ज्यामितीय समरूपता के लिए विशिष्ट है। स्टीरियोकेमिस्ट्री की मूल बातें
पाठ के दौरान, आप समावयवता के प्रकारों का एक सामान्य विचार प्राप्त करेंगे, जानें कि समावयवी क्या है। कार्बनिक रसायन विज्ञान में आइसोमेरिज्म के प्रकारों के बारे में जानें: संरचनात्मक और स्थानिक (स्टीरियोइसोमेरिज्म)। पदार्थों के संरचनात्मक सूत्रों का उपयोग करते हुए, संरचनात्मक समरूपता (स्थिति के कंकाल और समरूपता) की उप-प्रजातियों पर विचार करें, स्थानिक समरूपता की किस्मों के बारे में जानें: ज्यामितीय और ऑप्टिकल।
विषय: कार्बनिक रसायन विज्ञान का परिचय
पाठ: समरूपता। समरूपता के प्रकार। संरचनात्मक समरूपता, ज्यामितीय, ऑप्टिकल
1. समावयवता क्या है
कार्बनिक पदार्थों का वर्णन करने वाले पहले के प्रकार के सूत्र बताते हैं कि कई अलग-अलग संरचनात्मक सूत्र एक आणविक के अनुरूप हो सकते हैं।
उदाहरण के लिए, आणविक सूत्र सी2एच6हेअनुरूप दो पदार्थविभिन्न संरचनात्मक सूत्रों के साथ - एथिल अल्कोहल और डाइमिथाइल ईथर। चावल। 1.
एथिल अल्कोहल एक तरल है जो हाइड्रोजन की रिहाई के साथ धातु सोडियम के साथ प्रतिक्रिया करता है, + 78.50C पर उबलता है। उन्हीं शर्तों के तहत, डाइमिथाइल ईथर, एक गैस जो सोडियम के साथ प्रतिक्रिया नहीं करती है, -230C पर उबलती है।
ये पदार्थ अपनी संरचना में भिन्न होते हैं - एक ही आणविक सूत्र विभिन्न पदार्थों से मेल खाता है।
चावल। 1. इंटरक्लास आइसोमेरिज्म
एक ही संरचना वाले पदार्थों के अस्तित्व की घटना, लेकिन विभिन्न संरचना और इसलिए विभिन्न गुणों को आइसोमेरिज्म कहा जाता है (ग्रीक शब्द "आइसो" - "बराबर" और "मेरोस" - "भाग", "शेयर") से।
समरूपता के प्रकार
विभिन्न प्रकार के आइसोमेरिज्म हैं।
2. इंटरक्लास आइसोमेरिज्म
संरचनात्मक समरूपता एक अणु में परमाणुओं के कनेक्शन के एक अलग क्रम से जुड़ा हुआ है।
इथेनॉल और डाइमिथाइल ईथर संरचनात्मक आइसोमर हैं। चूंकि वे कार्बनिक यौगिकों के विभिन्न वर्गों से संबंधित हैं, इसलिए इस प्रकार के संरचनात्मक समरूपता को कहा जाता है इंटरक्लास भी... चावल। 1.
3. कार्बन कंकाल समरूपता
संरचनात्मक आइसोमर्स यौगिकों के एक वर्ग के भीतर भी हो सकते हैं, उदाहरण के लिए, तीन अलग-अलग हाइड्रोकार्बन सूत्र C5H12 के अनुरूप हैं। यह कार्बन कंकाल समरूपता... चावल। 2.

चावल। 2 पदार्थों के उदाहरण - संरचनात्मक समावयवी
4. स्थिति समरूपता
एक ही कार्बन कंकाल वाले संरचनात्मक समावयवी होते हैं, जो हाइड्रोजन के स्थान पर कई बंधों (डबल और ट्रिपल) या परमाणुओं की स्थिति में भिन्न होते हैं। इस प्रकार के संरचनात्मक समरूपता को कहा जाता है स्थिति का समरूपता.
चावल। 3. संरचनात्मक स्थिति समरूपता
5. स्थानिक समरूपता
केवल एकल बंध वाले अणुओं में, कमरे के तापमान पर, बंधों के चारों ओर आणविक अंशों का लगभग मुक्त घूमना संभव है, और, उदाहरण के लिए, 1,2-डाइक्लोरोइथेन के सूत्रों की सभी छवियां समतुल्य हैं। चावल। 4

चावल। 4. एकल बंध के चारों ओर क्लोरीन परमाणुओं की स्थिति
यदि घूर्णन बाधित होता है, उदाहरण के लिए, चक्रीय अणु में या दोहरे बंधन के साथ, तो ज्यामितीय या सीआईएस-ट्रांस आइसोमेरिज्म।सीआईएस आइसोमर्स में, प्रतिस्थापन रिंग प्लेन या डबल बॉन्ड के एक तरफ, ट्रांस आइसोमर्स में, विपरीत दिशा में होते हैं।
सीआईएस-ट्रांस आइसोमर्स तब मौजूद होते हैं जब एक कार्बन परमाणु बाध्य होता है दो अलगउप. चावल। 5.



चावल। 5. सीआईएस - और ट्रांस - आइसोमर्स
6. ऑप्टिकल आइसोमेरिज्म
एक अन्य प्रकार का समावयवता इस तथ्य के कारण उत्पन्न होता है कि चार एकल बंधों वाला एक कार्बन परमाणु अपने स्थानापन्नों के साथ एक स्थानिक संरचना बनाता है - एक टेट्राहेड्रोन। यदि एक अणु में कम से कम एक कार्बन परमाणु चार अलग-अलग पदार्थों से बंधा होता है, तो ऑप्टिकल आइसोमेरिज्म... ऐसे अणु अपने दर्पण प्रतिबिम्ब से मेल नहीं खाते। इस संपत्ति को चिरायता कहा जाता है - ग्रीक चीर से - "हाथ"। चावल। 6. ऑप्टिकल आइसोमेरिज्म कई अणुओं की विशेषता है जो जीवित जीवों को बनाते हैं।
|
|
|
चावल। 6. ऑप्टिकल आइसोमर्स के उदाहरण
प्रकाशिक समावयवता को भी कहते हैं एनैन्टीओमेरिज्म(ग्रीक एंन्तिओस से - "विपरीत" और मेरोस - "भाग"), और ऑप्टिकल आइसोमर्स - एनंटीओमर... Enantiomers वैकल्पिक रूप से सक्रिय हैं, वे एक ही कोण से प्रकाश के ध्रुवीकरण के विमान को घुमाते हैं, लेकिन विपरीत दिशाओं में: डी-, या (+) - आइसोमर, - दाईं ओर, एल, या (-) - आइसोमर, - बाईं ओर। समान मात्रा में एनैन्टीओमर का मिश्रण, जिसे रेसमेट कहा जाता है, वैकल्पिक रूप से निष्क्रिय है और प्रतीक द्वारा दर्शाया गया है डी, एल-या (±)।
पाठ सारांश
पाठ के दौरान, आपने समावयवता के प्रकारों का एक सामान्य विचार प्राप्त किया, एक समावयवी क्या है। हमने कार्बनिक रसायन विज्ञान में समरूपता के प्रकारों के बारे में सीखा: संरचनात्मक और स्थानिक (स्टीरियोइसोमेरिज्म)। पदार्थों के संरचनात्मक सूत्रों की मदद से, हमने संरचनात्मक समरूपता (स्थितियों के कंकाल और समरूपता) की उप-प्रजातियों की जांच की, स्थानिक समरूपता की किस्मों से परिचित हुए: ज्यामितीय और ऑप्टिकल।
ग्रन्थसूची
1. रुडज़ाइटिस जी.ई. रसायन विज्ञान। सामान्य रसायन विज्ञान की मूल बातें। ग्रेड 10: शैक्षणिक संस्थानों के लिए पाठ्यपुस्तक: बुनियादी स्तर / जी.ई. रुडज़ाइटिस, एफ.जी. फेल्डमैन। - 14वां संस्करण। - एम।: शिक्षा, 2012।
2. रसायन। ग्रेड 10। प्रोफाइल स्तर: पाठ्यपुस्तक। सामान्य शिक्षा के लिए। संस्थान / वी.वी. एरेमिन, एन.ई. कुज़्मेंको, वी.वी. लुनिन और अन्य - एम।: बस्टर्ड, 2008 .-- 463 पी।
3. रसायन। ग्रेड 11। प्रोफाइल स्तर: पाठ्यपुस्तक। सामान्य शिक्षा के लिए। संस्थान / वी.वी. एरेमिन, एन.ई. कुज़्मेंको, वी.वी. लुनिन और अन्य - एम।: बस्टर्ड, 2010 .-- 462 पी।
4. खोमचेंको जीपी, खोमचेंको आईजी विश्वविद्यालयों में प्रवेश करने वालों के लिए रसायन विज्ञान में समस्याओं का संग्रह। - चौथा संस्करण। - एम।: आरआईए "न्यू वेव": प्रकाशक उमेरेनकोव, 2012। - 278 पी।
1. इंटरनेटुरोक। रु.
2. कार्बनिक रसायन।
होम वर्क
1. नंबर 1,2 (पी। 39) रुडजाइटिस जी। ये। रसायन। सामान्य रसायन विज्ञान की मूल बातें। ग्रेड 10: शैक्षणिक संस्थानों के लिए पाठ्यपुस्तक: बुनियादी स्तर / जी.ई. रुडज़ाइटिस, एफ.जी. फेल्डमैन। - 14वां संस्करण। - एम।: शिक्षा, 2012।
2. एथिलीन श्रेणी के हाइड्रोकार्बन में आइसोमर्स की संख्या संतृप्त हाइड्रोकार्बन से अधिक क्यों होती है?
3. कौन से हाइड्रोकार्बन में स्थानिक आइसोमर होते हैं?
सिमुलेटर के साथ सामग्री को सुरक्षित करें
ट्रेनर 1 ट्रेनर 2 ट्रेनर 3

 I. आइसोमेरिज्म (ग्रीक आइसोस से - बराबर) बर्जेलियस, 1830 आइसोमर्स ऐसे पदार्थ हैं जिनका आणविक सूत्र (समान गुणात्मक और मात्रात्मक संरचना) है, लेकिन बाध्यकारी परमाणुओं के अनुक्रम में भिन्न हैं और (या) अंतरिक्ष में उनकी व्यवस्था है और है विभिन्न गुण।
I. आइसोमेरिज्म (ग्रीक आइसोस से - बराबर) बर्जेलियस, 1830 आइसोमर्स ऐसे पदार्थ हैं जिनका आणविक सूत्र (समान गुणात्मक और मात्रात्मक संरचना) है, लेकिन बाध्यकारी परमाणुओं के अनुक्रम में भिन्न हैं और (या) अंतरिक्ष में उनकी व्यवस्था है और है विभिन्न गुण।
 बर्सेलियस, जेन्स जैकब 1779 - 1848 प्रसिद्ध स्वीडिश रसायनज्ञ। 1807 से स्टॉकहोम में मेडिसिन और फार्मेसी के प्रोफेसर।
बर्सेलियस, जेन्स जैकब 1779 - 1848 प्रसिद्ध स्वीडिश रसायनज्ञ। 1807 से स्टॉकहोम में मेडिसिन और फार्मेसी के प्रोफेसर।
 सी 2 एच 6 ओ डाइमिथाइल ईथर बीपी = -24 सी एथिल अल्कोहल बीपी = 78 सी एन-ब्यूटेन बीपी = -0.5 सी सी 4 एच 10 आइसोब्यूटेन बीपी = -11.7 सी
सी 2 एच 6 ओ डाइमिथाइल ईथर बीपी = -24 सी एथिल अल्कोहल बीपी = 78 सी एन-ब्यूटेन बीपी = -0.5 सी सी 4 एच 10 आइसोब्यूटेन बीपी = -11.7 सी
 एल्केन्स की श्रृंखला में आइसोमर्स की संख्या नाम फॉर्मूला संख्या आइसोमर्स का फॉर्मूला नाम आइसोमर्स की संख्या सीएच 4 मीथेन 1 सी 11 एच 24 अघोषित 159 सी 2 एच 6 ईथेन 1 सी 12 एच 26 डोडेकेन 355 सी 3 एच 8 प्रोपेन 1 सी 13 एच 28 ट्राइडेकेन 802 सी 4 एच 10 ब्यूटेन 2 सी 14 एच 30 टेट्राडेकेन 1 858 सी 5 एच 12 पेंटेन 3 सी 15 एच 32 पेंटाडेकेन 4 347 सी 6 एच 14 हेक्सेन 5 सी 20 एच 42 ईकोसेन सी 7 एच 16 हेप्टेन 9 सी 25 एच 52 पेंटाकोसेन 36 797 588 सी 8 एच 18 ओकटाइन 18 सी 30 एच 62 ट्रायकॉन्टेन 4 111 846 763 सी 9 एच 20 नॉनन 35 सी 40 एच 82 टेट्राकॉन्टेन 62 491 178 805 831 सी 10 एच 22 डीकेन 75 366 319
एल्केन्स की श्रृंखला में आइसोमर्स की संख्या नाम फॉर्मूला संख्या आइसोमर्स का फॉर्मूला नाम आइसोमर्स की संख्या सीएच 4 मीथेन 1 सी 11 एच 24 अघोषित 159 सी 2 एच 6 ईथेन 1 सी 12 एच 26 डोडेकेन 355 सी 3 एच 8 प्रोपेन 1 सी 13 एच 28 ट्राइडेकेन 802 सी 4 एच 10 ब्यूटेन 2 सी 14 एच 30 टेट्राडेकेन 1 858 सी 5 एच 12 पेंटेन 3 सी 15 एच 32 पेंटाडेकेन 4 347 सी 6 एच 14 हेक्सेन 5 सी 20 एच 42 ईकोसेन सी 7 एच 16 हेप्टेन 9 सी 25 एच 52 पेंटाकोसेन 36 797 588 सी 8 एच 18 ओकटाइन 18 सी 30 एच 62 ट्रायकॉन्टेन 4 111 846 763 सी 9 एच 20 नॉनन 35 सी 40 एच 82 टेट्राकॉन्टेन 62 491 178 805 831 सी 10 एच 22 डीकेन 75 366 319
 द्वितीय. समान कार्यात्मक समूहों के साथ एक ही संरचना के कार्बनिक यौगिकों के होमोलॉजी समूह, कार्बन श्रृंखला में -CH 2 - समूहों की संख्या में एक दूसरे से भिन्न होते हैं, एक समरूप श्रृंखला बनाते हैं। मीथेन की समजातीय श्रृंखला
द्वितीय. समान कार्यात्मक समूहों के साथ एक ही संरचना के कार्बनिक यौगिकों के होमोलॉजी समूह, कार्बन श्रृंखला में -CH 2 - समूहों की संख्या में एक दूसरे से भिन्न होते हैं, एक समरूप श्रृंखला बनाते हैं। मीथेन की समजातीय श्रृंखला
 III. आइसोलॉजिकल पंक्तियाँ। ये कार्बन परमाणुओं की समान संख्या से निर्मित पदार्थों की एक श्रृंखला है, लेकिन एच परमाणुओं की मात्रात्मक संरचना में भिन्न है, अर्थात, श्रृंखला के प्रत्येक अगले सदस्य में पिछले एक की तुलना में 2 एच परमाणु कम होते हैं: सी 2 एच 6 ईथेन सी 2 एच 4 एथिलीन सी 2 एच 2 एसिटिलीन
III. आइसोलॉजिकल पंक्तियाँ। ये कार्बन परमाणुओं की समान संख्या से निर्मित पदार्थों की एक श्रृंखला है, लेकिन एच परमाणुओं की मात्रात्मक संरचना में भिन्न है, अर्थात, श्रृंखला के प्रत्येक अगले सदस्य में पिछले एक की तुलना में 2 एच परमाणु कम होते हैं: सी 2 एच 6 ईथेन सी 2 एच 4 एथिलीन सी 2 एच 2 एसिटिलीन






 स्ट्रक्चरल आइसोमेरिज्म 3. टॉटोमेरिज्म (प्रोटोट्रोपिक या डायनेमिक आइसोमेरिज्म) टॉटोमेरिज्म (ग्रीक ταύτίς से - वही और μέρος - माप) दो आइसोमेरिक रूपों के सह-अस्तित्व की घटना है जो मोबाइल संतुलन में हैं और एक दूसरे में अनायास बदल सकते हैं।
स्ट्रक्चरल आइसोमेरिज्म 3. टॉटोमेरिज्म (प्रोटोट्रोपिक या डायनेमिक आइसोमेरिज्म) टॉटोमेरिज्म (ग्रीक ταύτίς से - वही और μέρος - माप) दो आइसोमेरिक रूपों के सह-अस्तित्व की घटना है जो मोबाइल संतुलन में हैं और एक दूसरे में अनायास बदल सकते हैं।







Src = "https://present5.com/presentation/73124296_273676330/image-22.jpg" alt = "(! LANG: Conformation> C ------- C Conformation> C ------- C
 ज्यामितीय समरूपता ज्यामितीय समावयवी- अणु में बंधों का एक ही क्रम (अनुक्रम) होता है, लेकिन दोहरे बंधन या छोटे चक्र के तल के सापेक्ष अंतरिक्ष में परमाणुओं (समूहों) की व्यवस्था में भिन्न होता है।
ज्यामितीय समरूपता ज्यामितीय समावयवी- अणु में बंधों का एक ही क्रम (अनुक्रम) होता है, लेकिन दोहरे बंधन या छोटे चक्र के तल के सापेक्ष अंतरिक्ष में परमाणुओं (समूहों) की व्यवस्था में भिन्न होता है।
Src = "https://present5.com/presentation/73124296_273676330/image-24.jpg" alt = "(! LANG: ब्यूटेन-2 के सीआईएस और ट्रांस आइसोमर्स प्रत्येक परमाणु> सी = सी सीआईएस और ट्रांस आइसोमर्स ब्यूटेन- 2 प्रत्येक परमाणु> सी = सी
 "इस पर और दूसरी तरफ" लीटा सिस्लीटानिया नदी का - ऑस्ट्रियाई मुकुट की भूमि का नाम; लाल रंग में दिखाया गया है; 1867 -1918 अनुवादित - हंगेरियन मुकुट की भूमि का नाम; हरे रंग में दिखाया गया है
"इस पर और दूसरी तरफ" लीटा सिस्लीटानिया नदी का - ऑस्ट्रियाई मुकुट की भूमि का नाम; लाल रंग में दिखाया गया है; 1867 -1918 अनुवादित - हंगेरियन मुकुट की भूमि का नाम; हरे रंग में दिखाया गया है




 ई, जेड-नामकरण 2 1 ई-1-नाइट्रो-1-ब्रोमो-2-क्लोरोपेंटेन 1 2 जेड-1-नाइट्रो-1-ब्रोमो-2-क्लोरोपेंटेन 1. काहन-इंगोल्ड-प्रीलॉग नियमों का उपयोग करते हुए, सापेक्ष पूर्वता निर्धारित करें प्रतिस्थापन के, एक दोहरे बंधन से जुड़े और उन्हें पूर्वता संख्या 1 या 2 दें।
ई, जेड-नामकरण 2 1 ई-1-नाइट्रो-1-ब्रोमो-2-क्लोरोपेंटेन 1 2 जेड-1-नाइट्रो-1-ब्रोमो-2-क्लोरोपेंटेन 1. काहन-इंगोल्ड-प्रीलॉग नियमों का उपयोग करते हुए, सापेक्ष पूर्वता निर्धारित करें प्रतिस्थापन के, एक दोहरे बंधन से जुड़े और उन्हें पूर्वता संख्या 1 या 2 दें।
 a) उच्च परमाणु क्रमांक वाला परमाणु कम संख्या वाले परमाणु के सापेक्ष उच्चतम होता है। b) यदि दो परमाणु समस्थानिक हैं, तो बड़ी द्रव्यमान संख्या वाले परमाणु को लाभ होता है। 2. यदि दो सबसे वरिष्ठ समूह -बॉन्ड के तल के एक ही तरफ स्थित हैं, तो प्रतिस्थापन के विन्यास को प्रतीक Z द्वारा दर्शाया जाता है। (जर्मन zusammen से एक साथ) यदि ये समूह विपरीत पक्षों पर हैं -बॉन्ड का तल, फिर कॉन्फ़िगरेशन को प्रतीक E द्वारा दर्शाया जाता है (जर्मन Entgegen विपरीत से)
a) उच्च परमाणु क्रमांक वाला परमाणु कम संख्या वाले परमाणु के सापेक्ष उच्चतम होता है। b) यदि दो परमाणु समस्थानिक हैं, तो बड़ी द्रव्यमान संख्या वाले परमाणु को लाभ होता है। 2. यदि दो सबसे वरिष्ठ समूह -बॉन्ड के तल के एक ही तरफ स्थित हैं, तो प्रतिस्थापन के विन्यास को प्रतीक Z द्वारा दर्शाया जाता है। (जर्मन zusammen से एक साथ) यदि ये समूह विपरीत पक्षों पर हैं -बॉन्ड का तल, फिर कॉन्फ़िगरेशन को प्रतीक E द्वारा दर्शाया जाता है (जर्मन Entgegen विपरीत से)



 लुई पाश्चर (27.12.1822-28.09.1895) फ्रांसीसी रसायनज्ञ, 19वीं शताब्दी के महानतम शोधकर्ता "असमानता वह है जो कार्बनिक दुनिया को अकार्बनिक से अलग करती है" (इस कानून ने स्टीरियोकेमिस्ट्री की नींव रखी)। असममित क्रिस्टल में ध्रुवीकृत प्रकाश को घुमाने की क्षमता होती है।
लुई पाश्चर (27.12.1822-28.09.1895) फ्रांसीसी रसायनज्ञ, 19वीं शताब्दी के महानतम शोधकर्ता "असमानता वह है जो कार्बनिक दुनिया को अकार्बनिक से अलग करती है" (इस कानून ने स्टीरियोकेमिस्ट्री की नींव रखी)। असममित क्रिस्टल में ध्रुवीकृत प्रकाश को घुमाने की क्षमता होती है।
 Enantiomers स्थानिक आइसोमर होते हैं, जिनमें से अणु एक दूसरे से एक वस्तु और एक असंगत दर्पण छवि के रूप में संबंधित होते हैं। (ग्रीक enantios से - विपरीत)।
Enantiomers स्थानिक आइसोमर होते हैं, जिनमें से अणु एक दूसरे से एक वस्तु और एक असंगत दर्पण छवि के रूप में संबंधित होते हैं। (ग्रीक enantios से - विपरीत)।
 चिरलिटी (अंग्रेजी चिरलिटी, ग्रीक चीयर-हैंड से), रसायन विज्ञान में एक अवधारणा जो किसी वस्तु की संपत्ति को एक आदर्श फ्लैट दर्पण में उसके प्रतिबिंब के साथ असंगत होने की विशेषता है।
चिरलिटी (अंग्रेजी चिरलिटी, ग्रीक चीयर-हैंड से), रसायन विज्ञान में एक अवधारणा जो किसी वस्तु की संपत्ति को एक आदर्श फ्लैट दर्पण में उसके प्रतिबिंब के साथ असंगत होने की विशेषता है।






 फिशर एमिल हरमन (9.10.1852, ईस्किरचेन, - 15.7.1919, बर्लिन), जर्मन कार्बनिक रसायनज्ञ और जैव रसायनज्ञ।
फिशर एमिल हरमन (9.10.1852, ईस्किरचेन, - 15.7.1919, बर्लिन), जर्मन कार्बनिक रसायनज्ञ और जैव रसायनज्ञ।
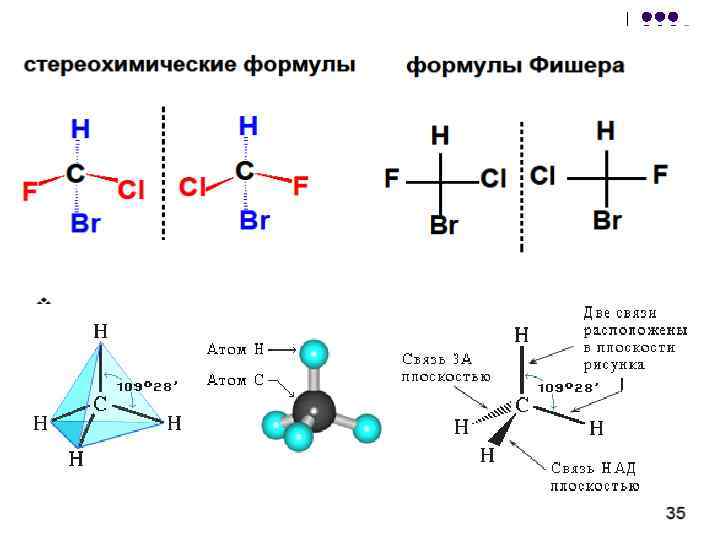


 फिशर के अनुमानों को रूपांतरित किया जा सकता है: l l 1. प्रतिस्थापकों के क्रमपरिवर्तन की एक सम संख्या सूत्र को नहीं बदलती; 2. प्रतिस्थापन के क्रमपरिवर्तन की एक विषम संख्या एंटीपोड (enantiomer) सूत्र की ओर ले जाती है; 3. सूत्र को 90 या 270 तक घुमाने के साथ-साथ इस विमान से सूत्र को निकालने के लिए मना किया गया है (इन क्रियाओं से एंटीपोड फॉर्मूला होता है); 4. ड्राइंग के तल में पूरे सूत्र को 180 तक घुमाने की अनुमति है;
फिशर के अनुमानों को रूपांतरित किया जा सकता है: l l 1. प्रतिस्थापकों के क्रमपरिवर्तन की एक सम संख्या सूत्र को नहीं बदलती; 2. प्रतिस्थापन के क्रमपरिवर्तन की एक विषम संख्या एंटीपोड (enantiomer) सूत्र की ओर ले जाती है; 3. सूत्र को 90 या 270 तक घुमाने के साथ-साथ इस विमान से सूत्र को निकालने के लिए मना किया गया है (इन क्रियाओं से एंटीपोड फॉर्मूला होता है); 4. ड्राइंग के तल में पूरे सूत्र को 180 तक घुमाने की अनुमति है;
 1906 में सापेक्ष विन्यास, एमए रोजानोव एल- और डी-आइसोमर्स के सुझाव पर (लैटिन शब्द लावस से - बाएं और डेक्सटर - दाएं)।
1906 में सापेक्ष विन्यास, एमए रोजानोव एल- और डी-आइसोमर्स के सुझाव पर (लैटिन शब्द लावस से - बाएं और डेक्सटर - दाएं)।



 कान - इंगोल्ड - प्रीलॉग सिस्टम? रॉबर्ट सिडनी कान इंगोल्ड क्रिस्टोफर प्रीलॉग व्लादिमीर (09.06.1899-15.09.1981) (28.10.1893-8.10.1970) (23.07.1906-07.01.1998) (ग्रेट ब्रिटेन) (स्विट्जरलैंड)
कान - इंगोल्ड - प्रीलॉग सिस्टम? रॉबर्ट सिडनी कान इंगोल्ड क्रिस्टोफर प्रीलॉग व्लादिमीर (09.06.1899-15.09.1981) (28.10.1893-8.10.1970) (23.07.1906-07.01.1998) (ग्रेट ब्रिटेन) (स्विट्जरलैंड)



 ऑप्टिकल आइसोमर्स की कुल संख्या सूत्र N = 2 n द्वारा निर्धारित की जाती है, n चिरल केंद्रों की संख्या है। I III IV 2-एमिनो-3-हाइड्रॉक्सीबुटानोइक एसिड
ऑप्टिकल आइसोमर्स की कुल संख्या सूत्र N = 2 n द्वारा निर्धारित की जाती है, n चिरल केंद्रों की संख्या है। I III IV 2-एमिनो-3-हाइड्रॉक्सीबुटानोइक एसिड
 टार्टरिक एसिड I III IV एरिथ्रो थ्रेओ एपिमर्स डायस्टेरेमर्स हैं जो केवल एक असममित केंद्र के विन्यास में भिन्न होते हैं
टार्टरिक एसिड I III IV एरिथ्रो थ्रेओ एपिमर्स डायस्टेरेमर्स हैं जो केवल एक असममित केंद्र के विन्यास में भिन्न होते हैं

 रेसमेट (लैटिन रेसमस से - अंगूर)। डी - और एल - स्टेरिसोमर की समतुल्य मात्रा को मिलाते समय, वैकल्पिक रूप से निष्क्रिय मिश्रण बनते हैं, जिन्हें रेसमिक एस (लैटिन सिनिस्टर - लेफ्ट से) और आर (लैटिन रेक्टस - राइट) कहा जाता है; रेसमेट को आरएस प्रतीक द्वारा नामित किया गया है। नस्लीय मिश्रण का पाचन: 1. यांत्रिक विधि (पाश्चर की विधि)। 2. माइक्रोबायोलॉजिकल विधि 3. एंजाइमेटिक विधि। 4. रासायनिक विधि। एफ़िनिटी क्रोमेटोग्राफ़ी
रेसमेट (लैटिन रेसमस से - अंगूर)। डी - और एल - स्टेरिसोमर की समतुल्य मात्रा को मिलाते समय, वैकल्पिक रूप से निष्क्रिय मिश्रण बनते हैं, जिन्हें रेसमिक एस (लैटिन सिनिस्टर - लेफ्ट से) और आर (लैटिन रेक्टस - राइट) कहा जाता है; रेसमेट को आरएस प्रतीक द्वारा नामित किया गया है। नस्लीय मिश्रण का पाचन: 1. यांत्रिक विधि (पाश्चर की विधि)। 2. माइक्रोबायोलॉजिकल विधि 3. एंजाइमेटिक विधि। 4. रासायनिक विधि। एफ़िनिटी क्रोमेटोग्राफ़ी
 जैविक गतिविधि की अभिव्यक्ति के साथ स्टीरियोकेमिकल संरचना का संबंध। एड्रेनालाईन, एपिनेफ्रीन आईयूपीएसी: 1 - (3, 4-डायहाइड्रोक्सीफेनिल) -2 मेथिलैमिनोइथेनॉल - जानवरों और मनुष्यों के अधिवृक्क मज्जा का एक हार्मोन। शीत-रक्त तंत्रिका तंत्र का मध्यस्थ। एड्रेनालाईन के दो एनेंटिओमर्स में से, आर (-) एड्रेनालाईन सबसे बड़ी औषधीय गतिविधि प्रदर्शित करता है।
जैविक गतिविधि की अभिव्यक्ति के साथ स्टीरियोकेमिकल संरचना का संबंध। एड्रेनालाईन, एपिनेफ्रीन आईयूपीएसी: 1 - (3, 4-डायहाइड्रोक्सीफेनिल) -2 मेथिलैमिनोइथेनॉल - जानवरों और मनुष्यों के अधिवृक्क मज्जा का एक हार्मोन। शीत-रक्त तंत्रिका तंत्र का मध्यस्थ। एड्रेनालाईन के दो एनेंटिओमर्स में से, आर (-) एड्रेनालाईन सबसे बड़ी औषधीय गतिविधि प्रदर्शित करता है।

 जैविक गतिविधि की अभिव्यक्ति के साथ स्टीरियोकेमिकल संरचना का संबंध। डेक्सट्रोरोटेटरी आइसोप्रोपिलएड्रेनालाईन (इज़ाड्रिन) अपने लीवरोटेटरी एनैन्टीओमर की तुलना में 800 गुना अधिक मजबूत ब्रोन्कोडायलेटरी प्रभाव प्रदर्शित करता है।
जैविक गतिविधि की अभिव्यक्ति के साथ स्टीरियोकेमिकल संरचना का संबंध। डेक्सट्रोरोटेटरी आइसोप्रोपिलएड्रेनालाईन (इज़ाड्रिन) अपने लीवरोटेटरी एनैन्टीओमर की तुलना में 800 गुना अधिक मजबूत ब्रोन्कोडायलेटरी प्रभाव प्रदर्शित करता है।

 डायस्टेरोमर्स स्थानिक आइसोमर्स हैं, जिनके अणु एक दूसरे से एक वस्तु और एक असंगत दर्पण छवि के रूप में संबंधित नहीं हैं।
डायस्टेरोमर्स स्थानिक आइसोमर्स हैं, जिनके अणु एक दूसरे से एक वस्तु और एक असंगत दर्पण छवि के रूप में संबंधित नहीं हैं।

 गठनात्मक समरूपता एक दूसरे के सापेक्ष एक ही अणु के भागों की विभिन्न व्यवस्था के परिणामस्वरूप होता है, इन भागों को दो परमाणुओं को जोड़ने वाले एक साधारण सी-सी बंधन के चारों ओर घुमाकर प्राप्त किया जाता है।
गठनात्मक समरूपता एक दूसरे के सापेक्ष एक ही अणु के भागों की विभिन्न व्यवस्था के परिणामस्वरूप होता है, इन भागों को दो परमाणुओं को जोड़ने वाले एक साधारण सी-सी बंधन के चारों ओर घुमाकर प्राप्त किया जाता है।
 (Lat.conformatio से - आकार, स्थान), अणुओं द्वारा लिए गए विभिन्न स्थानिक रूप, चारों ओर अलग-अलग टुकड़ों के मुक्त घूमने के परिणामस्वरूप सरल सी-सीसम्बन्ध।
(Lat.conformatio से - आकार, स्थान), अणुओं द्वारा लिए गए विभिन्न स्थानिक रूप, चारों ओर अलग-अलग टुकड़ों के मुक्त घूमने के परिणामस्वरूप सरल सी-सीसम्बन्ध।







 69% 31% वैन डेर वाल्स तनाव बड़ी मात्रा में वैलेंस अनबाउंड प्रतिस्थापन के बीच प्रतिकारक बलों के कारण होता है।
69% 31% वैन डेर वाल्स तनाव बड़ी मात्रा में वैलेंस अनबाउंड प्रतिस्थापन के बीच प्रतिकारक बलों के कारण होता है।
लिगैंड आइसोमेरिज्म
लिगैंड आइसोमेरिज्मएक संपर्क में विभाजित (जो निर्धारित किया जाता है विभिन्न प्रकारएक ही लिगैंड का समन्वय), और लिगैंड का वास्तविक समरूपता।
बॉन्ड आइसोमेरिज्म के उदाहरण कोबाल्ट (III) के नाइट्रो और नाइट्राइट कॉम्प्लेक्स का अस्तित्व K 3 और K 3 के साथ है, जिसमें NO 2 - लिगैंड का समन्वय क्रमशः नाइट्रोजन परमाणु या ऑक्सीजन परमाणु के माध्यम से किया जाता है। . एक अन्य उदाहरण थायोसाइनेट आयन एनसीएस का समन्वय है - नाइट्रोजन परमाणु के माध्यम से या सल्फर परमाणु के माध्यम से, थियोसाइनाटो-एन- या थियोसाइनाटो-एस-कॉम्प्लेक्स के गठन के साथ।
इसके अलावा, एक जटिल संरचना (उदाहरण के लिए, अमीनो एसिड) वाले लिगैंड स्वयं आइसोमर्स बना सकते हैं, जिसके समन्वय से विभिन्न गुणों के साथ एक ही संरचना के परिसरों का निर्माण होता है।
ज्यामितीय समरूपताएक दूसरे के सापेक्ष आंतरिक क्षेत्र में लिगैंड के असमान वितरण के कारण होता है। दुबारा िवनंतीकरनाज्यामितीय समरूपता कम से कम दो अलग-अलग लिगेंड के आंतरिक समन्वय क्षेत्र में उपस्थिति है। ज्यामितीय समरूपता मुख्य रूप से एक अष्टफलकीय संरचना के साथ जटिल यौगिकों में प्रकट होती है, एक सपाट वर्ग या वर्ग पिरामिड की संरचना।
टेट्राहेड्रल, त्रिकोणीय और रैखिक संरचनाओं वाले जटिल यौगिकों में ज्यामितीय आइसोमर्स नहीं होते हैं, क्योंकि दो के लिगैंड के स्थान विभिन्न प्रकारकेंद्रीय परमाणु के चारों ओर समतुल्य हैं।
एक फ्लैट वर्ग संरचना वाले कॉम्प्लेक्स, दो अलग-अलग लिगेंड एल और एल ′ की उपस्थिति में, पहले से ही दो आइसोमर (सीआईएस- और ट्रांस-) हो सकते हैं:
सीआईएस और ट्रांस आइसोमर्स वाले एक जटिल यौगिक का एक उदाहरण डाइक्लोरोडायमाइनप्लैटिनम (II) है:
ध्यान दें कि एक सपाट वर्ग संरचना के साथ संरचना के एक जटिल परिसर में आइसोमर्स नहीं हो सकते हैं: लिगैंड एल '' की स्थिति वर्ग के किसी भी कोने में समान रूप से संभावित है। जब दो अलग-अलग लिगैंड दिखाई देते हैं, तो दो आइसोमर्स (सीआईएस- और ट्रांस-) का अस्तित्व, गुणों में भिन्न, पहले से ही संभव है। इस प्रकार, सिस-डाइक्लोरोडायमाइनप्लैटिनम (II) नारंगी-पीले क्रिस्टल हैं, जो पानी में आसानी से घुलनशील हैं, और ट्रांस-डाइक्लोरोडायमाइनप्लाटिनम (II) हल्के पीले क्रिस्टल हैं, जिनकी पानी में घुलनशीलता सीआईएस आइसोमर की तुलना में कुछ कम है।
जैसे-जैसे आंतरिक गोले में विभिन्न लिगेंड की संख्या बढ़ती है, ज्यामितीय समावयवों की संख्या बढ़ती जाती है। नाइट्रो (हाइड्रॉक्सिलमाइन) अमाइन (पाइरीडीन) प्लैटिनम (II) Cl क्लोराइड के लिए, तीनों आइसोमर्स प्राप्त किए गए थे:
अष्टफलकीय संकुलों में अनेक समावयवी हो सकते हैं। यदि इस प्रकार के एक जटिल यौगिक में सभी छह लिगेंड समान () हैं या केवल एक अन्य सभी () से भिन्न है, तो एक दूसरे के संबंध में लिगैंड की अलग व्यवस्था की कोई संभावना नहीं है। उदाहरण के लिए, अष्टफलकीय यौगिकों में, अन्य पाँच L 'लिगैंडों के संबंध में L' लिगैंड की कोई भी स्थिति समतुल्य होगी और इसलिए यहाँ कोई समावयवी नहीं होना चाहिए:
उद्भव दोलिगैंड्स एल ′ इन अष्टभुजाकारजटिल यौगिक अस्तित्व की संभावना को जन्म देंगे दो ज्यामितीय समावयवी... इस मामले में, एक दूसरे के सापेक्ष लिगैंड्स L' को व्यवस्थित करने के दो अलग-अलग तरीके हैं। उदाहरण के लिए, डाइहाइड्रॉक्सोटेट्रामाइनकोबाल्ट (III) + धनायन में दो समावयवी होते हैं:
लिगैंड्स एच 3 एन और ओएच - की कुछ अन्य पारस्परिक व्यवस्था को खोजने की कोशिश करते समय, जो ऊपर बताए गए लोगों से अलग होगा, हम हमेशा पहले से दिए गए लोगों में से एक की संरचना में आएंगे।
परिसर में विभिन्न रासायनिक रचनाओं के साथ लिगैंड की संख्या में वृद्धि के साथ, ज्यामितीय आइसोमर्स की संख्या तेजी से बढ़ती है। प्रकार के यौगिकों में चार आइसोमर्स होंगे, और छह अलग-अलग लिगैंड वाले यौगिकों के लिए, ज्यामितीय आइसोमर्स की संख्या 15 तक पहुंच जाती है। ऐसे जटिल यौगिकों को अभी भी खराब समझा जाता है।
ज्यामितीय आइसोमर्स उनके भौतिक रासायनिक गुणों, जैसे रंग, घुलनशीलता, घनत्व, क्रिस्टल संरचना, आदि में काफी भिन्न होते हैं।
1. संरचनात्मक समरूपता।
2. गठनात्मक समरूपता।
3. ज्यामितीय समरूपता।
4. ऑप्टिकल आइसोमेरिज्म।
आइसोमरोंवे पदार्थ हैं जिनकी संरचना और आणविक भार समान हैं, लेकिन विभिन्न भौतिक और रासायनिक गुण हैं। आइसोमर्स के गुणों में अंतर उनके रासायनिक या स्थानिक संरचना में अंतर के कारण होता है। इस संबंध में, दो प्रकार के आइसोमेरिज्म प्रतिष्ठित हैं।
संवयविता
संरचनात्मक
स्थानिक
कार्बन कंकाल
विन्यास
गठनात्मक
कार्यात्मक की स्थिति
ऑप्टिकल
इंटरक्लास
ज्यामितिक
1. संरचनात्मक समरूपता
संरचनात्मक आइसोमर्स रासायनिक संरचना में भिन्न होते हैं, अर्थात। एक अणु में परमाणुओं के बीच बंधों की प्रकृति और अनुक्रम। संरचनात्मक आइसोमर्स शुद्ध रूप में पृथक होते हैं। वे व्यक्तिगत, स्थिर पदार्थों के रूप में मौजूद हैं, उनके पारस्परिक परिवर्तन के लिए, उच्च ऊर्जा की आवश्यकता होती है - लगभग 350 - 400 kJ / mol। केवल संरचनात्मक समावयवी - टॉटोमर्स - गतिशील संतुलन में हैं। कार्बनिक रसायन विज्ञान में टॉटोमेरिज्म एक सामान्य घटना है। एक अणु (कार्बोनिल यौगिक, एमाइन, हेटरोसायकल, आदि), इंट्रामोल्युलर इंटरैक्शन (कार्बोहाइड्रेट) में एक मोबाइल हाइड्रोजन परमाणु के हस्तांतरण के दौरान यह संभव है।
सभी संरचनात्मक समावयवों को संरचनात्मक सूत्रों के रूप में प्रस्तुत किया जाता है और उन्हें IUPAC नामकरण के अनुसार नामित किया जाता है। उदाहरण के लिए, संरचनात्मक आइसोमर्स संरचना С 4 Н 8 के अनुरूप हैं:
ए)विभिन्न कार्बन कंकाल के साथ
अशाखित सी-श्रृंखला - सीएच 3-सीएच 2-सीएच 2-सीएच = ओ (ब्यूटेनल, एल्डिहाइड) और
शाखित सी-चेन -
 (2-मिथाइलप्रोपेनल, एल्डिहाइड) या
(2-मिथाइलप्रोपेनल, एल्डिहाइड) या
चक्र -  (साइक्लोबुटानॉल, चक्रीय अल्कोहल);
(साइक्लोबुटानॉल, चक्रीय अल्कोहल);
बी)कार्यात्मक समूह की विभिन्न स्थिति के साथ
 ब्यूटेनोन-2, कीटोन;
ब्यूटेनोन-2, कीटोन;
वी)कार्यात्मक समूह की विभिन्न संरचना के साथ
 3-ब्यूटेनॉल-2, असंतृप्त अल्कोहल;
3-ब्यूटेनॉल-2, असंतृप्त अल्कोहल;
जी)मेटामेरिज्म
एक कार्यात्मक समूह के एक विषम परमाणु को कार्बन कंकाल (अंगूठी या श्रृंखला) में शामिल किया जा सकता है। इस प्रकार के समावयवता के संभावित समावयवों में से एक सीएच 3 -ओ-सीएच 2 -सीएच = सीएच 2 (3-मेथॉक्सीप्रोपीन-1, ईथर) है;
इ)टॉटोमेरिज़्म (कीटो-एनोल)
एनोल फॉर्म  कीटो फॉर्म
कीटो फॉर्म
टॉटोमर्स गतिशील संतुलन में हैं, जबकि अधिक स्थिर रूप, कीटो रूप, मिश्रण में प्रबल होता है।
सुगंधित यौगिकों के लिए, संरचनात्मक समरूपता को केवल पार्श्व श्रृंखला के लिए माना जाता है।
2. स्थानिक समरूपता (स्टीरियोइसोमेरिज्म)
स्थानिक आइसोमर्स में समान रासायनिक संरचना होती है, अणु में परमाणुओं की स्थानिक व्यवस्था में भिन्न होती है। यह अंतर भौतिक और रासायनिक गुणों में अंतर पैदा करता है। स्थानिक आइसोमर्स को विभिन्न अनुमानों या स्टीरियोकेमिकल फ़ार्मुलों के रूप में दर्शाया गया है। रसायन विज्ञान की वह शाखा जो यौगिकों के भौतिक और रासायनिक गुणों पर उनकी प्रतिक्रियाओं की दिशा और दर पर स्थानिक संरचना और इसके प्रभाव का अध्ययन करती है, स्टीरियोकेमिस्ट्री कहलाती है।
ए)गठनात्मक (घूर्णी) समरूपता
बॉन्ड एंगल या बॉन्ड की लंबाई को बदले बिना, कोई एक अणु के कई ज्यामितीय आकार (रूपांतरण) की कल्पना कर सकता है जो कार्बन टेट्राहेड्रा के पारस्परिक रोटेशन द्वारा उन्हें जोड़ने वाले -C-C बॉन्ड के चारों ओर एक दूसरे से भिन्न होते हैं। इस घूर्णन के परिणामस्वरूप घूर्णी समावयवी (कन्फर्मर्स) उत्पन्न होते हैं। विभिन्न कन्फर्मर्स की ऊर्जा समान नहीं होती है, लेकिन अधिकांश कार्बनिक यौगिकों के लिए अलग-अलग गठनात्मक आइसोमर्स को अलग करने वाला ऊर्जा अवरोध छोटा होता है। इसलिए, सामान्य परिस्थितियों में, एक नियम के रूप में, एक कड़ाई से परिभाषित संरचना में अणुओं को ठीक करना असंभव है। आमतौर पर, संतुलन में, कई गठनात्मक आइसोमर आसानी से एक दूसरे के सह-अस्तित्व में गुजरते हैं।
इथेन अणु के उदाहरण का उपयोग करके इमेजिंग के तरीकों और आइसोमर्स के नामकरण पर विचार किया जा सकता है। इसके लिए, कोई भी दो अनुरूपताओं के अस्तित्व का अनुमान लगा सकता है जो ऊर्जा में जितना संभव हो उतना भिन्न होता है, जिसे रूप में दर्शाया जा सकता है परिप्रेक्ष्य अनुमान(1) ("आरा चक्की") या अनुमान नया आदमी(2):

मंद रचना occluded रचना
परिप्रेक्ष्य प्रक्षेपण (1) में, -С कनेक्शन को दूरी में जाने की कल्पना की जानी चाहिए; बाईं ओर कार्बन परमाणु पर्यवेक्षक के करीब है, और दाईं ओर वाला उससे दूर है।
न्यूमैन प्रोजेक्शन (2) में, अणु को साथ में माना जाता है सी-सी लिंक... वृत्त के केंद्र से 120 ° के कोण पर विचलन करने वाली तीन रेखाएँ प्रेक्षक के निकटतम कार्बन परमाणु के बंधों को दर्शाती हैं; वृत्त से "बाहर निकली" रेखाएँ दूर के कार्बन परमाणु के बंधन हैं।
दायीं ओर दिखाई गई रचना कहलाती है अस्पष्ट ... यह नाम हमें याद दिलाता है कि दोनों CH3-समूहों के हाइड्रोजन परमाणु एक दूसरे के विपरीत हैं। बाधित रचना ने आंतरिक ऊर्जा में वृद्धि की है और इसलिए यह नुकसानदेह है। बाईं ओर दिखाई गई रचना कहलाती है संकोची , जिसका अर्थ है कि सीसी बांड के चारों ओर मुक्त रोटेशन इस स्थिति में "अवरुद्ध" है, अर्थात। इस रचना में अणु मुख्य रूप से मौजूद है।
किसी विशेष बंधन के चारों ओर एक अणु को पूरी तरह से घुमाने के लिए आवश्यक न्यूनतम ऊर्जा उस बंधन के लिए रोटेशन बाधा कहलाती है। एथेन जैसे अणु में घूर्णन अवरोध को परिवर्तन के रूप में व्यक्त किया जा सकता है संभावित ऊर्जाप्रणाली के डायहेड्रल (मरोड़ - τ) कोण में परिवर्तन के एक समारोह के रूप में अणु। ईथेन में सी-सी बांड के चारों ओर घूमने की ऊर्जा प्रोफ़ाइल चित्र 1 में दिखाई गई है। इथेन के दो रूपों को अलग करने वाला रोटेशन बैरियर लगभग 3 kcal / mol (12.6 kJ / mol) है। संभावित ऊर्जा वक्र की मिनिमा बाधित अनुरूपताओं के अनुरूप है, मैक्सिमा - ग्रहण किए गए लोगों के लिए। चूंकि कमरे के तापमान पर अणुओं के कुछ टकरावों की ऊर्जा 20 kcal / mol (लगभग 80 kJ / mol) तक पहुँच सकती है, 12.6 kJ / mol का यह अवरोध आसानी से दूर हो जाता है और इथेन में रोटेशन को मुक्त माना जाता है। सभी संभावित अनुरूपताओं के मिश्रण में, मंद अनुरूपता प्रबल होती है।

चित्र एक। ईथेन के अनुरूपण का संभावित ऊर्जा आरेख।
अधिक जटिल अणुओं के लिए, संभावित अनुरूपताओं की संख्या बढ़ जाती है। अभीतक के लिए तो एन-ब्यूटेन, छह अनुरूपताओं को पहले से ही चित्रित किया जा सकता है, जो केंद्रीय सी 2 - सी 3 बंधन के चारों ओर घूमते समय और सीएच 3 समूहों की पारस्परिक व्यवस्था में भिन्न होते हैं। ब्यूटेन के विभिन्न अवरुद्ध और मंद अनुरूपण ऊर्जा में भिन्न होते हैं। मंद रचनाएँ ऊर्जावान रूप से अधिक अनुकूल होती हैं।

ब्यूटेन में C 2 -C 3 बंध के चारों ओर घूमने की ऊर्जा प्रोफ़ाइल चित्र 2 में दिखाई गई है।

रेखा चित्र नम्बर 2। एन-ब्यूटेन अनुरूपताओं की संभावित ऊर्जा आरेख।
एक लंबी कार्बन श्रृंखला वाले अणु के लिए, गठनात्मक रूपों की संख्या बढ़ जाती है।
ऐलिसाइक्लिक यौगिकों के अणु को वलय के विभिन्न गठनात्मक रूपों की विशेषता है (उदाहरण के लिए, साइक्लोहेक्सेन के लिए) बंहदार कुरसी, स्नान, मोड़-फॉर्म)।
तो, रचना एक निश्चित विन्यास के साथ एक अणु के विभिन्न स्थानिक रूप हैं। कंफर्मर्स स्टीरियोइसोमेरिक संरचनाएं हैं जो संभावित ऊर्जा आरेख पर ऊर्जा मिनिमा के अनुरूप हैं, मोबाइल संतुलन में हैं और सरल σ-बॉन्ड के चारों ओर घुमाकर इंटरकनवर्सन में सक्षम हैं।
यदि इस तरह के परिवर्तनों की बाधा काफी अधिक हो जाती है, तो स्टीरियोइसोमेरिक रूपों को अलग किया जा सकता है (उदाहरण के लिए, वैकल्पिक रूप से सक्रिय बाइफिनाइल)। ऐसे मामलों में, कोई अब कंफर्मर्स के बारे में बात नहीं कर रहा है, बल्कि वास्तव में मौजूदा स्टीरियोइसोमर्स के बारे में है।
बी)ज्यामितीय समरूपता
ज्यामितीय समावयवों का एक अणु में अनुपस्थिति के परिणामस्वरूप होता है:
1. एक दूसरे के सापेक्ष कार्बन परमाणुओं का घूमना - सी = सी डबल बॉन्ड या चक्रीय संरचना की कठोरता का परिणाम;
2. एक दोहरे बंधन या चक्र के एक कार्बन परमाणु पर दो समान समूह।
कंफर्मर्स के विपरीत ज्यामितीय आइसोमर्स को शुद्ध रूप में अलग किया जा सकता है और व्यक्तिगत, स्थिर पदार्थों के रूप में मौजूद हो सकता है। उनके पारस्परिक परिवर्तन के लिए, एक उच्च ऊर्जा की आवश्यकता होती है - लगभग 125-170 kJ / mol (30-40 kcal / mol)।
सीआईएस-ट्रांस- (जेड, ई) आइसोमर्स हैं; सीआईएस- रूप ज्यामितीय समावयवी होते हैं जिनमें समान अवयव -बंध या वलय के तल के एक ओर स्थित होते हैं, ट्रान्स- रूप ज्यामितीय समावयवी होते हैं जिनमें समान प्रतिस्थापन -बंध या वलय के तल के विपरीत पक्षों पर स्थित होते हैं।
सबसे सरल उदाहरण ब्यूटेन-2 के समावयवी हैं, जो सिस-, ट्रांस-ज्यामितीय समावयवों के रूप में मौजूद हैं:


सीआईएस-ब्यूटेन-2 ट्रांस-ब्यूटेन-2
पिघलने का तापमान
138.9 0 सी - 105.6 0 सी
उबलता तापमान
3.72 0 सी 1.00 0 सी
घनत्व
1,2 - डाइक्लोरोसाइक्लोप्रोपेन सीआईएस-, ट्रांस-आइसोमर्स के रूप में मौजूद है:


सीआईएस-1,2-डाइक्लोरोसाइक्लोप्रोपेन ट्रांस-1,2-डाइक्लोरोसाइक्लोप्रोपेन
अधिक में मुश्किल मामलेलागू जेड, ई-नामकरण (कन्न का नामकरण, इंगोल्ड, प्रीलॉग - केआईपी, प्रतिनियुक्ति की वरिष्ठता का नामकरण)। संयोजन में
1-ब्रोमो -2-मिथाइल-1-क्लोरोब्यूटीन -1 (Br) (CI) C = C (CH 3) - CH 2 -CH 3 कार्बन परमाणुओं पर दोहरे बंधन वाले सभी पदार्थ अलग-अलग हैं; इसलिए, यह यौगिक Z-, E- ज्यामितीय समावयवों के रूप में मौजूद है:


E-1-ब्रोमो-2-मिथाइल-1-क्लोरोब्यूटीन-1 Z-1-ब्रोमो-2-मिथाइल-1-क्लोरोब्यूटीन-1।
आइसोमर के विन्यास को इंगित करने के लिए, इंगित करें एक डबल बॉन्ड (या साइकिल) पर वरिष्ठ प्रतिस्थापन की व्यवस्था - Z- (जर्मन ज़ुसामेन से - एक साथ) या ई- (जर्मन Entgegen से - विपरीत)।
जेड, ई-सिस्टम में, एक बड़ी क्रमिक (परमाणु) संख्या वाले पदार्थों को वरिष्ठ माना जाता है। यदि असंतृप्त कार्बन परमाणुओं से सीधे जुड़े परमाणु समान हैं, तो वे "दूसरी परत" पर जाते हैं, यदि आवश्यक हो, तो "तीसरी परत" आदि पर जाते हैं।
पहले प्रक्षेपण में, पुराने समूह दोहरे बंधन के सापेक्ष एक दूसरे के विपरीत होते हैं, इसलिए यह ई-आइसोमर है। दूसरे प्रक्षेपण में, पुराने समूह दोहरे बंधन (एक साथ) के एक तरफ स्थित होते हैं, इसलिए यह Z-आइसोमर है।
ज्यामितीय समावयवी प्रकृति में व्यापक हैं। उदाहरण के लिए, प्राकृतिक पॉलिमर रबर (सीआईएस-आइसोमर) और गुट्टा-पर्चा (ट्रांस-आइसोमर), प्राकृतिक फ्यूमरिक (ट्रांस-ब्यूटेनियोइक एसिड) और सिंथेटिक मैलिक (सीआईएस-ब्यूटेनियोइक एसिड) एसिड हैं, वसा की संरचना में - सिस-ओलिक , लिनोलिक, लिनोलेनिक एसिड।
वी)ऑप्टिकल समरूपता
कार्बनिक यौगिकों के अणु चिरल और अचिरल हो सकते हैं। चिरायता (ग्रीक शेइर - हाथ से) एक अणु की अपनी दर्पण छवि के साथ असंगति है।
चिरल पदार्थ प्रकाश के ध्रुवीकरण के विमान को घुमाने में सक्षम हैं। इस घटना को ऑप्टिकल गतिविधि कहा जाता है, और संबंधित पदार्थ - दृष्टिगत रूप से सक्रिय... वैकल्पिक रूप से सक्रिय पदार्थ जोड़े के रूप में पाए जाते हैं ऑप्टिकल एंटीपोड- आइसोमर्स, जिनमें से भौतिक और रासायनिक गुण सामान्य परिस्थितियों में समान होते हैं, एक के अपवाद के साथ - ध्रुवीकरण के विमान के रोटेशन का संकेत: ऑप्टिकल एंटीपोड्स में से एक ध्रुवीकरण के विमान को दाईं ओर विक्षेपित करता है (+, डेक्सट्रोरोटेटरी) आइसोमर), दूसरा - बाईं ओर (-, लेवोगाइरेट)। ऑप्टिकल एंटीपोड के विन्यास को एक उपकरण - एक पोलरिमीटर का उपयोग करके प्रयोगात्मक रूप से निर्धारित किया जा सकता है।
ऑप्टिकल आइसोमेरिज्म तब प्रकट होता है जब अणु में होता है असममित कार्बन परमाणु(अणु की चिरायता के अन्य कारण हैं)... यह एसपी 3 में कार्बन परमाणु का नाम है - संकरण और चार अलग-अलग पदार्थों के साथ जुड़ा हुआ है। असममित परमाणु के चारों ओर प्रतिस्थापकों की दो चतुष्फलकीय व्यवस्थाएँ संभव हैं। इसके अलावा, दो स्थानिक रूपों को किसी भी रोटेशन द्वारा नहीं जोड़ा जा सकता है; उनमें से एक दूसरे की दर्पण छवि है:

दोनों दर्पण रूप ऑप्टिकल एंटीपोड की एक जोड़ी बनाते हैं या एनंटीओमर .
ऑप्टिकल आइसोमर्स को ई. फिशर के प्रोजेक्शन फ़ार्मुलों के रूप में दर्शाया गया है। वे एक असममित कार्बन परमाणु के साथ एक अणु को प्रक्षेपित करके प्राप्त किए जाते हैं। इस मामले में, विमान पर असममित कार्बन परमाणु को एक बिंदु द्वारा दर्शाया जाता है, क्षैतिज रेखा पर ड्राइंग के विमान के सामने उभरे हुए पदार्थों के प्रतीकों को इंगित किया जाता है। ऊर्ध्वाधर रेखा (धराशायी या ठोस) उन पदार्थों को इंगित करती है जो ड्राइंग के विमान से परे हटा दिए जाते हैं। पिछली आकृति में बाएं मॉडल के अनुरूप प्रोजेक्शन फॉर्मूला लिखने के विभिन्न तरीके निम्नलिखित हैं:

प्रक्षेपण में, मुख्य कार्बन श्रृंखला को लंबवत दिखाया गया है; मुख्य कार्य, यदि यह श्रृंखला के अंत में है, प्रक्षेपण के शीर्ष पर इंगित किया गया है। उदाहरण के लिए, (+) और (-) ऐलेनिन - सीएच 3 - * सीएच (एनएच 2) -सीओओएच के स्टीरियोकेमिकल और प्रक्षेपण सूत्र निम्नानुसार दर्शाए गए हैं:

समान एनेंटिओमेरिक सामग्री वाले मिश्रण को रेसमेट कहा जाता है। रेसमेट में कोई ऑप्टिकल गतिविधि नहीं होती है और यह एनैन्टीओमर से भिन्न भौतिक गुणों की विशेषता होती है।
प्रक्षेपण सूत्रों के लिए रूपांतरण नियम।
1. सूत्र को उनके स्टीरियोकेमिकल अर्थ को बदले बिना ड्राइंग के विमान में 180 ° घुमाया जा सकता है:

2. एक असममित परमाणु पर प्रतिस्थापन के दो (या कोई भी संख्या) क्रमपरिवर्तन सूत्र के स्टीरियोकेमिकल अर्थ को नहीं बदलते हैं:

3. असममित केंद्र पर प्रतिस्थापन के एक (या कोई विषम संख्या) क्रमपरिवर्तन ऑप्टिकल एंटीपोड के सूत्र की ओर जाता है:

4. ड्राइंग के तल में 90 डिग्री घुमाने से सूत्र एक एंटीपोड में बदल जाता है।
5. किन्हीं तीन प्रतिस्थापनों को दक्षिणावर्त या वामावर्त घुमाने से सूत्र का स्टीरियोकेमिकल अर्थ नहीं बदलता है:
 6. प्रक्षेपण सूत्र चित्र के तल से नहीं निकाले जा सकते।
6. प्रक्षेपण सूत्र चित्र के तल से नहीं निकाले जा सकते।
ऑप्टिकल गतिविधि कार्बनिक यौगिकों के पास होती है, जिसके अणुओं में अन्य परमाणु भी चिरल केंद्र होते हैं, उदाहरण के लिए, सिलिकॉन, फास्फोरस, नाइट्रोजन, सल्फर।
कई असममित कार्बन परमाणुओं वाले यौगिक रूप में मौजूद हैं डायस्टेरोमर्स , अर्थात। स्थानिक आइसोमर्स जो एक दूसरे के साथ ऑप्टिकल एंटीपोड नहीं बनाते हैं।
डायस्टेरोमर्स एक दूसरे से न केवल ऑप्टिकल रोटेशन में, बल्कि अन्य सभी भौतिक स्थिरांकों में भी भिन्न होते हैं: उनके अलग-अलग गलनांक और क्वथनांक, विभिन्न विलेयताएं आदि होते हैं।
स्थानिक आइसोमर्स की संख्या फिशर सूत्र N = 2 n द्वारा निर्धारित की जाती है, जहाँ n असममित कार्बन परमाणुओं की संख्या है। कुछ संरचनाओं में दिखाई देने वाली आंशिक समरूपता के कारण स्टीरियोइसोमर्स की संख्या घट सकती है। वैकल्पिक रूप से निष्क्रिय डायस्टेरोमर्स कहलाते हैं मुझ-रूप।
ऑप्टिकल आइसोमर्स का नामकरण:
ए) डी-, एल- नामकरण
आइसोमर की डी- या एल-श्रृंखला निर्धारित करने के लिए, कॉन्फ़िगरेशन (असममित कार्बन परमाणु पर ओएच समूह की स्थिति) की तुलना ग्लिसराल्डिहाइड (ग्लिसरॉल कुंजी) के एनेंटिओमर्स के कॉन्फ़िगरेशन से की जाती है:

एल-ग्लिसराल्डिहाइड डी-ग्लिसराल्डिहाइड
डी-, एल-नामकरण का उपयोग वर्तमान में वैकल्पिक रूप से सक्रिय पदार्थों के तीन वर्गों तक सीमित है: कार्बोहाइड्रेट, अमीनो एसिड और हाइड्रोक्सीएसिड।
बी) आर -, एस-नामकरण (कैन, इंगोल्ड और प्रीलॉग नामकरण)
ऑप्टिकल आइसोमर के आर (दाएं) या एस (बाएं) विन्यास को निर्धारित करने के लिए, असममित कार्बन परमाणु के चारों ओर टेट्राहेड्रॉन (स्टीरियोकेमिकल फॉर्मूला) में प्रतिस्थापन को इस तरह व्यवस्थित करना आवश्यक है कि सबसे कम प्रतिस्थापन (आमतौर पर हाइड्रोजन) हो दिशा "पर्यवेक्षक से"। यदि वरिष्ठता से मध्य और कनिष्ठ से वरिष्ठता में अन्य तीन प्रतिस्थापनों का संक्रमण दक्षिणावर्त होता है, तो यह आर-आइसोमर है (वरिष्ठता में गिरावट अक्षर आर के ऊपरी भाग को लिखते समय हाथ की गति के साथ मेल खाती है)। यदि संक्रमण वामावर्त होता है, तो यह S . है - आइसोमर (पत्र एस के ऊपरी भाग को लिखते समय प्राथमिकता में गिरावट हाथ की गति के साथ मेल खाती है)।
प्रक्षेपण सूत्र के अनुसार ऑप्टिकल आइसोमर के आर- या एस-कॉन्फ़िगरेशन को निर्धारित करने के लिए, प्रतिस्थापनों को क्रमपरिवर्तन की एक समान संख्या से व्यवस्थित करना आवश्यक है ताकि उनमें से सबसे कम प्रक्षेपण के नीचे हो। दक्षिणावर्त शेष तीन प्रतिस्थापनों की प्राथमिकता में गिरावट आर-कॉन्फ़िगरेशन से मेल खाती है, वामावर्त - एस-कॉन्फ़िगरेशन के लिए।
प्रकाशिक समावयवी निम्नलिखित विधियों द्वारा प्राप्त किए जाते हैं:
ए) वैकल्पिक रूप से सक्रिय यौगिकों वाले प्राकृतिक पदार्थों से अलगाव, उदाहरण के लिए, प्रोटीन और अमीनो एसिड, कार्बोहाइड्रेट, कई हाइड्रॉक्सी एसिड (टार्टरिक, मैलिक, बादाम), टेरपीन हाइड्रोकार्बन, टेरपीन अल्कोहल और कीटोन, स्टेरॉयड, अल्कलॉइड, आदि।
बी) रेसमेट्स की दरार;
ग) असममित संश्लेषण;
डी) वैकल्पिक रूप से सक्रिय पदार्थों का जैव रासायनिक उत्पादन।
क्या तुम जानते हो
समरूपता की घटना (ग्रीक से - मैंमुसीबत का इशारा - अलग और मेरोस - शेयर, भाग) 1823 में खोला गया। जे। लिबिग और एफ। वोहलर दो अकार्बनिक एसिड के लवण के उदाहरण पर: साइनिक एच-ओ-सी≡एन और विस्फोटक एच-ओ-एन = सी।
1830 में जे. डुमास ने समावयवता की अवधारणा को कार्बनिक यौगिकों तक विस्तारित किया।
1831 में। कार्बनिक यौगिकों के लिए "आइसोमर" शब्द जे. बर्जेलियस द्वारा प्रस्तावित किया गया था।
प्राकृतिक यौगिकों के स्टीरियोइसोमर्स को विभिन्न जैविक गतिविधियों (एमिनो एसिड, कार्बोहाइड्रेट, एल्कलॉइड, हार्मोन, फेरोमोन, प्राकृतिक मूल के औषधीय पदार्थ, आदि) की विशेषता है।
ज्यामितीय समावयवी सिस-ट्रांस समावयवता या ईज़ी समावयवता हैं। उनकी क्रियाएं चक्रीय यौगिकों में कार्बन डबल या सिंगल बॉन्ड के सीमित रोटेशन पर आधारित होती हैं। एक चक्रीय यौगिक में, कार्बन सिंगल बॉन्ड के बीच रोटेशन सीमित होता है और दो अलग-अलग समूह समान रूप से प्रत्येक कार्बन आइसोमर से जुड़े होते हैं। ऐसे ज्यामितीय समावयवी अक्सर अपने भौतिक गुणों में भिन्न होते हैं। यह आइसोमर्स के आकार और कुल द्विध्रुवीय क्षण के कारण है। यदि उच्चतम प्राथमिकता वाले दो परमाणु आइसोमर के एक ही तरफ रहते हैं, तो उन्हें Z के रूप में नामित किया जाता है, और यदि वे विपरीत दिशा में हैं, तो E.
समरूपता का एक संक्षिप्त इतिहास
संवैधानिक समरूपता की अवधारणा आधुनिक रसायन विज्ञान के इतिहास में और विशेष रूप से कार्बनिक रसायन विज्ञान के विकास में एक महत्वपूर्ण कदम है। 1700 के दशक के अंत तक, "पशु" और "पौधे" रसायन विज्ञान का अध्ययन करके कई शुद्ध पदार्थों को अलग कर दिया गया था। कई कार्ल विल्हेम शीले (1742-1786) द्वारा प्राप्त किए गए थे। कार्बनिक यौगिकों की विस्तृत विविधता के कारण, प्रत्येक नए पदार्थ ने एक अलग मौलिक संरचना प्रस्तुत की, जो "खनिज" रसायन शास्त्र से सामान्यीकृत अवलोकन के अनुरूप थी। विभिन्न पदार्थों की पहचान के माध्यम से, 1800 के दशक की शुरुआत में पृथक कार्बनिक यौगिकों की संख्या में वृद्धि हुई।
रसायन विज्ञान के इतिहास पर अपनी पुस्तक में, थॉमस थॉमसन ने 1830 में लिखा था कि:
बर्ज़ेलियस ने परमाणु के सिद्धांत को वनस्पति साम्राज्य पर भी लागू किया, कई वनस्पति अम्लों का विश्लेषण किया, और अपने परमाणु संविधान को दिखाया, लेकिन यहाँ एक कठिनाई उत्पन्न होती है कि, हमारे ज्ञान की वर्तमान स्थिति में, हम दूर नहीं कर सकते। दो एसिड होते हैं जो बिल्कुल एक ही परमाणुओं से बने होते हैं। अब, हम संपत्तियों में इस हड़ताली अंतर के लिए कैसे जिम्मेदार हैं? निश्चित रूप से विभिन्न तरीके, जिसमें परमाणु उनमें से प्रत्येक में स्थित हैं।
थॉमसन ने उस समय इस्तेमाल किए गए परमाणु प्रतीकों की विभिन्न योजनाओं का इस्तेमाल किया, यह समझाने के लिए कि एक ही मौलिक संरचना वाले दो एसिड, जिन्हें ज्यामितीय आइसोमर कहा जाता है, में अलग-अलग भौतिक और रासायनिक गुण होते हैं।
19वीं शताब्दी की शुरुआत तक, यह माना जाता था कि जीवित जीवों में पाए जाने वाले इन रसायनों में जीवित चीजों से जुड़ी एक विशेष जीवन शक्ति होती है, और प्रजनन के लिए जीवित प्रणालियों में इनकी आवश्यकता होती है। 1828 में, वोहलर ने यूरिया (NH2) 2CO (भी CH4N2O) का एक नमूना संश्लेषित किया, जो जैविक मूत्र से पृथक यूरिया से अप्रभेद्य था।
उन्होंने इस "जानवर" पदार्थ को एक स्पष्ट रूप से अकार्बनिक (खनिज) प्रारंभिक सामग्री अमोनियम साइनेट, (एनएच 4) एनसीओ (सीएच 4 एन 2 ओ) से तैयार किया, जो अमोनियम क्लोराइड और सिल्वर साइनेट के संयोजन का परिणाम है। इस प्रकार, "जीवित" और "निर्जीव" समरूपता के बीच की बाधा ढह गई।
सीआईएस आइसोमर में, दो समान समूह दोहरे बंधन के एक तरफ रहते हैं, जबकि ट्रांस आइसोमर में वे विपरीत दिशा में रहते हैं। उदाहरण के लिए, 2-ब्यूटेन में दो आइसोमर, सीआईएस और ट्रांस होते हैं।
सीआईएस आइसोमर में, दो मिथाइल समूह और दो हाइड्रोजन समूह दोहरे बंधन के एक ही तरफ रहते हैं, जबकि ट्रांस आइसोमर में वे विपरीत दिशा में रहते हैं।
जब दोहरे बंधन से जुड़े एक या अधिक समूह समान नहीं होते हैं, तो आइसोमर्स को ई या जेड कहा जाता है। इस प्रकार को सूचित करने के लिए, उपयोगकर्ता को ज्यामितीय आइसोमर वाले हाइड्रोकार्बन के सूत्रों को इंगित करना होगा और परमाणु को सर्वोच्च प्राथमिकता के साथ निर्धारित करना होगा ( उच्चतम परमाणु संख्या) प्रत्येक दोहरे बंधन से जुड़ा हुआ है। C. यदि सर्वोच्च प्राथमिकता वाले दो परमाणु आइसोमर के एक ही तरफ रहते हैं, जिसे Z के रूप में नामित किया गया है, और यदि वे विपरीत दिशा में हैं, तो उन्हें E के रूप में नामित किया गया है।

उदाहरण के लिए, 1 - ब्रोमीन - 1 - फ्लोरोप्रोपेन में दो आइसोमर होते हैं। Z-1 - ब्रोमीन - 1 - फ्लोरोप्रोपेन में, यह देखा जा सकता है कि ब्रोमीन की फ्लोरीन (9) की तुलना में उच्च प्राथमिकता या उच्च परमाणु संख्या (35) होती है, जो C-1 से जुड़ी होती है। कार्बन का परमाणु क्रमांक (6) हाइड्रोजन (1) से अधिक होता है, जो इस यौगिक के C-2 से जुड़ा होता है। चूँकि उच्चतम प्राथमिकता वाले कार्बन परमाणु (-CH3 समूह से) और इन दो कार्बन परमाणुओं से जुड़े ब्रोमीन परमाणु एक तरफ हैं, इस यौगिक को Z के रूप में परिभाषित किया गया है। दूसरी ओर, E-1 में - ब्रोमो -1 - फ्लोरोप्रोपेन, सी और ब्रोमीन की सर्वोच्च प्राथमिकता वाले परमाणु विपरीत दिशा में हैं, इसलिए इसे ई-आइसोमर कहा जाता है।
कार्बन-कार्बन डबल बॉन्ड
आइसोमर दो अणु होते हैं जिनकी परमाणु संरचना समान होती है लेकिन समान नहीं होते हैं। दो आइसोमर्स में परमाणुओं को एक अलग क्रम (संरचनात्मक आइसोमेरिज्म) में जोड़ा जा सकता है, या उन्हें उसी तरह से जोड़ा जा सकता है, लेकिन एक अलग अभिविन्यास है - स्थानिक स्टीरियोइसोमेरिज्म।
विशेष मामलों में संरचनात्मक और ज्यामितीय आइसोमर - स्टीरियोइसोमर, दो आवश्यकताओं को पूरा करना चाहिए:
- अणु में सीमित घूर्णन होता है।
- प्रतिबंधात्मक बंधन में भाग लेने वाले दोनों परमाणुओं के दो अलग-अलग कार्यात्मक समूह हैं।
प्रतिबंधित रोटेशन का एक सामान्य उदाहरण कार्बन-कार्बन डबल बॉन्ड है। इन बांडों में पाई बांड शामिल है, ज्यादातर स्थितियों में, उन्हें तोड़ना लाभदायक नहीं है।

ज्यामितीय आइसोमर्स में एक संरचना होती है जो किसी यौगिक के भौतिक गुणों को प्रभावित करती है।
सीआईएस / ट्रांस सिस्टम
सीआईएस / ट्रांस नामकरण सबसे सरल कनेक्शन प्रणाली है। सबसे पहले, अणु में सबसे लंबी कार्बन श्रृंखला की पहचान की जाती है, और फिर ब्याज के कार्यात्मक समूहों की पहचान की जाती है। सीआईएस आइसोमर में, दो माने जाने वाले समूह डबल बॉन्ड के एक ही तरफ हैं (लैटिन में सीआईएस का अर्थ है "एक ही तरफ")। ट्रांस आइसोमर में, दो माने जाने वाले समूह दोहरे बंधन के विपरीत पक्षों पर होते हैं (ट्रांस का अर्थ है पार लैटिन) उदाहरण के लिए, ब्यूटेन -2 के दो अलग-अलग ज्यामितीय आइसोमर।

दोहरे बंधन वाले दोनों परमाणुओं में इन दो समूहों के समान दो समूह होते हैं, लेकिन वे दोहरे कार्बन में से एक पर एक दूसरे से भिन्न होते हैं। कार्य अधिक जटिल हो जाता है क्योंकि साइड चेन और कार्यात्मक समूह अधिक जटिल हो जाते हैं।
आधिकारिक IUPAC नामकरण प्रणाली E / Z पदनाम का उपयोग करती है। सीआईएस / ट्रांस और ई / जेड के बीच कोई विशिष्ट संबंध नहीं है, और दोनों प्रणालियां विनिमेय नहीं हैं। E / Z पदनाम Cahn-Ingold-Prelog प्राथमिकता नियमों का उपयोग करता है, और इसे अधिक विश्वसनीय माना जाता है। फ्यूमरिक एसिड के लिए IUPAC नाम ट्रांस आइसोमर है जिसका सूत्र HO2CCH = CHCO2H है और मैलिक एसिड cis-butenedioic एसिड है।

IUPAC शुद्ध और अनुप्रयुक्त रसायन विज्ञान का अंतर्राष्ट्रीय संघ है, जो पदनाम के लिए अंतर्राष्ट्रीय नियम और मानक निर्धारित करता है रासायनिक पदार्थसभी भाषाओं में।
एक चक्रीय बंधन में, कार्बन एकल बंधन के बीच घूर्णन सीमित है। इस प्रकार, इस प्रकार के यौगिकों के लिए समावयवता भी संभव है यदि दो विभिन्न समूह... 1,2-डाइमिथाइलसाइक्लोप्रोपेन के दो आइसोमर हैं।

एक सीआईएस आइसोमर है, जहां दो मिथाइल समूह एक तरफ होते हैं, और दूसरा ट्रांस आइसोमर होता है, जहां दो मिथाइल समूह दूसरी तरफ होते हैं।
ज्यामितीय आइसोमर्स उनके भौतिक गुणों में भिन्न होते हैं। यह आइसोमर्स के आकार और कुल द्विध्रुवीय क्षण के कारण है। उदाहरण के लिए, वे क्वथनांक में भिन्न होते हैं। 1,2-डाइक्लोरोएथिलीन के सीआईएस और ट्रांस आइसोमर्स के क्वथनांक क्रमशः 60.3 डिग्री सेल्सियस और 47.5 डिग्री सेल्सियस हैं।
सिस समावयवी में, दो द्विध्रुव आबंध (C-Cl) की उपस्थिति एक उभयनिष्ठ आणविक द्विध्रुव देती है। इससे अंतर-आणविक द्विध्रुवीय-द्विध्रुवीय बल उत्पन्न होते हैं। इस ताकत के लिए, सिस आइसोमर का क्वथनांक ट्रांस आइसोमर की तुलना में अधिक होता है, जहां दो द्विध्रुवीय बांड (C-Cl) विपरीत दिशा में उनकी स्थिति के कारण रद्द हो जाते हैं।
कार्बन-कार्बन डबल बॉन्ड को घुमाया नहीं जा सकता इसका कारण यह है कि कार्बन परमाणुओं को एक साथ जोड़ने वाले दो बॉन्ड हैं और पाई बॉन्ड को तोड़ना होगा। पी-ऑर्बिटल्स के बीच लेटरल ओवरलैप द्वारा पाई बॉन्ड बनते हैं। यदि कोई कार्बन-कार्बन डबल बॉन्ड को घुमाने की कोशिश करता है, तो पी-ऑर्बिटल्स लाइन में नहीं रहेंगे, और इसलिए पाई बॉन्ड टूट जाएगा। इस पर ऊर्जा खर्च होती है और यह तभी होता है जब कनेक्शन बहुत गर्म हो।
संकुचन के दौरान संरचनात्मक सूत्रों का निर्माण करते समय ज्यामितीय समावयवों के महत्वपूर्ण तत्वों की अनदेखी करना बहुत आसान है। उदाहरण के लिए, लेकिन-2-ईन को आकर्षित करना बहुत आकर्षक है; यदि उपयोगकर्ता इसे गलत लिखता है, तो यौगिक अब एक आइसोमर नहीं होगा। यदि थोड़ा सा भी संकेत है कि एक आइसोमर का उपयोग किया जा सकता है, तो बांड के सिरों पर कार्बन परमाणुओं के चारों ओर सही कोण (120 °) दिखाते हुए कार्बन-कार्बन डबल बॉन्ड वाले यौगिकों का उपयोग करना हमेशा आवश्यक होता है। दूसरे शब्दों में, आपको चित्र में दिखाए गए प्रारूप का उपयोग करना चाहिए।

कार्बन-कार्बन डबल बॉन्ड वाले यौगिकों में सीमित रोटेशन होता है। आइसोमर्स प्राप्त करने के लिए, अनिवार्य शर्तें:
- सीमित रोटेशन, जिसमें आमतौर पर कार्बन-कार्बन डबल बॉन्ड शामिल होता है;
- लिंक के बाएं छोर पर दो अलग-अलग समूह और दाईं ओर दो अलग-अलग समूह।
इससे कोई फर्क नहीं पड़ता कि बाएं समूह सही लोगों के समान हैं या नहीं।
एल्केन्स के ज्यामितीय आइसोमर्स में कई यौगिक शामिल होते हैं जो कार्बन श्रृंखला में सी और एच परमाणुओं से बने होते हैं। इस समूह में CnH2n सूत्र के साथ एक समजातीय श्रृंखला शामिल है। सबसे सरल एल्कीन एथीन है, इसमें दो C परमाणु और सूत्र C2H4 होता है।

एथीन का संरचनात्मक सूत्र ऊपर की आकृति में दिखाया गया है। लंबी एल्कीन श्रृंखलाओं में, अतिरिक्त कार्बन परमाणु अकेले सहसंयोजक बंधों के माध्यम से एक दूसरे से जुड़े होते हैं। प्रत्येक कार्बन परमाणु कुल चार एकल सहसंयोजक बंधन बनाने के लिए पर्याप्त हाइड्रोजन परमाणुओं से भी जुड़ा होता है।
चार या अधिक C परमाणुओं वाली जंजीरों में, दोहरा बंधन विभिन्न स्थितियों में स्थित हो सकता है, जिससे संरचनात्मक आइसोमर्स का निर्माण होता है। संरचनात्मक आइसोमर्स के अलावा, एल्केन्स स्टीरियोइसोमर्स भी बनाते हैं। चूंकि बहु-आबंध के चारों ओर घूर्णन सीमित होता है, इसलिए दोहरे बंधन परमाणुओं से जुड़े समूह हमेशा एक ही सापेक्ष स्थिति में रहते हैं।
ये "लॉक" स्थिति रसायनज्ञों को यह निर्धारित करने के लिए कि किस पदार्थ में ज्यामितीय आइसोमर्स हैं, प्रतिस्थापन से विभिन्न आइसोमर्स की पहचान करने की अनुमति देते हैं। उदाहरण के लिए, C5H10 के एक संरचनात्मक आइसोमर में निम्नलिखित स्टीरियोइसोमर्स होते हैं।

बाईं ओर का आइसोमर, जिसमें दो प्रतिस्थापन (मिथाइल और एथिल समूह) दोहरे बंधन के एक ही तरफ होते हैं, को सीआईएस आइसोमर कहा जाता है, जबकि दाईं ओर का आइसोमर विपरीत पक्षों पर दो गैर-हाइड्रोजन पदार्थों के साथ होता है। समावयवी
उदाहरण के लिए, क्लोरीन को प्राथमिकता दी जाती है क्योंकि यह भारी होता है। साथ दाईं ओरब्रोमीन कार्बन से श्रेष्ठ है। तीसरा, दो उच्च-क्रम परमाणुओं की स्थिति निर्धारित की जाती है। यदि दो परमाणु सीआईएस स्थिति में हैं, तो व्यवस्था जेड है (जर्मन ज़ुसमेन से, जिसका अर्थ है "एक साथ")। यदि परमाणु, या समूह, ट्रांस स्थिति में हैं, तो व्यवस्था ई है (जर्मन एंटेजेन से, जिसका अर्थ है "विपरीत")।
ज्यामितीय समावयवी ब्यूटेन एक दृढ़ द्विबंध एल्कीन है। इसका मतलब है कि वास्तव में चार आइसोमर हैं, तीन नहीं, डबल बॉन्ड स्थिति में। एक ही संरचना का पाँचवाँ और छठा हाइड्रोकार्बन है, लेकिन एक ही सूत्र के बावजूद, वे अल्केन्स नहीं हैं।

साइक्लोब्यूटेन या मिथाइलसाइक्लोप्रोपेन का वलय निर्माण दो हाइड्रोजन परमाणुओं के स्थान को दोहरे बंधन के रूप में घेरता है, जो इस तथ्य की ओर जाता है कि उनके पास विभिन्न ब्यूटेन के समान सूत्र हैं।
ज्यामितीय आइसोमर्स उदाहरण:
- 1-ब्यूटिलीन (1-ब्यूटेन);
- आइसो-ब्यूटिलीन (2-मिथाइल-प्रोपेन);
- सीआईएस-2-ब्यूटिलीन (सीआईएस-2-ब्यूटेन);
- ट्रांस-2-ब्यूटिलीन (ट्रांस-2-ब्यूटेन)।
और बोनस: साइक्लोब्यूटेन और मिथाइलसाइक्लोप्रोपेन - दोनों में ब्यूटेन आइसोमर्स के समान अनुभवजन्य सूत्र हैं, लेकिन एल्केन्स नहीं हैं। पहला नाम "सामान्य" या "तुच्छ" नाम है, और कोष्ठक में नाम IUPAC नाम है।
ब्यूटेन के कई उपयोग हैं, कार में ईंधन से लेकर किराने की थैलियों तक, जिन्हें दुनिया भर में करोड़ों लोग हर दिन ले जाते हैं। ब्यूटेन का रासायनिक सूत्र C4H8 है, जिसका अर्थ है कि इसमें चार C परमाणु और आठ H परमाणु हैं, यौगिक एल्केन को संदर्भित करता है।
कई अलग-अलग आइसोमर या आणविक संरचनाएं हैं जो यह यौगिक बना सकती हैं (आईयूपीएसी नाम कोष्ठक में दिखाए गए हैं):
- अल्फा-ब्यूटिलीन (लेकिन-1-एनी);
- सीआईएस-बीटा-ब्यूटिलीन - ((2Z) -but-2-ene);
- ट्रांस-बीटा-ब्यूटिलीन - ((2E) -but-2-ene);
- आइसोब्यूटिलीन (2-मिथाइलप्रॉप-1-ईएन)।

हालाँकि उन सभी का सूत्र समान है, लेकिन उनकी संरचनाएँ भिन्न हैं। इनमें से प्रत्येक ज्यामितीय आइसोमर्स के बीच संबंध ज्यादातर संवैधानिक हैं, जिसका अर्थ है कि उनके पास एक ही आणविक सूत्र है, लेकिन अलग-अलग बंधन हैं। अपवाद सीआईएस-बीटा-ब्यूटिलीन और ट्रांस-बीटा-ब्यूटिलीन हैं।
बहुत से लोग जानते हैं कि ट्रांस वसा मनुष्यों के लिए खराब हैं, और असंतृप्त वसा उनके लिए अच्छे हैं। इन दो वसाओं के बीच एकमात्र अंतर यह है कि एक में ट्रांस बॉन्ड होता है और दूसरे में सीआईएस बॉन्ड होता है, हालांकि यह मामूली अंतर अणु के कार्य को महत्वपूर्ण रूप से प्रभावित कर सकता है।
सीस-बीटा-ब्यूटिलीन और ट्रांस-बीटा-ब्यूटिलीन के साथ, परमाणु एक ही क्रम में हैं, लेकिन ध्रुवीयताएं अलग हैं। सीआईएस आइसोमर एक ही तरफ दोनों सीएच 3 समूहों के साथ ध्रुवीय है। यह इसे वास्तव में भारी और जटिल बनाता है। ट्रांस आइसोमर गैर-ध्रुवीय है, भारी सीएच 3 समूह वैकल्पिक है, जो अणु में अधिक जगह देता है। इस अनुपात को सीआईएस-ट्रांस आइसोमेरिज्म कहा जाता है। सीआईएस आइसोमर्स ध्रुवीय होते हैं, जबकि ट्रांस आइसोमर्स नहीं होते हैं।
हालांकि इनमें से प्रत्येक ब्यूटेन आइसोमर्स में समान सामग्री होती है, प्रत्येक में अलग-अलग भौतिक गुण होते हैं। उदाहरण के लिए क्वथनांक:
- सीआईएस-बीटा-ब्यूटिलीन: 3.7 डिग्री सेल्सियस।
- ट्रांस-बीटा-ब्यूटिलीन: 0.8 डिग्री सेल्सियस।
- आइसोब्यूटिलीन: -6.9 डिग्री सेल्सियस।
- अल्फा ब्यूटिलीन: -6.3 डिग्री सेल्सियस।
प्लास्टिक के उत्पादन के लिए सामग्री
ब्यूटेन चार कार्बन परमाणुओं, C4H8 के साथ अल्कीन हैं। ब्यूटेन के कई अलग-अलग संरचनात्मक या विन्यास आइसोमर्स हैं, जिनमें ज्यामितीय और ऑप्टिकल आइसोमर्स शामिल हैं। सभी चार ब्यूटेन में समान भौतिक गुण होते हैं, रंगहीन गैसें, पानी में भारी, ईथर और अल्केन्स में आसानी से घुलनशील होने के कारण। में मतभेद भौतिक गुणअणुओं की संरचना द्वारा समझाया गया है। उदाहरण के लिए, सिस-बट-2-एन का क्वथनांक ट्रांस-बट-2-एन की तुलना में अधिक है क्योंकि यह एक मजबूत द्विध्रुव है।

सीआईएस आइसोमर के दो एल्काइल समूह एक ही दिशा में अपने + I प्रभाव के साथ काम करते हैं और इस तरह बढ़ते हैं, जबकि ट्रांस आइसोमर्स के दो अल्काइल समूह विपरीत दिशाओं में कार्य करते हैं और इस तरह एक दूसरे को कमजोर करते हैं। ज्यामितीय समावयवों वाले हाइड्रोकार्बन के सूत्र IUPAC मानकों के अनुसार दर्शाए गए हैं। But-1-en में इतना कम गलनांक होता है, क्योंकि CC दूसरे और तीसरे कार्बन परमाणुओं के बीच एक एकल बंधन मुक्त रोटेशन है और एथिल समूह सभी दिशाओं में रोटेशन की धुरी के चारों ओर घूम सकता है।
इससे अणु को ठोस क्रिस्टलीय संरचना में वर्गीकृत करना मुश्किल हो जाता है। दूसरे और तीसरे सी परमाणुओं के बीच दोहरे बंधन वाले अन्य तीन ब्यूटेन बहुत कठोर होते हैं और इन्हें आसानी से क्रिस्टल संरचनाओं में वर्गीकृत किया जा सकता है। इसलिए, उनके पास अपेक्षाकृत उच्च गलनांक होता है। ये तर्क हमेशा मान्य नहीं होते हैं, क्योंकि उदाहरण 2-मिथाइल-बट-2-एन (या आइसोब्यूटीन) दिखाता है। दो मिथाइल समूह, उनके + I-प्रभावों के साथ, cis-but-2-en के समान दिशा में कार्य करते हैं, और वास्तव में सुधार किया जाना चाहिए। हालाँकि, आइसोब्यूटीन का क्वथनांक केवल -7 ° C बहुत कम होता है।
But-1-en और But-2-ene का उपयोग Butadiene और Butane-2-ol के उत्पादन के लिए किया जाता है। इसके अलावा, एल्केन्स का उपयोग अल्काइलेटिंग एजेंटों के रूप में किया जाता है। इस प्रकार, महत्वपूर्ण ईंधन 2,2,4-ट्राइमिथाइल-पेंटन, जिसे आइसोक्टेन के रूप में जाना जाता है, आइसोब्यूटीन और आइसोब्यूटेन से प्राप्त होता है। अंत में, ब्यूटेन कुछ प्लास्टिक के लिए शुरुआती सामग्री हैं क्योंकि वे पोलीमराइज़ करने में आसान होते हैं। प्रसिद्ध बट-1-एन-आधारित प्लास्टिक पॉलीब्यूटीन-1 है, जिससे पाइप बनाए जाते हैं।
पेंटेन, एन-पेंटेन, आइसोपेंटेन
पेंटेन, या एन-पेंटेन, संतृप्त हाइड्रोकार्बन अल्केन्स में से एक है। लगभग गंधहीन, एन-पेंटेन परिवेशी परिस्थितियों में तरल होता है और हेराकाटेचाइट का 3-आइसोमर आइसोमर होता है। शाखित तरल आइसोअल्केन्स C5 - C16 का तेजी से ईंधन (ओटो, डीजल) के रूप में उपयोग किया जा रहा है। इसके अलावा, ये अल्केन्स गर्म करने वाले तेलों और चिकनाई वाले तेलों में मौजूद होते हैं। वे पूर्ण दहन सुनिश्चित करते हैं। ऐसे यौगिकों की विशेषताओं को जानने से पहले, ज्यामितीय समावयवों वाले हाइड्रोकार्बन के सूत्रों को इंगित करना आवश्यक है:
- भौतिक अवस्था तरल है।
- रंग बेरंग है।
- गंध - लगभग कोई नहीं।
- आसानी से ज्वलनशील।
- हवा के संपर्क में आने पर वाष्प विस्फोटक मिश्रण बना सकते हैं।
- पानी में घुलनशीलता बहुत कम है (व्यावहारिक रूप से अघुलनशील)।
- बहुत अस्थिर कनेक्शन।
पेंटेन के सबसे महत्वपूर्ण स्रोत पेट्रोलियम तेल हैं, जो उनके मूल के आधार पर संरचना में व्यापक रूप से भिन्न होते हैं। पृथक्करण भिन्नात्मक आसवन के माध्यम से होता है। निम्नलिखित गुट यहां प्राप्त किए गए हैं:
- पैराफिन तेल (क्वथनांक> 320 डिग्री सेल्सियस)।
- तेल (क्वथनांक 180 से 250 डिग्री सेल्सियस)।
- ताप / डीजल (क्वथनांक 250 से 320 डिग्री सेल्सियस)।
- क्रूड गैसोलीन (लगभग 180 डिग्री सेल्सियस तक क्वथनांक)।
- नेफ्था में C5 से C10 तक शाखित हाइड्रोकार्बन (अल्केन्स) मौजूद होते हैं।
- ऑक्सीजन के साथ पेंटेन का दहन (स्टोइकोमेट्रिक)।
- अंतिम उत्पाद कार्बन डाइऑक्साइड और पानी हैं। ज्यामितीय समावयवों के सूत्र: C5H12 + 8O2 5CO2 + 6H2O।
| ऊष्मीय मान HU | कैलोरी मान एचयू [किलोवाट / किग्रा] |
||
पेंटीन-2 का ज्यामितीय समावयवी एक बहुउपयोगी विलायक है। इसका उपयोग फेनोलिक राल और पॉलीस्टाइनिन को फोम करने के लिए किया जाता है। गैस क्रोमैटोग्राफी में संदर्भ पदार्थ के रूप में और स्प्रे सिलेंडर में प्रणोदक के रूप में भी इसकी आवश्यकता होती है।


 डिंब की बड़ी टुकड़ी लेकिन गर्भावस्था आगे बढ़ती है
डिंब की बड़ी टुकड़ी लेकिन गर्भावस्था आगे बढ़ती है गर्भावस्था नहीं है, लेकिन परीक्षण सकारात्मक है: कारण
गर्भावस्था नहीं है, लेकिन परीक्षण सकारात्मक है: कारण घर पर डाई करने के बाद अपने बालों का रंग कैसे वापस पाएं?
घर पर डाई करने के बाद अपने बालों का रंग कैसे वापस पाएं?