지혈 위반. 혈관에서 혈전을 형성하는 혈액의 능력 증가. Ca 이온 길항제
지혈 시스템은 두 가지 반대 방향 과정 사이의 균형을 지속적으로 유지하는 놀라운 진화의 업적입니다. 액체 상태를 유지하면서 혈관 손상에 대한 반응으로 혈액 손실을 방지하기 위해 가능한 가장 빠른 응고 (혈전) 형성 순환계의 혈액 응집. 이 어려운 문제에 대한 해결책은 혈관 내피, 혈장 응고 캐스케이드, 항응고 메커니즘, 섬유소 용해 시스템, 혈소판 및 백혈구의 복잡한 상호 작용에 의해 제공됩니다. 다양한 직경의 혈관을 통한 혈액 이동의 유변학적 특성, 특히 미세 순환 시스템의 점도가 매우 중요합니다.
중요한 상태의 의학에서 지혈 장애가 종종 발생하며 그 심각도는 외상, 감염, 수술, 약물 및 심혈관 및 호흡기 시스템의 보상 기능과 같은 손상 요인의 항상성에 대한 규제 완화 효과에 따라 다릅니다. 지혈 장애, 특히 파종 성 혈관 내 응고 증후군 (DIC 증후군)의 주요 역할 해독 집중 치료, 그리고 의사의 무기고에서 효과적인 표적 교정 수단의 출현은 현대 의료 행위의 특징입니다.
임상 적으로 지혈 장애는 출혈에 의해 더 자주 나타나고 혈전증에 의해 덜 자주 나타나지만 종종 병리학 적 출혈과 미세 혈전증이 동시에 나타납니다.
정상 지혈의 생리학
혈관벽의 손상은 손상된 혈관 자체와 인접한 모세혈관 및 세동맥 모두의 즉각적인 혈관수축을 유발하여 손상된 부위의 혈류가 초기에 느려지게 합니다. 또한, 여러 기능적 구성 요소의 상호 작용으로 1차 혈소판 플러그(응고)가 형성되며, 이는 피브린 필라멘트에 의해 빠르게 안정화됩니다. 정상적인 조건에서이 응고 촉진 과정은 시간과 장소에 제한이 있으며 동일한 기능 구성 요소에 의해 제어됩니다. 여기에는 혈소판, 혈장 응고 캐스케이드, 천연 항응고제, 섬유소 용해 시스템 및 내피 세포가 포함됩니다.
내피가 손상되면 혈소판이 콜라겐의 내피하층과 접촉하여 혈소판이 콜라겐에 접착(유착)이 일어나며 세로토닌, 리소좀 효소, 피브리노겐 및 혈소판인자 IV의 방출과 혈소판과립이 형성된다. 프로스타글란딘이 자극됩니다. 활성화 된 혈소판은 응집되어 1 차 혈소판 플러그 (1 차 지혈)를 형성합니다. 혈소판의 양적 및 질적 병리학 적 변화는 출혈과 출혈로 나타납니다. 출혈 시간은 혈소판의 기능적 생존력을 평가하기 위한 최적의 선별 검사입니다.
응고 캐스케이드는 안정적인 섬유소 혈전의 형성을 담당합니다. 그것을 구성하는 요소는 표에 나열되어 있습니다. 2-10.
표 2-10. 응고 인자 인자 1 피브리노겐 인자 II 프로트롬빈 인자 III 조직 트롬보플라스틴(조직 인자) 인자 IV 칼슘 인자 V 액셀러린 인자 VII 프로컨버틴 인자 VIII 항혈우병 인자 인자 IX 크리스마스 인자 X 인자 스튜어트 인자 XI 트롬보플라스틴 인자 XI의 혈장 전구체 인자 XibrinXIplastagin 인자 인자
대부분의 응고 인자는 간에서 합성됩니다. 인자 VIII는 간 외에 부분적으로 거핵구와 내피 세포에 의해 합성됩니다. 요인 II, VII, IX 및 X는 비타민 K에 의존합니다. 간세포에 의한 합성을 위해서는 비타민 K가 필요하며 응고 응고 캐스케이드의 계획은 Fig. 2-8.
응고 캐스케이드의 시작은 손상된 부위 (외부 응고 경로)에서 인자 VII와 조직 인자 (III)의 상호 작용입니다. 활성화된 VII 인자와 조직 인자의 복합체는 인자 IX와 X를 활성화시켜 트롬빈을 형성합니다. 트롬빈은 인자 XIII와 혈소판을 활성화하여 피브리노겐을 피브린으로 전환합니다. 트롬빈의 작용은 천연 항응고제-활성화 된 단백질 C의 제어하에 있습니다. 외부 응고 경로의 대안은 외부 표면과의 혈액 접촉으로 인한 콜라겐에 의한 인자 XII의 활성화로 시작되는 내부 응고 경로입니다. 인자 XHa가 인자 X1a를 활성화하면 외부 및 내부 응고 경로가 동일합니다.
내부 경로 외부 경로
(접촉 계수) (조직 손상)
RSh
PXa
RUa
RHSA
RHsh
무화과. 2-8. 응고 캐스케이드 다이어그램.
선별 검사 - 프로트롬빈 시간, 활성화된 부분 트롬보플라스틴 시간(APTT) 및 트롬빈 시간 -을 통해 응고 지혈의 연결 상태를 판단할 수 있습니다. 응고 캐스케이드의 선천적 또는 후천적 결함은 뇌, 관절, 연조직그리고 근육, 위장 출혈.
천연 항응고제는 항 트롬빈 III 및 비타민 K 의존성 단백질 C 및 5의 두 가지 가장 중요한 요소로 나타납니다. 안티 트롬빈 III는 트롬빈 및 인자 Xa를 억제하고 인자 1Xa, X1a, XIA의 비활성화에 참여합니다. 헤파린과 상호 작용함으로써 항 트롬빈 III는 항 응고 효과를 크게 향상시킵니다. 단백질 5와 결합된 활성화된 단백질 C는 인자 Va 및 VIIIa(응고 촉진 과정의 중요한 보조 인자)를 억제하는 효소에 항응고 효과가 있습니다. 또한, 단백질 C는 조직 플라스 미노 겐 활성화 제를 억제하여 플라스 미노 겐의 플라스 민으로의 전환을 촉진하여 섬유소 용해를 향상시킵니다. 단백질 C는 병인에 중요한 역할을합니다
DIC 증후군. 항 트롬빈 III, 단백질 C 및 단백질 5 (선천성보다 더 자주 획득)의 결핍은 혈전 성 합병증의 높은 발생률을 동반합니다.
섬유소 용해 (응고와 유사)는 혈관벽 손상에 대한 정상적인 반응입니다. 손상 또는 트롬빈 자극에 반응하여 내피 세포에 의해 생성되는 조직 플라스 미노 겐 활성화 제 (1-PA)는 플라스 미노 겐을 플라스 민으로 전환합니다. 플라스민은 섬유소와 섬유소원을 분해하여 다양한 섬유소 분해 생성물을 형성합니다. 동시에 플라스 미노 겐 활성화 억제제 (간세포와 내피 세포에 의해 형성되는 PA1-1, 태반과 대 식세포에서 형성되는 PA1-2)가 비활성 형태로 혈장에서 순환합니다. 그들의 생리적 중요성은 섬유소 용해를 제어하고 병리학 적 단계로의 전환을 방지하는 데 있습니다. 섬유소 용해의 치료 억제제는 트라 넥 삼산과 아미노 카프로 산입니다. 반대로, streptokinase는 플라스 민의 형성을 증가시키는 섬유소 용해제입니다.
정상적인 조건에서 내피 세포는 혈액과 조직 사이의 항 혈전 작용을 담당하여 혈액의 유동성을 유지합니다. 그들은 글리코 사 미노 글리 칸, 헤파린 설페이트, 트롬 보 모듈 린 (항 트롬빈 III 및 단백질 C 활성화), 산화 질소 및 프로스타글란딘 (혈소판 응집 억제 및 혈관 확장 촉진), 섬유소 용해를 시작하는 조직 플라스 미노 겐 활성화 제와 같은 항응고제를 생산합니다. 그러나 내피 세포는 박테리아 내 독소에 의한 자극에 반응하여 표면에 von Willebrand 인자와 조직 인자를 생성 할 수 있으며, 이는 응고 캐스케이드를 유발합니다. 이러한 특성은 지혈 장애의 치료에 고려되어야 합니다.
지혈 시스템 장애에 대한 실험실 검사
중환자실에서 긴급하게 수행되는 1차 지혈을 평가하기 위한 검사는 출혈 시간과 혈소판 수를 측정하는 것입니다. 혈소판의 응집과 접착, 폰 빌레 브란트 인자의 함량은 전문 응고 실험실에서 조사됩니다.
응고 지혈 과정은 APTT, 프로트롬빈 시간 및 트롬빈 시간과 같은 검사로 평가할 수 있으며, 이는 혈액 응고의 여러 요인에 대한 요약 평가를 제공합니다. 응고 인자의 별도 측정은 전문 실험실에서만 가능합니다.
항응고제 시스템의 스크리닝은 항트롬빈 III의 농도를 결정하여 수행할 수 있습니다. 다른 응고 억제 검사는 오랜 시간이 걸리며 전문 실험실에서 수행됩니다.
섬유소 용해 시스템의 상태는 섬유소원 분해 산물, 섬유소 단량체, B- 이량 체의 양을 검사하고 혈장에서 섬유소 용해 억제제 및 활성화 제 함량에 대한 구체적인 연구를 통해 판단 할 수 있습니다.
응고 지표의 정상 값은 표에 나와 있습니다. 2-11.
표 2-11. 혈액 응고 지수 테스트 표준 APTT 27.4-40.3s 프로트롬빈 시간 12.3-16.1s 트롬빈 시간 제어 ± 3s 피브리노겐 1.7-3.1g / L P-dimers 2-11 응고 인자 II, V, VII, VIII, IX, X, XI, XII 50-150% 안티트롬빈 III 80-120% 활성화된 단백질 C 73-121% 단백질 3: 총 55-125% 유리 21-53% 폰 빌레브란트 인자(항원) 50-150%
출혈 시간은 혈소판 마개가 형성되는 데 걸리는 시간에 해당합니다. 혈소판 감소증, 혈소판 기능 장애 및 폰 빌레브란트병에서는 연장될 수 있지만 응고 장애(예: 혈우병)에서는 연장되지 않습니다.
중환자 실에있는 환자를위한 의무적 인 검사실 검사에는 혈소판 계수가 포함되어야합니다. 생리 첫날에는 혈소판 수가 적을 수 있음을 기억해야 합니다.
APTT는 인자 VII 및 XIII를 제외하고 인자 XII의 활성화에서 가용성 섬유소의 형성에 이르기까지 내부 응고 경로의 모든 인자의 총 함량을 반영합니다. 연장 된 APTT는 출혈 경향의 증가를 반영하고 지혈의 내부 연결에 대한 하나 또는 여러 요인의 결핍을 나타낼 수 있습니다 (예 : 혈우병 또는 폰 빌레 브란트 병의 VIII). 나트륨 헤파린 또는 와파린으로 APTT 치료를 연장합니다. APTT는 일차 지혈 위반을 반영하지 않습니다.
프로트롬빈 시간은 응고 형성 과정을 특징으로 합니다. 그것은 외부 경로를 구성하는 응고 인자 I, II, V, VII 및 X의 합을 결정하고 그중 하나 이상이 부족할 때 길어집니다. 이 지표는 종종 피브리노겐과 인자 V에 작용하지 않는 비타민 K 길항제 인 간접 항응고제 (와파린)를 사용한 치료를 제어하는 데 사용됩니다.이 목적에 대한 더 많은 정보는 프로트롬빈 복합체에 대한 연구로 합계 만 결정합니다. 인자 II, VII 및 X의 (이러한 인자의 합성을 위해서는 비타민 K가 필요함). 서로 다른 테스트 시스템을 사용하는 여러 실험실의 연구 결과를 비교하기 위해 프로트롬빈 시간 및 프로트롬빈 복합체의 지표를 국제 정규화 비율 (INR)로 다시 계산합니다. 건강한 개인의 경우 INR은 약 1입니다. 와파린, 비타민 K 결핍, 간부전 또는 요인 중 하나 (일반적으로 VII)의 고립 된 결핍으로 치료할 때 INR 값은 2에서 3 사이 여야합니다.
트롬빈 시간은 혈전 형성의 최종 단계를 테스트합니다. 그것의 길어짐은 1g / l 미만의 섬유소 생성 또는 섬유소 형성 이상을 나타낼 수 있습니다. 나트륨 헤파린 요법은 또한 트롬빈 시간을 연장시킵니다.
낮은 섬유소원 함량은 생산 감소 또는 소비 증가 때문일 수 있습니다. 높은 함량의 피브리노겐은 특히 합성이 일어나는 간의 급성 염증 상태의 지표입니다. 피브리노겐 용해 산물 (피브린 분해 산물, B- 이량 체)의 농도가 증가하면서 동시에 그 양이 감소하면 DIC가 발생했음을 나타냅니다.
항 트롬빈 III (가장 강력한 천연 단백질 분해 혈장 항응고제)의 결핍은 종종 급성 대량 출혈, 부적절하게 보충 (신선 냉동 혈장 (FFP) 수혈없이) 또는 패혈증을 수반하는 파종 성 혈관 내 응고 증후군의 징후입니다. 훨씬 덜 자주, 항 트롬빈 III의 양의 감소는 상 염색체 우성 유전 질환의 징후로 발생합니다. 주요 임상 증상이 지혈 시스템의 병리학 인 후천성 출혈 증후군 또는 질병의 감별 진단을위한 선별 검사의 사용이 표에 나와 있습니다. 2-12.
표 2-12. 일부 질병 및 증후군에서 지혈 지표 연구 혈우병 질환 테스트
폰 빌레브란트 샤프
내부 연소 엔진
질병 증후군
간 헤파린
나트륨 와파린 혈소판 규범 규범 감소 규범 규범 규범 피브리노겐 규범 규범 감소 규범 규범 프로트롬빈 감소
시간 정상 정상 연장 연장 정상 연장 APTT 연장 정상 또는 연장 정상 또는 연장 정상 또는 연장 연장 연장 트롬빈 시간 정상 정상 연장 정상 또는 연장 연장 정상
그러나 지혈을 모니터링하기 위해 나열된 고전적인 테스트는 불행히도 수많은 요인의 상호 작용을 반영하여 그의 상태에 대한 통합적이고 통합적인 그림을 제공하지 않습니다. 집중 치료에서는 약물 또는 수혈 교정 수단을 선택하고 수행되는 치료의 정확성을 평가하기 위해 연구 당시 환자의 혈액 응고 시스템 상태에 대해 알아야하는 경우가 많습니다. 지혈 장애를 수정하십시오. thromboelastography 방법을 사용하면 일반적인 지혈 상태와 병리학 적 변화와의 개별 연결 상태를 모두 특성화하는 데이터를 빠르고 안정적으로 얻을 수 있습니다.
혈전탄성조영술 방법은 혈전(혈전)이 형성되는 동안의 물리적 매개변수 측정을 기반으로 합니다. 응고가 시작되는 순간부터 완료 및 후속 용해까지 응고 밀도의 변화는 혈소판 탄성 그래프의 현대 모델에서 컴퓨터 디스플레이로 전송되는 전기 기계 변환기를 사용하여 기록됩니다. 혈전탄성조영술에는 다음과 같은 주요 매개변수가 있습니다(그림 2-9).
K (분) - 응고 시작부터 첫 번째 피브린 섬유 형성까지의 시간;
K (분) - 응고 진폭의 변화 시간, 증가 또는 감속;
К + К-혈액 응고 시간과 관련이 있으며 일반적으로 6-8 분입니다.
각도 a-혈액 응고 속도, 섬유소 중합 과정을 반영합니다.
MA (mm) - 주로 혈소판의 기능과 수, 그리고 덜하지만 혈액 내 피브린 농도에 의존하는 형성된 응고의 강도와 강성을 특징으로 하는 곡선의 최대 진폭;
EPL, LUZO (%)-섬유소 용해 정도 평가.
그림에서 볼 수 있듯이. 2-9, 응고 과다 증후군에서 C & C의 시간 매개 변수가 짧아지고 각도 a와 MA가 증가합니다. 반대로 저응고 상태에서는 C&C가 증가하고 각도와 MA가 감소합니다. 게다가 일반적 특성 thromboelastography의 데이터에 따르면 지혈 상태는 개별 링크의 위반에 대해서도 판단 할 수 있습니다. 따라서 헤파린 나트륨 과다 복용의 경우 모든 혈전 탄성도 지표가 길어지고 감소합니다-K, K, a, MA; 혈소판 감소증이있는 경우 K는 정상 범위를 유지하지만 K는 감소 된 MA로 길어집니다. 섬유소 용해가 증가하면 #은 정상이지만 MA는 EPb와 LYZO에 의해 급격하고 오랫동안 감소합니다. 혈소판 병증 및 혈소판 기능 장애
스타트
무화과. 2-9. Thromboelastogram 옵션 : A-표준; B-과 응고; B - 응고 저하.
K가 길어지고 각도 a와 MA가 감소합니다. 반복적 인 혈전 탄성 조영의 가능성, 그래픽 기록, 시행에 필요한 매우 적은 혈액량으로 연구에 필요한 최소 시간은 혈전 탄성 조영술이 중환자 실의 급행 실험실에서 실험실 장비의 필수 속성 중 하나가되게합니다.
지혈 계 장애의 개별 형태에 대한 집중 요법
중환자 실의 경우 환자 상태의 심각성, 시간 부족 및 수술의 긴급 성으로 인해 완전한 응고 검사를 수행 할 수없는 경우가 많습니다. 환자가 적혈구 용적률> 30 %, 혈소판 수> 100x109 / L, 섬유소원 농도> 1.5g / L, 그리고 환자가 적혈구 용적률> 30 %, 혈소판 농도> 1.5g / L 인 경우 압도적 다수의 사례에서 전신 지혈 장애로 인한 출혈의 의심을 배제 할 수 있습니다. 동시에 APTT 및 프로트롬빈 시간은 3-5 초 이하로 정상 값의 상한을 초과하지 않습니다. 이러한 지표를 통해 침습적 시술(중심정맥 도관 또는 동맥 천자)을 안전하게 수행할 수 있습니다. 동시에, 이러한 매개 변수로 인한 출혈은 외과 적 국소 지혈 (보통 수술 후)의 결함 또는 급성 파종 성 혈관 내 응고 증후군의 발생을 나타낼 수 있습니다.
집중 치료가 필요한 가장 일반적인 전신 지혈 장애는 표에 나와 있습니다. 2-13.
표 2-13. 중대 상태에서의 지혈 장애 진단 지혈 병리 간 질환 VII 및 von Willebrand 인자를 제외한 모든 응고 인자 함량 감소 단백질 C 농도 감소 및 5 혈소판 수 감소 및 기능 장애 DIC 증후군 Dysfibrinogenemia opn 혈소판 기능 장애 항 트롬빈 III DIC 증후군 농도 감소 AIC를 사용한 차단 혈소판 기능 장애 혈소판 수 감소 섬유소원 농도 감소 인자 II, V, VII, X, XI의 함량 감소 DIC-TBI 증후군, 충돌 증후군 섬유소 분해 산물의 농도 증가 DIC-증후군 대규모 수혈 인자 V 및 VII의 함량 감소 와파린 인자 II, VII, IX, X의 함량 감소 단백질 C 및 5 헤파린 나트륨 농도 감소 혈소판 감소증 인자 X 혈전 용해제의 함량 감소
치료 피브린 분해 산물, 플라스민 농도 증가 피브리노겐 함량 감소 DIC 증후군 피브리노겐 함량 감소 혈소판 수 감소 단백질 C 및 5 함량 감소 안티트롬빈 III 농도 감소 인자 V, VIII, IX, XI의 함량 섬유소 분해 산물의 농도 증가
외과적 중재 동안 지혈을 보장하는 데 필요한 혈류 내 혈장 응고 인자의 최소 충분한 함량은 표에 나와 있습니다. 2-14.
최소 충분한 혈소판 수는 80-100x109 / l입니다.
표 2-14. 외과적 지혈에 필요한 응고 인자의 최소 함량 인자 지혈 수준, 표준의 % 피브리노겐 50-100 프로트롬빈 40-50 인자 V 10-30 인자 VII 10-20 인자 VIII 30-70 Von Willebrand 인자 20-50
테이블의 끝. 2-14 요인 IX 20-60 요인 X 10-20 요인 XI 20-80 요인 XIII 10
일차 지혈 장애
1차 지혈 손상으로 인한 출혈 체질에는 혈소판 감소증(9장 참조), 폰 빌레브란트병 및 혈소판 기능 장애가 포함됩니다. 전형적인 증상은 피부 나 점막의 출혈성 발진, 타박상, 최소한의 노출로 인한 점상 출혈입니다. 집중 치료는 국소 출혈, 특히 종종 비강 및 월경과 함께 필요합니다.
골수 손상 (무형성 빈혈, 혈모 세포증, 암 전이)으로 인한 혈소판 감소증이 가장 자주 기록됩니다. 중환자 실 의사의 진료에서 드물게 출혈성 혈소판 감소 체질이 선천적 원인 (Wiskott-Aldrich 증후군, May-Hegglin 이상) 또는 방사선 손상, 철분 결핍, 비타민 B12, 만성 알코올 중독으로 인한 환자가 있습니다.
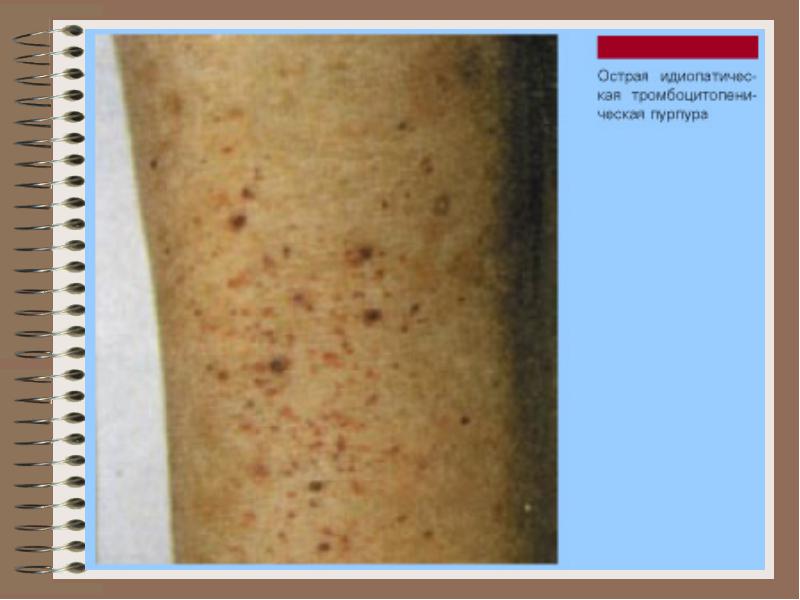
특발성 혈소판 감소성 자반병은 자가면역 혈소판 감소증의 가장 흔한 형태로, 혈소판의 소비 증가로 인해 혈소판의 수명이 단축되는 특징이 있습니다. 혈소판 기능은 영향을받지 않습니다. 출혈이 발생하거나 출혈을 예방하기 위해 글루코 코르티코이드가 처방됩니다. 고용량의 정맥 내 면역 글로불린을 사용하는 것이 효과적입니다. 종종, 특히 글루코 코르티코이드 요법의 합병증 (이 센코-쿠싱 증후군, 고혈당증) 또는 재발 성 출혈이 발생하는 경우 비장 절제술이 사용됩니다. 수술 당일과 수술 직후에는 글루코 코르티코이드 요법이 계속되고 점차적으로 취소되어야합니다 (하루에 2.5-5mg의 프레드니솔론 용량 감소). 극히 드문 경우를 제외하고는 혈소판 수혈은 선택 수단으로 간주되지 않습니다 (보존 요법의 효과가없고 수술 중 출혈 증가를 예방할 필요가 있음).
면역 충돌은 또한 헤파린 유발 혈소판 감소증의 기초입니다. 헤파린 나트륨 투여에 대한 반응으로 환자의 몸은 IgC 항체를 형성하기 시작하여 혈소판의 Pc 수용체에 결합하여 수명을 단축시킵니다. 그러한 갈등의 발생 빈도-
헤파린 나트륨을 투여받은 개인의 5 %. 혈소판 감소증은 천천히 진행되고 국소 출혈은 드물며 혈소판 수혈이 필요하지 않습니다. 헤파린 나트륨을 폐지하면 혈소판 수가 2 ~ 5 일 이내에 회복됩니다.
집중 치료에 사용되는 많은 약물은 혈소판 이상을 유발할 수 있지만 일반적으로 임상 적으로 중요하지 않습니다. 소수만이 출혈을 일으킬 수 있습니다.
Acetylsalicylic acid는 혈소판 응집을 차단하고, 억제는 순환 중인 혈소판의 수명(7-10일) 동안 계속되므로 아세틸살리실산을 한 번 섭취해도 충분히 오랜 시간 동안 일차 지혈의 가장 중요한 기능을 차단할 수 있습니다. 이러한 상황에서 수술을 수행해야 하는 경우 일시적으로(3시간까지) 출혈 시간의 연장을 제거하는 데스모프레신의 임명이 표시됩니다. 데스모프레신을 반복 투여하면 효과가 연장됩니다.
NSAID는 혈소판 응집의 중요한 매개체인 트롬복산 A2의 합성을 차단합니다. 이들의 작용은 데스모프레신 투여로 중화될 수도 있습니다.
Dextran 용액은 VIII 인자, von Willebrand 인자의 혈장 농도를 감소시키고 혈소판 기능을 억제하여 출혈 시간을 연장시킵니다. 좋은 체적 대체 효과에도 불구하고 급성 대량 실혈 또는 초기에 긴장된 지혈(혈우병, 혈액계 질환, 간 질환 등)이 있는 경우의 덱스트란 수혈은 이제 최소화되어야 합니다.
뇌졸중이나 심근경색을 겪은 관상동맥질환(CAD) 환자에게 사용되는 클로피도그렐, 티클로피딘, 혈소판 수용체 CPR/IIIa(abciximab)의 현대식 억제제는 혈소판 기능 장애를 일으키고 출혈성 합병증의 위험을 증가시킵니다. 거의 항상 이러한 경우 CPH / IIIa 억제제를 사용하는 상황을 제외하고 desmopressin의 임명이 도움이됩니다. 후자의 경우 혈소판 수혈이 필요할 수 있습니다.
폰 빌레 브란트 병은 혈장에서 폰 빌레 브란트 인자의 결손 또는 부재로 인한 상 염색체 우성 유전성 출혈성 체질입니다. 폰 빌레브란트 요인에는 두 가지 주요 기능이 있습니다. 혈소판 마개 형성에 필요하며 혈장 내 분해로부터 인자 VIII를 보호합니다. 폰 빌레브란트병에는 세 가지 주요 유형이 있습니다(표 2-15).
표 2-15. 폰빌레브란트병: 유형 및 요법 폰빌레브란트 인자 치료 양적 결함 대부분의 경우 데스모프레신 정성적 결함 경증의 경우 데스모프레신; 폰 빌레브란트 인자를 함유하는 인자 VIII 농축물; cryoprecipitate 완전 부재 von Willebrand 인자를 포함하는 Factor VIII 농축물, cryoprecipitate
역학 연구에 따르면 폰빌레브란트병의 발병률은 인구의 1%를 초과하지 않지만 일반적으로 진단되는 빈도는 낮습니다. 이 질병은 월경과다를 가진 여성에게 우세합니다. 출혈이 있는 모든 환자에서 혈액 내 폰 빌레브란트 인자의 양이 결정되어야 합니다.
첫 번째 유형의 질병이 가장 흔하며 폰빌레브란트병 환자의 70-80%를 차지합니다. 이러한 형태의 질병에서는 정상적으로 기능하는 폰 빌레브란트 인자의 양이 감소합니다. 출혈 경향은 일반적으로 경미하지만 심각한 증상이 있습니다.
두 번째 유형은 von Willebrand 요인의 질적 결함이 특징이며, 이는 이 요인의 유전자 돌연변이로 인해 발생합니다.
세 번째 유형은 일반적으로 von Willebrand factor가 없고 혈장 내 factor VIII 농도가 감소하는 것이 특징입니다. 진단은 주로 von Willebrand factor의 농도와 기능 및 활성의 결정에 대한 실험실 검사를 기반으로 합니다. 인자 VIII.
치료는 von Willebrand 요인의 내용과 VIII, 출혈 시간의 세 가지 매개 변수를 정상화하는 것을 목표로합니다. 이것은 내인성 지혈을 자극하는 데스모프레신을 투여하고 폰 빌레브란트 인자를 함유하는 인자 VIII 농축액을 투여함으로써 달성된다. 데스모프레신은 폰빌레브란트병의 첫 번째 유형에서는 효과적이며 두 번째 유형에서는 덜 자주, 세 번째 유형에서는 효과가 없습니다. 정맥 투여의 경우 효과가 거의 번개처럼 빠르며 치료를 계속해야 할 경우 8-12시간 후에 반복 투여합니다. 첫 번째 유형의 desmopressin에서 치료는 von Willebrand 인자를 포함하는 인자 VIII 농축액으로 수행됩니다. VIII인자는 von Willebrand 인자가 없을 때 반감기가 매우 짧기 때문에 순수 factor VIII 농축액은 사용되지 않습니다. von Willebrand factor를 포함하는 모든 factor VIII 농축액은 혈장에서 얻어지기 때문에 바이러스 감염에 의한 수혈 감염을 피하기 위해 바이러스 비활성화를 거친 농축액을 사용해야 합니다. 폰빌레브란트병 치료에 사용을 제한하는 것은 동결침전물의 바이러스성 불안정성입니다. 때로는 특히 점막의 심한 출혈로 섬유소 용해 억제제의 임명에 의존합니다 - tranexamic acid 투여.
폰 빌레 브란트 병 환자는 항응고제, 분 해제, 덱스 트란 수혈을 금합니다. 근육 내 혈종이 발생할 위험이 높으므로 근육 내 주사를 주어서는 안됩니다.
응고 캐스케이드의 장애
응고 캐스케이드의 병리학으로 인한 질병에서 섬유소 형성은 궁극적으로 중단됩니다. 질병의 선천적 특성에서 혈장에는 하나의 응고 인자가 없지만 후천성 질병에서는 여러 인자의 결핍이 관찰됩니다(예: 간 질환으로 인한 지혈의 이차 장애, 비타민 K 결핍, 사용 항응고제).
AIV 혈우병
혈우병 - 선천성 질환응고 시스템, 열성 성 연관 유형에서 유전되고 인자 VIII(혈우병 A) 또는 인자 IX(혈우병 B)의 결핍으로 인해 발생합니다. 임상 적으로이 두 가지 형태의 질병은 동일하며 혈액 내 각 요인의 농도를 검사해야만 구별됩니다.
혈우병 A의 발병률은 신생아 5,000명 중 1명이며, 혈우병 B는 신생아 30,000명 중 1명입니다. 따라서 혈우병 환자의 80%는 혈우병 A, 20%는 혈우병 B를 가지고 있습니다.
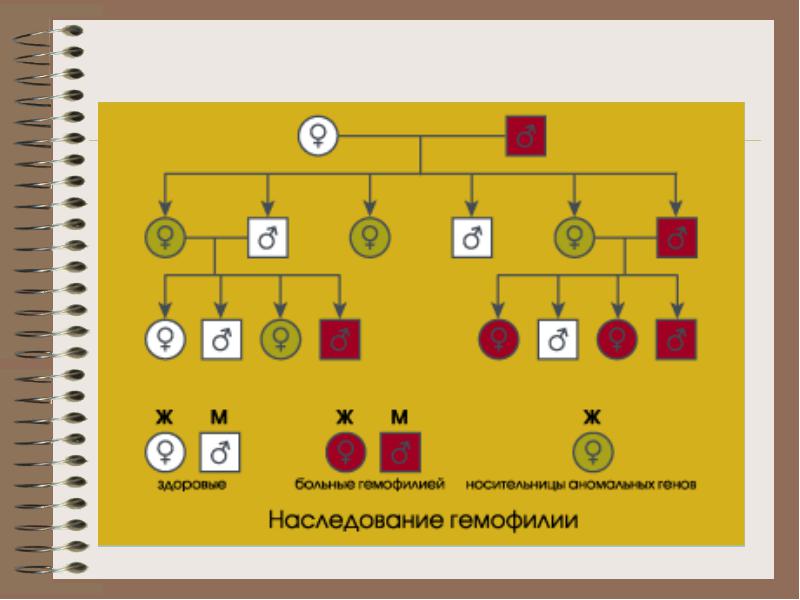
인자 VIII과 IX에 대한 유전자는 여성 X 염색체에 연결되어 있으므로 혈우병은 남성에게만 영향을 미치고 여성은 보인자가 됩니다. 여성 보균자의 경우 혈우병에 걸린 남아를 낳을 위험은 25%이고 보인자 여아도 25%입니다. 혈우병이 있는 남성의 경우 딸은 항상 보균자이고 아들은 항상 건강합니다.
혈우병의 임상 증상은 혈액 내 인자 VIII 또는 IX의 농도에 따라 다릅니다. 그들의 활동은 국제 단위(IU)로 결정됩니다. 일반적으로 인자 VIII 또는 IX의 활성은 혈장 1ml당 약 1IU입니다. 혈우병의 중증도에는 세 가지 정도가 있습니다(표 2-16).
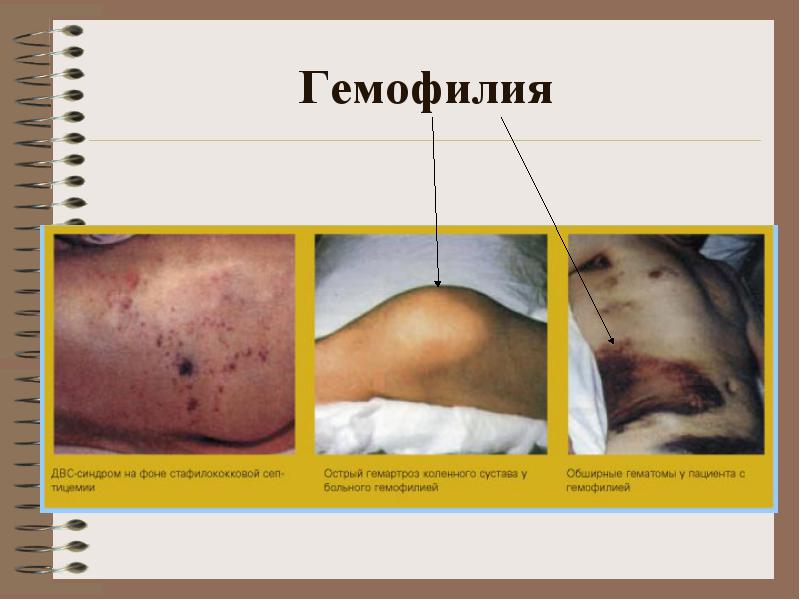
표 2-16. 혈우병의 중증도 중증도 VIII 인자 농도, t/t 인자 IX 농도, IU/dL 경도 혈우병 A 5-25 100 중등도 혈우병 A 1-4 100 중증 혈우병 A 일반적으로 중증 형태의 혈우병 환자는 집중 치료가 필요하며, 임의의 장기 및 조직에서 자발적 출혈 및 출혈이 발생할 수 있는 재발성입니다. 관절의 출혈은 근육에서 혈우병 관절 병증의 발병으로 이어집니다. 연조직에서 압박 증후군을 유발할 수 있습니다. 캡슐화되고 반복되는 출혈의 결과로 천천히 증가하여 주변 조직을 짜내는 가성 종양이 형성됩니다. 두개내 출혈은 혈우병 환자의 가장 흔한 사망 원인 중 하나입니다.
경증 혈우병은 때까지 인식되지 않는 경우가 많습니다. 성숙한 나이소년, 외과 적 개입이 필요한 경우 처음으로 감지 할 수 있습니다. 중증 혈우병은 보통 1~2세 소년이 걷기 시작할 때 진단됩니다. 첫 번째 징후는 관절 출혈, 유치한 장난으로 인한 피하 혈종 또는 근육 주사일 수 있습니다. 응고도에서 APTT의 연장은 정상적인 프로트롬빈 및 트롬빈 시간과 출혈 시간으로 나타납니다. 진단은 인자 VIII, IX 및 von Willebrand의 농도를 검사하여 확인합니다.
치료를 위해 기증자 혈장 또는 유전자 기술을 사용하여 얻은 인자 VIII 또는 IX의 농축물이 사용됩니다. 응고 인자의 현대 농축물은 바이러스에 안전하고 매우 효과적입니다. 인자 농축액의 용량을 계산할 때 수술 당일 및 수술 중 수혜자의 혈액 내 지혈 농도를 50% 이상 유지해야 합니다.
수술 후 기간의 14일. 일반적으로 단일 투여에 필요한 인자 VIII 또는 IX의 IU량은 다음과 같이 계산됩니다.
혈액량(ml) = 체중(kg)의 7%; 예를 들어, 70kg의 7% = 4900ml;
혈장 용적(ml) = 혈액 용적(ml)의 60%; 4900ml의 60% = 2940ml;
인자 VIII IU = 50% 혈장 부피(ml); 그. 이 예에서는 1470IU입니다.
인자 VIII 농축액에 대한 정맥내 투여 빈도 - 매
h, 인자 IX의 경우 - 매 12시간마다.
A형 혈우병 환자의 약 30%에서 인자 VIII 농축액으로 치료하는 동안 약물의 응고촉진 활성을 차단하는 항체가 혈액에 나타나므로 억제제라고 합니다. 혈우병 B에서는 억제제의 발생률이 더 적습니다. 억제제 역가는 Bethesda 단위(BU)로 측정됩니다. 하나의 BU는 테스트 시스템에 도입된 인자 VIII의 50%를 억제하는 억제제의 양과 같습니다. 낮은 BU 역가(5-10 BU)는 인자 용량을 증가시켜 극복할 수 있지만, 높은 BU 역가(10 BU 이상)는 주사된 약물의 전량이 되기 때문에 지혈 효과를 얻는 것이 불가능합니다. 항체에 의해 차단됩니다. 항체를 제거하기 위해 혈장분리반출법이 권장되며(제거된 혈장은 VIII 인자가 포함되어 있으므로 제거된 혈장을 공여자 FFP로 대체해서는 안 됨) 글루코코르티코이드가 처방됩니다. 최근에는 재조합 활성화 인자 VII와 활성화 프로트롬빈 복합 농축물이 이러한 상황에서 널리 사용되고 있습니다. 그러한 환자의 치료를 수행 할 때 응고 학자와상의하는 것이 필수적입니다.
요인 VII의 결핍
조직 인자에 결합하는 응고 인자 VII가 활성화되어 응고 과정이 시작되는 방아쇠가 됩니다. 선천적 인자 VII 결핍의 유전적 변이는 거의 진단되지 않습니다. 임상 적으로 경미한 부상, 장기간의 난치성 코 및 자궁 출혈로 타박상이 형성됩니다. 심각한 인자 VII 결핍(1% 미만)의 경우 혈우병(혈우병, 관절염, 복막후혈종 및 뇌내출혈)과 같이 출혈이 발생할 수 있습니다. 이 경우 APTT는 정상 범위를 유지하지만 프로트롬빈 시간과 INR이 증가합니다. 최종 진단을 위해서는 혈액 내 인자 VII의 활성을 연구할 필요가 있습니다.
인자 VII의 후천성 결핍은 간 질환, 와파린 치료, 비타민 K 결핍으로 발생합니다. 동시에 다른 비타민 K 의존성 응고 인자(II, IX, X)의 농도가 혈액에서 감소합니다.
치료는 대체입니다. FFP 수혈은 인자 VII의 공급원으로 사용되며 프로트롬빈 복합 농축물이 처방됩니다. 최근에 재조합 활성화 인자 VII가 의사의 무기고에 나타났습니다. 이는 인자 VII 결핍 치료와 억제 형태의 혈우병 및 혈소판 감소성 출혈의 치료에서 모두 입증되었습니다. 지혈을 달성하려면 환자의 혈액에서 인자 VII의 농도를 15-20%로 증가시켜야 합니다. 재조합 활성화 인자 VII의 권장 용량은 90-120 mg/kg IV입니다.
출혈을 멈추는 데 3시간. 검사실 모니터링은 효과를 조절하고 용량을 명확히 하고 혈전색전성 합병증의 위험 가능성을 배제하는 데 필요합니다.
혈장 수집 인자의 기타 선천적 결핍
인자 XI 결핍(혈우병 C)은 뚜렷한 민족적 성격의 선천적 출혈성 체질이며 주로 유대인과 아르메니아인들 사이에서 진단됩니다. 요인 XI의 함량이 10% 미만인 경우 다양한 국소화(비강, 월경과다, 산후, 외상 후)의 반복 출혈이 발생합니다. APTT가 길어지고 프로트롬빈 시간이 정상 범위 내에 있습니다. 출혈 증가와 함께 인자 XI의 결핍을 검사실에서 확인할 수 없는 경우 기증자 FFP 수혈을 처방해야 합니다. 항섬유소용해제(트라넥삼산 및 아미노카프로산)의 사용은 효과가 없으며 혈뇨에 금기입니다.
Afibrinogenemia는 빈번한 자발적인 심한 출혈로 나타나는 매우 드문 출혈성 체질입니다. 저섬유소원혈증에서 자연출혈은 섬유소원 농도가 0.5g/l 미만일 때만 발생합니다. APTT 및 프로트롬빈 시간이 상당히 연장됩니다. 진단은 피브리노겐 함량에 대한 실험실 검사로 확인됩니다. 치료는 FFP, 동결 침전물 또는 섬유소원 농축물의 수혈입니다.
Dysfibrinogenemia - 이질적인 그룹 유전 질환피브리노겐 기능 장애와 함께. 때때로이 기능 장애는 섬유소 용해에 대한 섬유소 응고의 저항성, 더 자주 섬유소 용해에 대한 민감도 증가로 나타납니다. 첫 번째 경우에는 혈전 형성이 증가하는 경향이 있고 두 번째 경우에는 출혈이 발생하는 경향이 있습니다. 진단 확인 후 치료 (응고 전문의의 참여) - FFP 수혈, 덜 자주 - 섬유소 유전자 임명.
프로트롬빈의 고립된 선천적 결핍, 인자 V, X,
XII, XIII는 집중 치료 의사의 진료에서 극히 드뭅니다. 이러한 장애는 특정 임상 양상을 나타내지 않으며, 진단을 위해서는 응고도에 대한 선별 연구뿐만 아니라 특정 응고 인자 농도에 대한 특정 분석이 필요합니다. 출혈의 원인이 발견되면 FFP를 수혈합니다.
항인산염 증후군 및 루푸스 항응고제
혈액에서 항인지질 항체 및 / 또는 루푸스 항응고제의 동시 검출과 함께 혈소판 감소증의 배경에 대한 정맥 또는 동맥 혈전증의 징후와 함께 점막 출혈은 항인지질 증후군 및 그 심각한 형태 - 치명적인 항인지질 증후군을 특징으로 합니다. 이 증후군은 전신성 홍반성 루푸스, 콜라겐 질환, 암, 감염 및 임신에서 발생합니다. 비극적인 사례가 많다. 항인지질 증후군특발성이다. 이 증후군은 인지질, 특히 카디오리핀에 대한 자가항체의 형성을 기반으로 합니다. 후자는 프로트롬빈의 일부인 단백질(32-glycoprotein-1(p2-CP1))과 복합체를 형성한다. 이러한 이유로 파국성 항인지질 증후군 환자의 혈장에는 항응고 활성이 있으며, "루푸스 항응고제"의 함량이 항인지질 증후군에서는 모든 프로트롬빈 의존성 검사가 연장됩니다.동시에 APTT t UIGO의 연장에도 불구하고 응고 시간 t VIVO가 손상되지 않아 높은 항인지질 증후군에서 혈전증의 위험.
치명적인 항인지질 증후군의 치료는 복잡합니다. plasmapheresis의 배경에 대해 UFH, prednisolone이 처방됩니다. 효과가 없으면 메틸프레드니솔론을 사용한 펄스 요법이 수행됩니다. 제거된 혈장은 기증자 FFP로 보충됩니다. 종종 장간막 혈관의 총 혈전증으로 예후를 크게 악화시키는 외과 적 개입에 의존해야합니다.
간경화
간 질환에서 많은 응고 인자 및 억제제의 합성 감소로 인한 지혈 균형의 복잡한 위반은 병리학 적 출혈의 발생을 동반합니다. 이것은 혈소판의 수와 기능을 감소시키고 섬유소 용해를 증가시키며 프로트롬빈 시간을 연장하고 INR을 증가시킵니다. 간경변증에서 흔히 볼 수 있는 비장종대가 혈소판 감소증을 악화시킵니다. 심한 출혈이나 수술의 경우 FFP 수혈, 재조합 활성화 인자 VII의 도입, 프로트롬빈 복합체가 처방됩니다. Tranexamic acid와 desmopressin은 속효성입니다.
파종 성 혈관 내 응고
DIC는 내피 세포, 혈소판 (일차) 지혈, 혈장 응고 시스템 및 섬유소 용해를 포함하여 균형을 결정하는 모든 지혈 균형 시스템의 상호 작용을 완전히 위반합니다. DIC는 출혈과 미세혈전증이 동시에 존재하여 장기와 MOF가 빠르게 발달하는 것이 특징입니다. ICE 현상(M.S. Machabeli와 Z.S. Barkagan의 작업이 우리나라에서 주도적인 역할을 한)을 해독하는 것은 패혈증, 대량 출혈, 화상, 뱀 물림, 임신 합병증, 기타
중환자 실에서 DIC는 패혈증, 대량 출혈(특히 산부인과), 외상, 종양 및 혈액 질환의 배경에 대해 가장 자주 발생합니다.
발병의 병인 및 메커니즘
ICE의 발전은 아래와 같이 다양한 이유와 조건에 기인할 수 있습니다. 대부분의 경우 내연 기관은 급성 (번개처럼 빠른) 과정의 특성을 취하며 덜 자주 만성 과정이 관찰됩니다.
DIC 증후군 발생 이유 :
모든 병인의 쇼크(혈량저하 및 저산소증).
감염.
부패.
박테리아.
바이러스.
곰팡이.
상해
화상.
충돌 증후군.
-ChMT.
지방 색전증.
주요 외과 수술.
임신과 출산의 합병증
심한 자간증.
태반 조기 박리.
자궁 내 태아 사망.
색전증 양수.
HENR 증후군.
아나필락시스
뇌졸중
급성 혈관내 용혈
혈관 보철물
뱀에 물린
신생물
선암종.
혈모세포증.
간 질환
경화증.
급성 전격성 간염.
지혈 시스템 연결의 병리학 적 활성화는 다양한 요인에 의해 발생할 수 있습니다. 감염, 중독, 산증 및 저산소 혈증 동안 내 독소에 의한 내피 세포의 활성화는 막 표면에 조직 인자의 출현을 동반합니다. 혈장 응고 시스템은 외상, 패혈증, 임신 합병증, 조혈모세포증의 결과로 조직 인자의 방출에 의해 활성화됩니다.
응고의 전신적 활성화는 혈류에서 과도한 양의 순환 트롬빈을 형성하여 일반화된 섬유소 형성, 인자 VIII 및 V의 활성화 및 소비, 혈소판 활성화를 유발합니다. 결과적으로 미세 순환 시스템에서 대규모 미세 혈전 형성 과정이 유발되어 MOF가 발생하고 내피 세포 손상이 악화됩니다. 반면에, 일반화된 섬유소 형성은 섬유소 용해 시스템을 활성화하고 섬유소 용해의 활성제는 활성화된 내피 세포, 혈소판 및 백혈구에서 방출되며 활발하게 소비됩니다.
지혈의 이 대규모 전신 활성화는 모든 응고 인자, 혈소판 및 억제제의 빠른 소비로 이어집니다. DIC 동안 혈소판의 소비는 매우 빠르게 진행될 수 있으며 골수 생산은 순환하는 혈소판 풀을 보충할 시간이 없습니다. 또한 순환하는 혈소판은 섬유소 분해 산물에 노출되어 기능적으로 결함이 있습니다. 간 질환에서 간부전으로 인한 단백질 합성 감소는 응고 인자 및 그 억제제의 결핍을 심화시키는 데 기여합니다. 또한, 패혈증의 경우 세균성 프로테아제, 췌장 괴사의 경우 췌장 효소, 양수 색전증의 경우 태아에 가까운 체액에 의한 응고 인자의 병리학적 파괴가 중요합니다. 이러한 과정의 결과는 혈소판 감소증, 과섬유소 용해 및 응고 인자 결핍으로 인한 출혈입니다.
임상 징후
DIC의 임상 증상 범위는 원인이 된 원인(DIC는 항상 이차적이며, 조직학적 형태가 아니라 항상 일부 기저 질환과 관련된 증후군)과 발병에 수반되는 조건에 따라 다릅니다. 파종성 혈관내 응고(DIC)의 급성 과정에서 그 징후는 PON의 징후일 수 있으며, 이는 중추 신경계, 신장, 간, 폐 기능 장애의 손상을 나타냅니다. 대사성 산증, 단백뇨, 저산소증, 저혈압 및 발열이 특징적입니다. 출혈 징후로는 피부의 점상출혈 및 반상출혈, 점막의 자연출혈, 주사 부위 및 수술 상처 출혈, 심한 경우 뇌내출혈 등이 있습니다. 미세혈전증은 허혈성 손상을 유발합니다. 내장, 주로 뇌, 폐, 신장 및 간. 진피와 진피 아래의 혈관 혈전증은 손가락이나 발가락의 괴저가 발생할 수 있는 극청색증(acrocyanosis)을 동반합니다. DIC의 허혈성 징후는 의식의 신경학적 장애(기면, 빠른 피로 및 질문에 대한 단음절 반응), 호흡의 빈도 및 리듬 장애, 핍뇨 또는 무뇨증, 저알부민혈증 및 저프로트롬빈혈증을 동반한 저산소증 및 저산소증으로 나타납니다.
진단
파종성 혈관내 응고의 1차 진단은 전적으로 출혈성 및 허혈성 징후를 포함한 임상 양상에 기초합니다. 급성 파종성 혈관내 응고 증후군의 과응고 단계와 저응고 단계를 구별하는 반면, 파종성 혈관내 응고의 과응고 단계는 만성 과응고 증후군(상태)과 구별해야 합니다. 데이터.
과응고성 증후군 - 항응고제 메커니즘에 의해 보상되는 혈액 응고 준비도 증가. 그것으로 혈관계에 국소 또는 파종 혈전이 없으며 혈전증의 임상 증상은 없습니다. 그러나 실험실 데이터에서 APTT의 단축, 프로트롬빈 시간, 혈소판 활성 증가, 섬유소 용해 감소 및 시험관에서 빠른 응고 형성이 주목됩니다.
DIC의 과응고 단계는 종종 일시적이며 의사가 진단하지 못할 수 있습니다. 장기 허혈의 임상 징후가 나타납니다. 과응고성(APTT, 프로트롬빈, 혈소판 활성화)의 모든 실험실 징후가 뚜렷하지만 동시에 응고 인자 소비의 첫 번째 초기 징후(혈소판 수, 항트롬빈 III 농도, 단백질 C)가 나타납니다. 테스트 튜브에서 다소 빨리 형성되지만 느슨하고 불안정합니다. 중요한 증상은 종종 정맥 천자 중 바늘이나 카테터의 빠른 혈전증입니다.
DIC의 저 응고 단계는 확산 출혈 체질 (점상 출혈 유형의 출혈)의 징후와 지혈 시스템의 응고 인자 소비의 실험실 마커 - 출혈 시간 연장, APTT, 프로트롬빈 시간, 상당한 감소 혈소판 수 및 기능 장애, 피브리노겐 농도 감소, 인자 VIII, B-이량체의 출현.
치료
ICE 요법의 핵심은 그것을 시작한 병리학적 과정의 완화입니다. 그러나 이러한 질병의 병인 요법(패혈증에 대한 항생제, 종양에 대한 화학요법 또는 수술, 급성 혈관내 용혈에 대한 혈장교환술 등)은 일정 기간 후에만 효과를 나타냅니다. 이것이 BCC의 회복 및 유지, 적절한 산소 공급 및 미세 순환을 개선하기 위한 저혈압 교정을 보장하기 위해 수반되는 치료 조치가 중요한 이유입니다.
동시에 DIC의 징후로 악화되는 환자의 심각한 상태로 인해 지혈 시스템의 수혈 장애를 신속하게 교정해야합니다.
DIC의 과응고성 단계의 치료에서 미세 혈전증으로 인한 장기 허혈의 임상 증상이 있을 때 나트륨 헤파린이 처방됩니다. 나트륨 헤파린은 트롬빈의 활성을 억제하여 섬유소 형성을 감소시킵니다. 일반적으로 의약 물질 디스펜서를 사용하여 일정한 정맥 내 투여로 8-10 MEDKhch를 처방합니다 (infusomat). 혈장에 충분한 양의 안티트롬빈 III가 있는 경우 나트륨 헤파린이 효과적으로 작용한다는 것을 기억해야 합니다. 감소하면 FFP (10 ml / kg)를 수혈하거나 항트롬빈 III의 상용 약물 (최대 3000 IU / day)을 처방해야합니다. 나트륨 헤파린 요법의 효과에 대한 기준은 섬유소 및 B-이량체의 분해 산물 농도 감소, 섬유소원 함량 증가 및 프로트롬빈 시간 단축입니다. 이 상황에서 저분자량 헤파린의 사용은 효과가 불충분하고 모니터링이 불가능하기 때문에 비실용적입니다. 항응고제로서 V 및 VIII 인자의 활성화를 억제하고 트롬빈 형성을 감소시키는 활성화된 단백질 C는 패혈증 병인의 DIC 증후군 치료에서 입증되었습니다.
훨씬 더 자주 집중 치료 의사는 DIC의 저응고 단계를 만납니다. 여기서 수혈 요법은 응고 인자 결핍의 보충에 주도적인 역할을 합니다. DIC는 지혈 시스템의 복잡한 위반이므로 최적의 세트가 필요한 모든 응고 인자를 포함하는 복합 수혈 매체인 FFP의 수혈은 치료에서 "첫 번째 바이올린"을 담당합니다. FFP 수혈의 목적은 피브리노겐 농도를 1-1.5g/L 이상으로 높이는 것입니다. 치료 용량은 15-20 ml / kg의 비율로 FFP 수혈입니다. 지혈이 없는 경우, 응고 인자 농도에 대한 실험실 제어하에 FFP를 재투여하는 것이 가능합니다. 특히 혈액 내 농도가 70% 미만인 경우 FFP 수혈에 항트롬빈 III 약물을 추가해야 하는 경우가 있습니다. 순환 과부하의 위협으로 부피를 줄이기 위해 동결 침전물 수혈이 사용됩니다 (체중 10kg 당 1 회 투여). 파종성 혈관내 응고의 치료에 혈장교환술을 사용하는 것은 기저 질환의 치료(예: ABO 시스템의 항원과 양립할 수 없는 적혈구 수혈로 인한 급성 혈관내 용혈)와 순환 과부하 예방을 목표로 합니다. 많은 양의 혈장이 수혈되어야 할 때.
DIC 증후군의 혈소판 수혈은 출혈이 발생하고 수의 감소가 50x109 / l 미만인 경우에만 나타납니다. 혈소판 수혈의 목적은 일반적으로 수혈당 체중 10kg당 1단위의 혈소판 농축액(55-70x109)이 필요한 이 값을 초과하는 것입니다. 혈소판의 현저한 소비로 인해 24시간마다 반복적인 수혈이 필요합니다.
적혈구 수혈은 혈류 내 적혈구 부족으로 인한 저산소혈증 및 조직 저산소증의 확인된 징후가 있는 건강상의 이유로만 표시됩니다.
DIC의 실험실 징후가있는 일부 환자는 혈전증의 임상 증상이나 출혈 경향이 없음을 기억하는 것이 중요합니다. 이러한 환자는 지혈의 수혈 교정이 필요하지 않으며 기저 질환에 대한 치료를 받아야 합니다.
참조 ^
실용 수혈학 / Ed. 미군 병사. 코지넷. - M .: 실용 의학, 2005 .-- 544 p.
Shevchenko Yu.L., Shabalin V.N., Zarivchatskiy M.F., Selivanov E.A. 일반 및 임상 수혈학 지침. - SPb .: Foliant, 2003 .-- 608 p.
KH ^ aars! T., Thanera, W.R.K., Voyzhs! K. e * a1. PHANTASOCTEILC $ o ^ hematinatus: acPua ^ ec! acr VII m raita paraien m1 \\ seuere Neec11ng // Cn. 세이지. - 2006. - Yo1. 10. - 104페이지.
Maginostir II., Kepe * S., Segala E. e1 al. 케소시판!; asPua ^ eu! Gacigor VII br apypsyue letor-rHage const 1; haita //]. 트가이타. - 2001. - Yo1. 51. - P. 431-438.
Utsep !:].B., Ko $$ at1: K., Cui V. e * a1. Kesottepc1a1: 태양 $ op le 및 $ eo! "Reotmantan! Acy-ya * ec1 ^ ac1; og VII as a af" upsNue 1; 실제: tep1; Ror ma $$ le Nec11ng-a European regresse // Cn (. Car.-2006.-Vo1.10.-P. 120.
괴혈병 환자는 피부에 출혈하는 잇몸과 점상출혈이 있습니다. 이 질병에서 지혈 장애의 원인은 무엇입니까?
A. @ 콜라겐 합성 방해
B. 혈소판 감소증
C. 과도한 항응고제
D. 섬유소용해의 활성화
E. 응고촉진제의 결핍
출혈성 증후군이 있는 소년의 혈액에는 항혈우병 글로불린 A(인자 VIII)가 없습니다. 이 환자에서 어떤 혈액응고 기전이 불충분합니까?
@ 프로트롬비나제 형성의 내부 메커니즘
피브리노겐에서 피브린으로의 전환
프로트롬비나제 형성의 외부 메커니즘
프로트롬빈을 트롬빈으로 전환
혈전의 수축
2년 전부터 만성골수성백혈병을 앓던 남자가 급성신부전증으로 병원에 입원했다. 이 환자에서 급성 신부전의 원인은 무엇입니까?
@ DIC - 증후군
림프구감소증
호중구감소증
혈소판 감소증
어떤 혈액 응고 인자의 불충분한 활동이 비타민 K 결핍 환자에서 출혈성 증후군의 발병을 유발합니까?
@ X, IX, VII, II
폰 빌레브란트 요인
아세틸살리실산을 정기적으로 사용하는 환자는 출혈이 있습니다. 이 경우 혈소판 병증의 발병은 혈소판 효소의 활성 감소와 관련이 있습니까?
@ 사이클로옥시게나제
리폭시게나제
과산화효소
시토크롬 산화 효소
포도당-6-인산 탈수소효소
소녀는 주기적으로 코피를 흘리며 작은 출혈성 피부 발진이 나타납니다. 검사 결과 : 출혈 시간-10 분, 혈소판의 접착력 감소 및 f의 낮은 활성. VIII (VIII: C). 아이는 어떤 질병을 가지고 있습니까?
@ 폰빌레브란트병
혈우병 A
혈우병 B
유전성 섬유소원 혈증
혈소판 감소증
인후염 후, 5세 소녀는 몸통과 사지의 피부에 점상 발진이 있고 잇몸에서 출혈이 있습니다. 검사 결과 혈액 내 혈소판 수가 감소한 것으로 나타났습니다. 혈소판 감소증(G/L)의 어느 수준에서 임상 징후가 나타납니까?
하지 정맥의 혈전 정맥염으로 고통받는 환자의 혈전 성병 발병 기전의 주요 연결 고리는 무엇입니까?
@ 항응고제 부족
혈소판 감소증
혈소판병증
응고촉진제 부족
혈액 응고 시스템의 어떤 변화를 진단하기 위해 처방된 혈액 내 피브린 분해 산물의 수준에 대한 연구가 있습니까?
혈소판병증
혈소판 감소증
출혈성 혈관병증
환자는 혈소판이 콜라겐에 부착되는 초기 단계를 담당하는 폰 빌레브란트 인자 - 당단백질(GP) Ib에 대한 막 수용체의 유전적 결함으로 진단되었습니다. 이 질병의 이름은 무엇입니까?
@ 베르나르 - Soulier
Von Willebrand
애디슨 - 버머
윌슨 - 코노발로프
글랜츠맨 - 네겔리
환자는 피브린과 혈소판막의 연결을 보장하고 응집에 필요한 막 수용체인 GP IIb – IIIa의 유전적 결함으로 진단되었습니다. 어떤 종류의 질병에 대해 이야기하고 있습니까?
@ 글랜츠맨 - 네겔리
Von Willebrand
애디슨 - 버머
윌슨 - 코노발로프
베르나르 - 술리에
복합 면역 결핍증이있는 어린이의 혈액 검사에서 콜라겐에 대한 혈소판 부착 감소, 응집, 혈액 응고 약화 및 혈전 수축이 나타났습니다. 어떤 면역 결핍에서 그러한 변화가 관찰됩니까?
@Wiskott - 알드리치
스위스형
디 - 조지
네젤로프
아픈 소녀는 Glantsman의 혈소판 쇠약으로 진단되었습니다. 이 경우 지혈 시스템에서 어떤 위반이 발생합니까?
@ 분해혈소판병증
절대 혈소판 감소증
접착성 혈소판병증
혈소판 결핍증
탈과립성 혈소판병증
북쪽에 있던 원정대원들은 잇몸 출혈과 피부 점상출혈을 호소했다. 식단에 아스코르브산이 부족하여 혈관벽이 취약하다는 것은 기억상실증(anamnesis)에서 알려져 있습니다. 혈관병증의 병인은 무엇입니까?
@ 플라스틱
염증성
변성
영양실조
면역
췌장에 장기간 수술을 한 환자에서 수술 후 상처에서 오랫동안 출혈이 있었습니다. coagulogram의 데이터에 따르면, 플라스민 수준의 상당한 증가가 발견되었습니다. 이 경우 관찰되는 응고병증의 병인은 무엇입니까?
@ 섬유소병증
프로트롬빈병증
혈소판병증
혈소판병증
혈관병증
환자는 항혈전성 트롬보모듈린-단백질 C 복합체에 의한 비활성화에 둔감해지는 인자 V의 유전적 결함으로 진단되며, 이는 혈관벽이 섬유소 형성을 제한하는 능력을 감소시킵니다. 이 이상 현상으로 인해 어떤 혈액 응고 병리가 발생합니까?
@ 혈전증
혈소판 감소증
혈소판병증
출혈성 증후군
혈액이 혈관 내강에서 응고되거나 혈관벽을 통해 스며들지 않고 액체 상태로 유지되는 메커니즘의 복합체를 지혈이라고 합니다. 혈액 응고와 관련된 병리학적 상태는 다음 강의에서 논의되므로 여기에서는 지혈 장애와 관련된 다른 변화를 고려해야 합니다.
출혈(출혈, 그리스어 haima - 혈액 및 라인 - 흐름)은 혈관 바닥 또는 심장 외부의 환경(외부 출혈) 또는 체강, 속이 빈 기관의 내강(내부 출혈)으로 혈액이 방출되는 것입니다. 외부 출혈의 예로는 메트로과다(자궁), 흑색변(장), 내부 출혈 - 혈심낭, 혈흉, 혈복막 및 관절증(심낭, 흉막, 복강또는 조인트).
출혈의 원인에 따라 동맥, 정맥, 동맥-정맥(혼합), 모세관, 실질(실질 기관의 모세관) 및 심장으로 나뉩니다.
특정 유형의 출혈은 혈액이 조직에 혈관외로 축적되는 출혈입니다. 네 가지 유형이 있습니다.
혈종 - 조직의 완전성과 공동 형성을 위반하는 출혈;
출혈성 함침 (침투) - 조직의 무결성을 유지하면서 출혈;
멍 (멍) - 피부, 피하 조직, 점막의 평면 출혈;
점상출혈은 피부, 점막, 장액막, 내부 장기에 점상 출혈이 있습니다.
다발성 점상출혈이 합쳐져 더 커지는 것을 출혈성 자반병이라고 하고 직경 2cm까지의 멍을 반상출혈이라고 합니다.
출혈과 출혈의 발생 메커니즘은 다음과 같습니다.
손상되지 않은 혈관에 대한 외상 또는 괴사(심근경색에서 심장 파열), 염증(대동맥 파열을 동반한 매독 중동맥염), 영향을 받은 혈관벽의 동맥류로 인한 파열(렉신당 출혈);
염증(일반적으로 화농성), 악성 종양, 괴사(출혈결핵강 내 괴사), 화학물질 노출(위액은 위궤양), 나팔관 혈관의 발아 융모막 융모 자궁외 임신;
Diapedesis (diapedesin 당 출혈, 그리스 dia-through, pedao-jumping), 일반적으로 심한 저산소증, 중독, 감염, 다양한 응고 병증, 출혈성 체질. 상대적으로 종종 당뇨병 성 출혈은 고혈압 위기, 전신 혈관염, 백혈병, 혈우병, 요독증에서 발생합니다.
경미한 손상에도 자발적인 출혈이나 출혈이 일어나는 경향을 출혈 체질이라고 합니다. 이 상태는 유전 및 후천 모두에서 혈소판의 질적 또는 양적 변화, 혈액 응고 부족, 병리학적 취약성 또는 혈관벽의 투과성 증가와 관련이 있습니다.
출혈(출혈)의 주요 원인은 다음과 같습니다.
1. 선천적 결함, 감염 및 중독, 비타민 저하증 및 비타민 증, 스테로이드 요법에서 혈관벽의 취약성 증가가 관찰됩니다.
2. 혈소판 결함. 여기에는 모든 기원의 혈소판 감소증, 유전성 또는 후천성 접착 약화(von Willebrand 질병, Bernard-Soulier, 유전성 출혈성 체질 등), 혈소판 응집 약화 또는 분비 감소가 포함됩니다.
3. 선천적 응고 인자의 부족(인자 VIII에 의한 혈우병 A, 인자 IX에 의한 혈우병 B, 폰 빌레브란트병, 기타 혈액 응고 인자) 또는 더 자주 후천적 기원(간 질환, 비타민 K 결핍, 일부 면역 병변 포함);
4. 과도한 혈관내 응고, 예를 들어 파종성 혈관내 응고 - 파종성 혈관내 응고 증후군(다음 강의 참조).
출혈의 결과는 유리할 수 있고(유출되는 혈액의 흡수, 조직화, 캡슐화, "녹슨" 낭종의 형성) 바람직하지 않을 수 있습니다(감염이 합류할 때 화농).
출혈의 의미는 유형, 중증도 및 기간 때문입니다. 따라서 hemopericardium의 형성과 함께 심근 경색증의 심장 파열은 환자의 사망으로 빠르게 이어지지만 유출 된 총 혈액량은 일반적으로 100-200g을 넘지 않습니다. 동맥 출혈, 대량 출혈 및 치명적인 결과를 초래하는 급성 빈혈이 발생할 수 있습니다. 만성 위 또는 십이지장 궤양으로 인한 장기간의 경미한 출혈은 만성 출혈성 빈혈을 유발합니다. 출혈의 중요성은 우선 그 국소화와 그 크기에 달려 있습니다. 뇌의 작은 출혈조차도 중요한 중추 손상, 뇌부종 및 환자의 사망을 유발할 수 있는 반면, 피하 조직의 단순하지 않은 대규모 출혈은 생명에 위협이 되지 않습니다.
Plasmorrhage는 증가된 혈관 투과성으로 인한 주변 조직의 함침(plasma impregnation)과 함께 혈장 혈관의 내강으로부터의 출구입니다. Plasmorrhage는 한외여과(정수압 또는 삼투압의 증가로 인해 내피 기저막의 기공을 통한 혈장 배출), 확산(내강 및 혈관 외부의 혈장 성분 기울기로 인한), 미세소포 수송으로 인해 경내피적으로 발생합니다. (효소 내피계의 활동으로 인해 발생하는 미세음세포증 또는 세포감소증) ... 내피 혈장 출력도 가능합니다. 따라서 혈장 출혈은 혈관벽(주로 내막)의 손상과 혈액 상수의 변화에 의해 결정됩니다. 형태 학적 연구 동안 미세 혈관의 혈관 벽이 두꺼워지고 균질 해지며 전자 현미경 검사 중에 많은 수의 미세 소포, fenestra 및 터널의 형성, 세포 간 간격의 출현 및 기저막의 풀림 팽창된 내피 세포에서 내막이 관찰됩니다. 혈장 성분의 축적은 혈관벽과 혈관주위 조직 모두에서 세포 및 세포간 물질에 손상을 일으키며, 그 결과 유리질증이 발생하고 심한 경우에는 섬유소 괴사가 발생합니다.
쇼크는 지혈에 대한 초강력 효과 후 순환 허탈(급성 순환 부전)을 특징으로 하는 심각한 병리학적 상태입니다. 저혈량, 심장, 패혈증 및 혈관 유형의 쇼크가 있습니다.
저혈량성 쇼크는 급성 실혈, 탈수에서 관찰되는 순환 혈액량이 20% 이상 급격히 감소하여 발생합니다. 따라서 심한 구토, 심한 설사와 함께 광범위한 화상 (손상된 미세 순환 혈관에서 혈장의 방출로 인해)으로 체액과 전해질의 손실이 가능합니다.
심장 쇼크는 심장 손상의 경우 뇌졸중 볼륨의 감소에 대한 반응으로 발생하며 심근 경색, 중증 심근염, 급성 승모판 또는 대동맥 기능 부전, 인공 판막 혈전증, 심실 중격 파열, 심장 셔츠의 혈액 탐폰에서 관찰됩니다. 혈압이 현저하게 떨어지면 저혈량 변화와 유사한 조직 혈액 공급이 크게 감소합니다.
패 혈성 (독성-감염성) 쇼크는 그람 음성 (E. coli, Proteus, Klebsiella 등), 덜 자주 그람 양성 (포도상 구균, 연쇄상 구균, 폐렴 구균) 미생물에 의한 감염이있을 때 발생합니다. 방출된 독소(주로 내독소)는 보체, 응고, 섬유소 용해 시스템, 혈소판 및 호중구를 활성화합니다. 그 결과, 급성 순환 장애를 일으키는 산화질소(강력한 혈관 확장제), 종양 괴사 인자 a 및 인터루킨의 형성이 자극됩니다.
혈관(재분배) 쇼크는 전신적인 과민 반응으로 인해 발생하는 신경성(외상성, 통증, 척수 손상, 마취 합병증) 또는 아나필락시스성 쇼크일 수 있습니다. 뚜렷한 혈관 확장, 모세 혈관 투과성 증가 및 동정맥 분비물로 인해 혈관 내 혈액량이 재분배되고 총 말초 혈관 저항이 크게 감소합니다.
개발의 충격은 세 단계를 거칩니다.
1. 쇼크의 비진행성(초기) 단계는 중요한 기관에 대한 상대적으로 정상적인 혈액 공급을 유지하면서 혈압 및 심박출량의 감소를 특징으로 합니다. 이것은 주로 피부와 장의 혈관의 보상적 혈관 수축 때문입니다. 적응 메커니즘이 고갈되면 충격이 다음 단계로 넘어갑니다.
2. 쇼크의 진행 단계는 뚜렷한 임상 증상, 모든 기관 및 조직의 혈액 충전 감소로 인한 깊은 허탈(동맥 확장 증가로 인한 조직 저관류), 대사 및 순환 장애의 발병이 특징입니다. 3. 돌이킬 수없는 쇼크 단계에서는 혈관벽의 완전성을 위반하여 미세 순환 베드 수준에서 뚜렷한 순환 부전이 발생하여 다발성 장기 부전이 급격히 증가하여 환자의 사망으로 끝납니다.
형태 학적 검사는 일반적인 영양 장애 및 괴사 변화, 파종 혈관 내 응고 현상 (점상 출혈, 정체, 미세 혈관계의 혈전)을 나타냅니다. 또한 다양한 기관의 구조와 기능의 특성으로 인해 각각의 기관, 즉 충격 기관에 독특한 변화가 발생합니다. 따라서 쇼크 신장의 경우 괴사 성 신증 (곱슬 세관의 상피 괴사)의 발달이 특징적입니다. 쇼크 폐는 무기폐의 초점, 장액 출혈성 부종, 때로는 섬유소 필라멘트 (유리질 막)의 손실로 나타납니다. 뇌에서 허혈성 뇌병증이 발생하며 부종, 점상 출혈 및 괴사의 병소로 나타납니다. 심장에서는 출혈과 심근 괴사의 작고 주로 심내막 아래 병소, 과수축 증상이 있는 심근 세포의 지방 변성이 관찰됩니다. 부신 피질에서는 스테로이드 호르몬 합성에 사용되는 지질이 완전히 사라질 때까지 감소합니다. 위장관에서 점막의 출혈, 미란 및 급성 궤양이 발견됩니다. 쇼크 간은 간세포의 지방 변성이 특징이며 경우에 따라 소엽 중심 괴사도 있습니다.
쇼크의 예후는 유형, 중증도, 치료가 시작된 단계, 합병증의 유무에 따라 다릅니다. 현재 심각한 심인성 또는 패혈성 쇼크의 경우 사망률이 50% 이상에 이릅니다.
지혈 장애
혈액 응집 상태의 최적 응집 상태를 보장하는 요인 및 메커니즘의 복합체.
혈액 응고 시스템을 평가하기 위해 다음과 같은 검사가 수행됩니다.
시간, 출혈 기간. 손가락 찔림과 튀어나온 방울을 종이에 담근다. 표준은 45-180초입니다.
Lee-White에 따른 혈액 응고 시간. 그것들을 시험관에 넣고 섬유소 필라멘트가 나타날 때까지 흔든다. 표준은 6-9분입니다.
혈관 손상에 대한 반응으로 혈관벽 경련이 발생합니다. 혈소판은 손상된 혈관으로 돌진하여 혈관벽에 달라붙습니다(유착). 혈소판 혈전이 서로 달라붙어 형성됩니다. 이러한 메커니즘은 혈관 혈소판 지혈입니다.
혈액 응고 단계.
응고 지혈. 활성화는 두 가지 방법으로 발생할 수 있습니다.
메커니즘은 내부적이며 콜라겐, 프로테아제 또는 아드레날린에 의해 활성화되며, 이러한 요인은 다음과 같은 사실을 초래합니다. IX VIII - 반드시 Ca 이온의 참여 활성 프로트롬비나제(트롬보플라스틴)의 형성.
메커니즘 - 외부 - 조직 손상. 조직 트롬보플라스틴(III)은 인자 VII의 활성 형태로의 전환을 촉진하고 그 결과 활성 프로트롬비나제가 형성됩니다.
혈액 응고의 1단계에는 7, 8, 9개의 응고 인자가 포함됩니다.
혈액 응고.
활성 프로트롬비나제(트롬보키나제)는 트롬빈으로 전환됩니다. 2개의 하위 단계가 있습니다.
트롬빈의 효소 용량 형성.
트롬빈의 초기 용량의 작용에 따라 프로컨버틴(VII)은 컨버틴(VIIa)으로 전환됩니다. 전환은 응고 과정을 1단계로 되돌립니다.
Proaccelyrin(V)은 accelerin(Va)으로 전환되어 혈액 응고를 촉진합니다.
결과 용량의 트롬빈 형성. 프로트롬빈, 프로아셀리린, 프로컨버틴 작용.
트롬빈은 섬유소에 작용하여 섬유소원을 형성합니다. 중합 및 안정화. 피브리노겐 - 피브리노머 - 피브리노올리고머 - 피브린 폴리머.
단계 - 섬유소 용해.
XII XIIa 플라스미노겐 - 플라스민(섬유소 용해 시스템의 주요 인자) 섬유소는 섬유소 분해 생성물로 파괴됩니다(섬유소 용해 생성물은 응고의 1단계를 활성화함).
지혈 시스템.
출혈성 체질.
그들은 지혈 구성 요소의 손상에 따라 나뉩니다.
혈관 병증 :
유전:
모세혈관확장증 또는 Randu-Osler 질병은 상염색체 우성으로 유전됩니다. 즉, 혈관벽 구조의 결함으로 인해 얇아지고 낭 확장이 형성됩니다. 국소화: 입술, 상체, 얼굴, 두피, 점막, 충치. 이 얇아진 벽은 잘 다쳤습니다. 환자는 만성 출혈로 인해 만성 철분 결핍 빈혈이 발생합니다.
획득 :
비타민 Hypovitaminosis C (괴혈병), PP - 혈관벽의 중합에 필요 - 환자는 점상 출혈, 혈관염이 발생합니다. 피부의 대칭적인 부위.
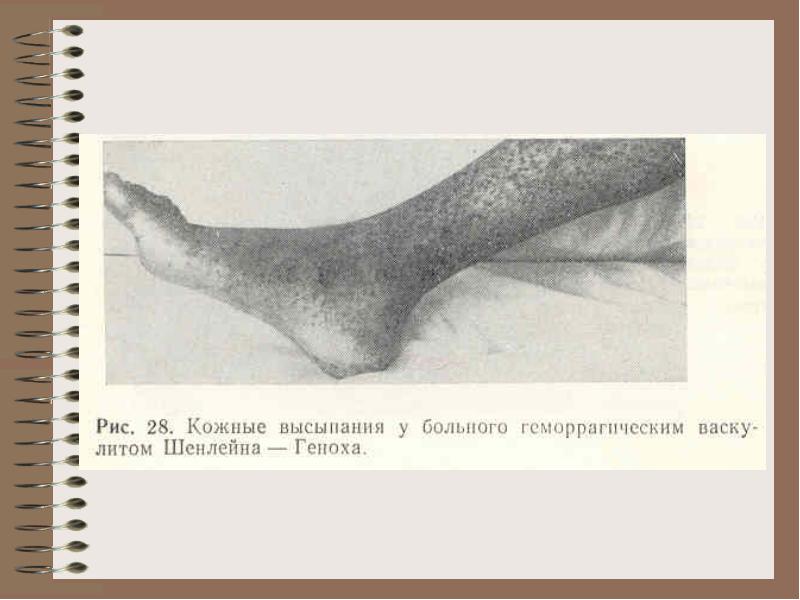
출혈성 혈관염(Shenlein-Henoch 질병):
혈관벽 저항 검사: Konchalovsky(커프의 압력을 일정 값으로 주입한 다음 점상 출혈의 수를 계산), 지혈대(혈압 측정 시 커프를 붙인 후 피부를 봅니다. 출혈), 꼬집음 (피부 꼬집음).
혈소판병증:
혈소판 감소증:
베를호프병(혈소판 감소성 자반병)은 상염색체 우성 방식으로 유전됩니다. 그것은 멍의 형태로 나타나며 표범 피부가 피고 있습니다.
혈소판 생성 억제제(비장 인자)를 생성하는 비장의 능력은 유전됩니다. 이 인자는 골수의 거핵구에서 혈소판의 끈끈이를 억제하고 거핵구의 수가 증가하며 그로부터 거의 감각이 없습니다.
치료: 비장 제거.
구매: BY PHONE PHOTOS!
골수독성 효과:
외인성 요인: 물리적(전리 방사선), 화학적(세포증식억제제, 항생제, 오일 제품), 생물학적(바이러스, 미생물의 독소).
내인성:
정상적인 조혈 새싹의 억제.
자가 면역 혈소판 감소증.
결과는 비출혈, 치은 출혈, 자궁 출혈, 타박상입니다.
분화를 위해 생물학적 분석이 있으며 환자의 혈청이 동물에 주입됩니다. 비장 인자는 종 특이적이지 않으므로 동물에서도 혈소판 감소증을 유발합니다.
혈소판 감소증 - 혈소판의 기능적 특성 위반:
유전: 글란츠만병, 폰 빌레브란트병(복합 출혈성 체질, 내피는 일반적으로 인자 8의 구성요소인 폰 빌레브란트 인자를 생성하기 때문입니다. 그리고 이 인자의 비뚤어진 합성은 유전됩니다. 폰 빌레브란트 인자는 응고 인자입니다).
획득 :
다량의 혈액, 혈장, 응고 촉진제 농축물의 수혈.
다발성 골수종, 발덴스트롬병(포아스마의 정상 및 비정상 단백질 증가).
DVSS(PDP 증가 - 섬유소 분해 산물)
약용 - NSAID
비타민 저하증 C, B 12.
혈소판 감소증의 메커니즘:
과립구에서 BAS 혈소판 합성 및 축적 위반,
혈장 내 혈소판 인자의 탈과립 및 방출 위반.
혈소판 감소증 및 무력증 진단:
혈소판 수: 180-400 * 10 9 / l.
혈소판 응집 시간: 14-18초
집계에 들어간 셀의 비율이 90을 초과합니다.
시간의 연장과 진입하는 세포의 감소 - 혈소판감소증
긍정적 인 테스트 Konchalovsky - 혈소판은 혈관 내피의 영양을 결정하고 내피 세포에 필요한 성장 인자를 분비합니다. 혈소판 수가 적으면 결손, 혈관 취약성이 증가합니다.
응고 병증 - 응고 지혈 위반:
유전. 응고 단계별:
1상 응고 장애:
혈우병 A(모든 혈우병의 80%) - VIII 인자 결핍.
혈우병 B(10%) - 인자 IX 결핍.
혈우병 C(5%) - 인자 XI 결핍.
혈우병 유전 메커니즘: 혈우병 A는 X 염색체의 결함입니다. 건강한 아버지, 보균자 어머니 건강한 아들, 건강한 딸, 보균자 딸, 혈우병 아들. 이 질병은 출생 직후에 나타나며 신생아는 다양한 출혈(두혈종)을 가질 수 있습니다. 모든 외상은 혈종(일종의 출혈)을 형성합니다. 관절염의 형성이 가능합니다.
B 및 C 혈우병은 남성과 여성 모두에게 발생할 수 있습니다.
응고의 첫 번째 단계 위반 진단 :
활성화된 혈장 재석회화 시간(AVR)은 40-60초입니다.
활성화된 부분 트롬보플라스틴 시간(APTT) 33-45초.
2단계 위반:
유전성(부혈우병): 저프로트롬빈혈증, 저프로콘베르틴혈증, 저프로가셀린혈증.
후천성: 간부전, 결핍증, 비타민 저하증 K.
II상의 상태를 평가하기 위해 우리는 프로트롬빈 지수(PTI)를 85-110%로 추정합니다.
3단계 위반:
유전성: 저섬유소원혈증, 무섬유소원혈증, 이상섬유소원혈증.
합성 감소 또는 소비 증가(특히 ARD 사용)의 결과로 획득: 저섬유소원혈증, 무섬유소원혈증.

지혈 시스템의 병태생리학
지혈 시스템의 가치
1. 액체 상태의 혈액 보존(응고 및 항응고 시스템 활성의 적절한 비율)
2. 출혈의 예방 및 조절(순환 혈액량을 일정하게 유지)

지혈의 종류
혈관판
(일 순위)
- 마이크로 용기에서 출혈을 멈추십시오.
응집
(중고등 학년)
섬유소 클러스터의 형성

지혈 시스템의 구성 요소
* 혈관벽
* 혈소판(단핵구, 적혈구)
* 플라즈마 시스템:
- 촉진제
- 항응고제
- 섬유소 용해제
- 칼리크레인-키니노바

지혈 장애의 분류
병인학
- 유전
- 구입 한
개발 메커니즘을 위해
- 혈관판 장애
지혈
- 응고 지혈 장애
변화에 대한 지시
- 저응고
- 과응고

저응고
재출혈 및 출혈 경향이 있는 혈액 응고 능력 감소(자발적 또는 경미한 부상 후)

병인학
1. 혈소판 감소증
2. 혈소판병증
3. 혈관병증
4. 응고병

혈소판감소증
혈액 내 혈소판 함량 감소를 특징으로하는 병리학 적 상태 (150 109/l 미만)

유전성 혈소판 감소증
일반적으로 선천적 혈소판 결함이 동시에 동반됩니다.

획득된 혈소판 감소증(발달 기전에 따른 분류)
플레이트 손상
- 면역 복합체
- 기계적 외상(비장종대, 혈관종)
혈소판 형성 억제
(재생 불량성 빈혈, 적골수에 대한 화학적 및 방사선 손상, 조혈 조직을 종양으로 대체)
플레이트 사용 증가
(혈전증, 파종성 혈관내 응고)

면역 혈전 감소증
이종면역
* 에서 더 자주 발생 어린이
** 원인- 혈소판의 항원 구조 변화(풍진, 천연두, 아데노바이러스 바이러스의 침강, 약물 기원의 합텐 - 퀴니딘, 설폰아미드, 리팜피신, 백신)
***현재가 유리하다(원인이 제거되면 완전한 회복이 일어남)

면역 혈전 감소증
자가면역
에서 더 자주 발생합니다. 성인
원인- 자신의 혈소판 항원에 대한 면역 내성 부족
자극 요인 :약물, 바이러스, 박테리아

자가면역 혈소판감소증
웰호프의 질병
(자가면역 만성 혈소판 감소성 자반병)
* 혈소판 표면의 숫자 이그 10배 증가
* Ig G 합성의 주요 부위는 비장
* 치료 원리:
- 비장절제술
- 코르티코스테로이드
- 면역억제제
* 완전한 치료법은 없다

혈소판병증
혈관 혈소판 지혈 장애, 조직 및 기관 출혈의 출현을 특징으로 하는 혈소판의 질적 열등 또는 기능 장애로 인한 지혈 장애

과립의 방출을 방해하지 않고
글란츠만 혈소판증
* 유전 - 상염색체 열성
*원인- 혈소판막에 당단백질 2c와 3a가 없음
*병인- 혈소판은 피브리노겐과 상호작용하지 않으며 응집하지 않습니다.
*표지판:점상출혈, 비강출혈, 자궁출혈( 치명적일 수 있습니다!!)

유전성 혈소판병증
과립 방출의 손상된 반응과 함께
계승- 상 염색체 열성
원인- Cycloxygenase 활성 위반, 수축성 단백질의 낮은 활성
병인- 콜라겐과 상호작용 시 응집이 없고, 과립이 방출되지 않음
표지판:

유전성 혈소판병증
과립 내용물의 장애 및 방출
헤르만스키-푸들락병(AR)
* 원인- 조밀한 과립의 축적 위반 (ADP, 아드레날린, 세로토닌, Ca2 +)
* 병인- 콜라겐과 상호작용 시 응집이 없고, 과립의 내용물이 방출되지 않음
* 표지판:점상출혈, 비출혈, 자궁출혈

유전성 혈소판병증
손상된 플레이트 접착 및 응집
폰 빌레브란트-유르겐스 증후군 (AR)
원인 - 폰 빌레브란트 인자 결핍
병인 - 인자 8 결핍으로 인한 혈소판 유착 장애
버나드 소울병 (AR)
원인 - 혈소판에 당단백질 1이 없음
병인 - 폰 빌레브란트 인자와 혈소판의 상호작용 방해 f. 5, 바. 열한
표지판 - 모세혈관 출혈( 특히 사춘기 또는 출산 중 위험)

유전성 혈소판병증
결함 및 감소된 가용성 f.3
보우와 양자리 혈소판병증
원인 - ph.3 혈소판 결핍
병인 - 혈소판 및 응고촉진제에 대한 감수성이 없습니다.
표지판: 점상출혈, 비출혈, 자궁출혈

유전성 혈소판병증
다른 유전적 이상과 함께 혈소판 병증
Wiskott-Aldridge 증후군
- 원인- 혈소판은 조밀한 과립(ADP, 세로토닌, 아드레날린, Ca2+), 알파 과립(베타-트롬보글로불린, 피브리노겐, 피브로넥틴, 성장 인자)이 거의 없습니다.
- 병인- 혈소판의 부착 및 응집 감소, 과립 방출 장애
- 표지판:출혈 증후군이 일찍 나타나 치명적인 출혈이있을 수 있습니다.

후천성 혈소판병증(병인)
1. 백혈병- 빠른 성숙, 감소된 부착 및 응집으로 인해 혈소판에 과립이 거의 없음
2. 괴상 집적 Ig M - 면역 복합체에 의한 수용체 손상, 혈소판과 응고 촉진제 상호 작용 장애(면역 질환)
3. Hypovitaminosis B12 - 과립의 방출이 손상됨
4. 약효

약물 혈소판병증
* 그리고 트롬복산 A2 합성 억제제
-스테로이드 성 항염증제
- 비스테로이드성 소염제(아스피린은 4-6일 동안 혈소판 응집을 차단)
* 캠프 형성 자극제
-파파베린
-유필린
- 단백 동화 스테로이드
* Ca 이온 길항제
-베라파밀
-코린파

혈관병증
혈관벽의 기능적, 형태적 손상으로 인한 출혈성 체질
- 선천적
- 획득

선천성 혈관병증
볼. Randu-Osler(출혈성 모세혈관확장증)
볼. Fabry (디퓨즈 지오 케라 - 트렁크 볼륨)
유전성 혈소판 감소성 미세혈관종증

선천성 혈관병증
원인 - 결합 조직 발달의 유전성 장애, 포함. 혈관 내피
특성
- 혈관이 국소적으로 얇아짐
- 미세혈관 내강 확장
- 내피하층에 콜라겐 섬유가 거의 없음
- 혈관이 쉽게 손상됨
- 콜라겐 섬유의 결핍으로 인한 혈소판의 약한 접착 및 응집
**표지판- 코피, 폐-기관지 및 위장 출혈(때로는 치명적임)

후천성 혈관병증
1. 그리고 특발성(카포시 육종)
- 병인학 - 불명
2. 흐르지 않는(클로츠 피부염, 파브르라쿠쇼 피부염)
- 병인 - 만성 심부전, 국소 정맥 부전
3. 영양실조
스테로이드 자반병 - 부신기능항진증, 코르티코스테로이드 치료 - 콜라겐 합성 억제
Skorbut - 비타민 C 결핍
Bol.Shenlein-Henoch - 면역 복합체에 의한 혈관 손상
4. 신경성
임상적 특징 - 피부 출혈

응고병
지혈의 응고 시스템의 병리학의 결과로 발생하는 출혈성 체질
** 유전
** 취득

유전성 응고증
응고 지혈을 담당하는 물질의 결핍 또는 분자 이상으로 인한 유전적으로 결정된 혈액 응고 장애

유전성 응고증
분류
1. 프로트롬비나제 활성 형성의 내부 기전에 대한 고립된 위반으로 인한 응고병증(혈우병 A, B, C, Willebrand B., Hageman 결핍증)
2. 프로트롬비나제 활성 형성의 외부 기전에 대한 고립된 위반으로 인한 응고병증(저컨버틴혈증 - 7f 결핍)
3. 프로트롬비나제 활성 형성의 외부 및 내부 기전에 대한 결합 위반 (parahemophilia - 5p 결핍, B. Stewart-Prower - 10p 결핍)
4. 혈액 응고의 마지막 단계 위반(아피브리노겐혈증)

통계
모든 형태의 응고병증 중:
혈우병 A 68 - 78%
비 ... 빌레브란트 9 - 18%
혈우병 B 6 - 13%
혈우병 C, parahemophilia 및 hypoproconvertinemia 1 - 2%
기타 형태 - 임상 casuistry

혈우병 A
제8인자 응고촉진 부분의 유전적 결핍으로 인한 출혈성 체질
인자 8(고분자량 단백질)
1. 당단백질 전응고제(VIII: K)
2. 혈소판 부착을 매개하는 당단백질(VIII: VWF)
3. 리스토마이신의 영향으로 혈소판 부착을 활성화하는 당단백질(VIII: Rkof)
4. 항원 마커 VIII: K(VIII: K AG)
5. 항원 마커 VIII: Rkof(VIII: Rkof AG)
활동 VIII: K 및 VIII: VWF는 다량체 구조 및 8개 요인의 감소와 함께 감소합니다.

혈우병 A
* 이 티올로지- 합성을 조절하는 X염색체의 유전자 이상 응고 촉진제 부분 f. 여덟(VIII: K)
** 아픈 - 남자 (46, XhY)
** 견해
- 혈우병 A + (항원 양성 형태 - 비정상 VIII : K), 8-10 % 고통
- 혈우병 A-(항원 음성형 - 합성되지 않음 VIII : K), 90 - 92%로 고통
**** 진료소:큰 관절의 출혈, 혈종 (피하, 근육 내), 중증 및 장기간의 외상 후 출혈. 복부 장기로의 출혈 가능성, 위장 출혈

혈우병
혈우병
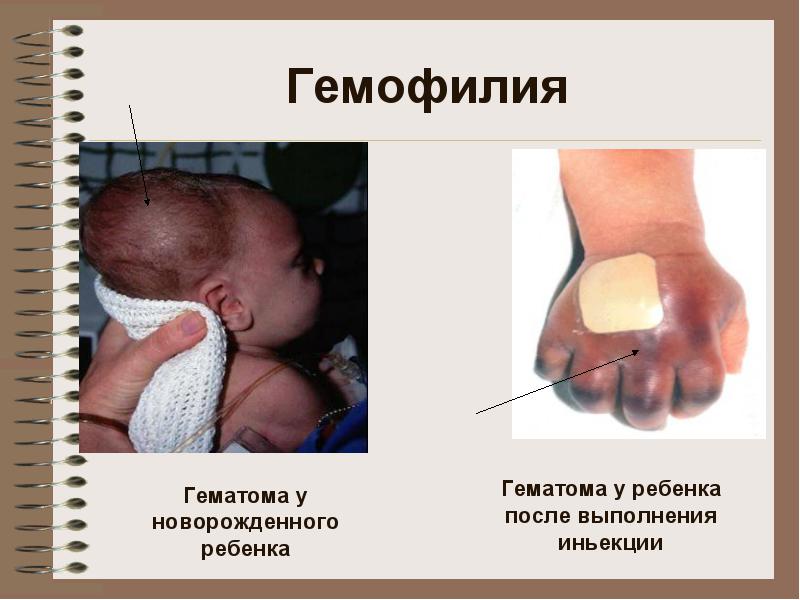
혈우병 B
병인학 - f의 합성을 제어하는 X 염색체의 유전자 이상. 아홉
아픈 남자 (46, XhY)
-여성 (46, XhXh), (45, Xh O)
*** 견해
- 혈우병 B + (항원 양성 형태 - 비정상 에프. 아홉)
- 혈우병 B-(항원 음성형 - 합성되지 않음 에프. 아홉)
진료소:큰 관절의 출혈, 혈종(피하, 근육내), 심각하고 장기간의 외상 후 출혈. 복부 장기로의 출혈 가능성, 위장 출혈

후천성 응고장애
특색 - 다결핍증
병인학
1. 응고촉진제의 면역 억제(히말라야 충돌)
2. 비타민 결핍. K 의존적 응고 인자 (7, 10, 9, 2)
a) 장의 합성 위반 (dysbiosis, 설사)
b) vit의 흡수 장애. K(담즙 결핍증)
c) 심각한 간 손상
3. 헤파린 과다 복용

과응고
혈관에서 혈액을 형성하는 능력 증가
혈전증
얼음 증후군

DIC-증후군(심장혈관내 혈액 수집 증후군)
분류
* 임상 경과에 따라
1) 급성(즉각적인 형태는 심한 과정을 특징으로 함)
2) 만성
* 유병률별
1) 현지화
2) 일반화

병인학
감염, 패혈증 상태
충격 (패혈증 있음 - 치사율 100%)
외과 개입, 화상
모든 말기 상태, 심장 마비
급성 혈관내 용혈
산과 병리학 (20-25 %)
조혈모세포증(o. 백혈병 - 33-45%)
실질 기관의 파괴적인 과정
알레르기 반응

파종성 혈관내 응고의 단계
1) 과응고(응고계의 활성화로 인한 다발성 혈전 형성)
2) 소비 응고 장애(응고 시스템의 고갈, 혈전용 혈소판의 과도한 사용)
3) 저 응고 (응고제 활성 감소, 항응고제 활성화, 섬유소 용해 활성화)
4) 완성(회복, 합병증, 사망)

파종성 혈관내 응고의 발병기전
1) 고트롬빈혈증(트롬보플라스틴은 손상된 조직에서 대량으로 혈류로 들어가 트롬빈 형성을 촉진합니다). 감염의 경우 활성화된 단핵구-대식세포는 자체 응고제를 합성합니다(f. 7, f. 10, f. 9, f. 2).

파종성 혈관내 응고의 발병기전
2) 대규모 혈소판 응집(혈소판 감소증 소모의 발병을 유발하고 출혈로 인해 복잡해짐)
3) 적혈구의 손상 및 용혈(이것은 많은 ADP를 생성하여 혈소판 부착 및 응집을 향상시킵니다)

파종성 혈관내 응고의 발병기전
4) "체액성 프로테아제 파열" (응고촉진제, 항응고제, 섬유소용해제, 칼리크레인-키닌계의 단백질, 보체계를 활성화할 때, 많은 단백질 분해 생성물이 혈액에 축적되어 매우 독성이 있고 혈관과 조직을 손상시킵니다)

파종성 혈관내 응고의 발병기전
5) 섬유소 용해 시스템의 고갈
(혈전 형성 촉진)
6) 응고 인자의 고갈
(출혈의 원인이 됨)

파종성혈관내응고클리닉
1. 혈액응고 쇼크
원인
* 미세 순환 장애(조직 저산소증의 발병 원인)
* 단백질 분해의 독성 생성물 축적
발현
* 혈압을 낮추는
* 중심정맥압의 저하
* 출혈(출혈성 쇼크 유발)

파종성혈관내응고클리닉
2. 지혈 장애
a) 과응고성
주요 증상은 혈전증
시험관의 혈전
비) 저응고
주요 증상은 출혈
(동시에 섬유소 용해 시스템이 고갈됨)

파종성혈관내응고클리닉
3. 혈소판 감소증
그것은 혈관에 많은 수의 혈전이 형성되어 발생합니다 (소비 혈소판 감소증)

인후염 후 소녀는 사지와 몸통의 피부에 점상 발진이 발생했습니다. 객관적으로: 혈소판 수 80 G/L, 항혈소판 항체. Coombs and Jell에 따르면 이 질병의 원인이 되는 알레르기 반응은 무엇입니까?
@ 유형 II(체액성 세포독성)
I형(아나필락시스)
III형(면역복합체)
V형(자극)
환자는 콜라겐에 대한 혈소판 부착이 손상되었으며 작은 혈관에서 출혈이 관찰됩니다. 환자에서 지혈의 어떤 연결이 방해받을 수 있습니까?
@ 혈관 혈소판
응고 및 단계
응고, 3단계
섬유소 용해
응고 단계 II
환자는 혈소판 감소증으로 진단됩니다. 혈소판-혈관 지혈 장애의 전형적인 임상 증상은 무엇입니까?
@ Petechiae, 반상 출혈 (타박상)
관절염
혈종
출혈 시간 감소
시간의 증가 혈액 응고
환자는 검사 중에 혈소판 병증 진단을 받았습니다. 혈소판병증의 발병기전에 어떤 변화가 중요한 역할을 합니까?
@ 골수에 의한 병적 혈소판 생성
항응고 활성 감소
혈소판 생성 과활성화
혈액 내 응고촉진제 농도 증가
섬유소 용해 억제.
수술 전 인간의 출혈 시간이 10분으로 늘어난 것으로 밝혀졌다. 어떤 혈액 세포의 결핍이 그러한 변화를 일으킬 수 있습니까?
@ 혈소판
적혈구
단핵구
림프구
백혈구
아스피린을 장기간 사용하면 환자에게 출혈이 발생했습니다. 객관적으로: 혈소판 기능 활성이 손상된 혈소판 감소증. 이 경우 혈소판 병증은 활동 억제로 인해 발생합니다.
@ 사이클로옥시게나제
시토크롬 산화 효소
리폭시게나제
슈퍼옥사이드 디스뮤타제
포스포리파제 A 2.
환자는 혈관 내피에 의한 폰 빌레브란트 인자 생산 감소로 진단됩니다. 이 경우 혈관 혈소판 지혈의 어떤 위반이 관찰됩니까?
@ 혈소판 유착 장애
혈소판 응집 장애
과응고
피브린 중합 위반
강화된 섬유소 용해
ARVI 후 발생한 출혈성 발진이 있는 어린이는 출혈성 혈관염(Schönlein-Henoch 질병) 진단을 받았습니다. Coombs and Jell에 따르면 이 질병의 원인이 되는 알레르기 반응은 무엇입니까?
@ 유형 III(면역복합체)
I형(아나필락시스)
유형 II(체액성 세포독성)
유형 IV(세포성 세포독성)
V형(자극)
ARVI 후 발생한 출혈성 발진이 있는 어린이는 출혈성 혈관염(Schönlein-Henoch 질병) 진단을 받았습니다. 이 질병에서 지혈 장애의 원인은 무엇입니까?
@ 혈관벽 손상
혈관벽 결합 조직의 유전적 결함
유전성 항응고제 결핍
섬유소 용해 억제
응고촉진제의 유전적 결핍
담석증을 앓고 있는 여성이 비타민 K 결핍으로 인한 출혈 증후군을 앓고 있습니다. 비타민 K 결핍증에서 열등한 요인은 다음 중 어느 것입니까?
@ Stuart-Prower (ph. X)
폰 빌레브란트 요인
섬유소 안정화(f. XIII)
피브리노겐(f.I)
검사 중 환자는 혈전증(혈액 응고 과정의 가속화)이 있는 것으로 나타났습니다. 위반의 원인은 무엇입니까?
@ 단백질 분해효소 억제제의 결핍
프로스타사이클린 농도 증가
혈액 내 트롬빈 농도 감소
혈액 내 헤파린 농도 증가
혈액 내 피브리노리신 농도 증가
간 질환이 있는 환자는 혈액 내 프로트롬빈 함량이 감소한 것으로 나타났습니다. 이것은 주로 다음을 위반합니다.
@ 응고 지혈의 두 번째 단계
섬유소 용해
응고 지혈의 세 번째 단계
혈관 혈소판 지혈
응고 지혈의 첫 번째 단계
7세 남아가 자전거에서 넘어져 무릎 관절염이 생겼습니다. cryoprecipitate의 도입과 관절에서 혈액의 펌핑으로 아이의 상태가 크게 개선되었습니다. 어떤 질병을 생각해야합니까?
@ 혈우병 A
출혈성 혈관염.
혈소판병증
혈소판 감소증
류마티스 관절염
중증 출혈성 증후군이 있는 소년은 혈장에 항혈우병 글로불린 A(인자 VIII)가 없습니다. 이 소아에서 주로 어떤 지혈 단계가 손상됩니까?
@ 프로트롬비나제 활성화의 내부 경로
혈전의 수축
프로 트롬 비나 제 활성화의 외부 경로
그 소년은 혈우병을 앓고 있습니다. 응고 지혈 장애의 임상 징후는 무엇입니까?
점상출혈
미세혈뇨
반상출혈(멍)
시력 장애
@ 혈종, 장기간 출혈
사고의 희생자는 다발성 외상을 겪은 후 얼마 후 파종성 혈관내 응고(DIC) 증후군이 발생했습니다. 이 합병증을 유발한 요인은 무엇입니까?
@ 조직 트롬보플라스틴(f. III)
피브리노겐(f.I)
항혈우병 글로불린 A(f. VIII)
급성 췌장염 환자는 파종성 혈관내 응고(DIC) 증후군이 발생했습니다. 이 합병증을 유발한 물질은 무엇입니까?
@ 트립신
피브리노겐(f.I)
항혈우병 글로불린 A(f. VIII)
스튜어트-프로워 팩터(F. X)
항혈우병 글로불린 B(f.IX)
다발성 외상 및 급성 신부전이 있는 환자에서 내부 출혈로 인해 상태가 복잡해졌습니다. DIC 증후군의 이 단계의 병인에서 주요 연결 고리는 무엇입니까?
@ 응고 인자의 소비
저장소에서 백혈구 방출
혈소판증가증
프로트롬비나제 활성화
섬유소 용해 억제
합병증으로 화상 질환이 있는 환자는 DIC 증후군을 일으켰습니다. 환자의 혈액이 3분 이내에 응고되는 것으로 알려지면 DIC 증후군의 어느 단계를 의심할 수 있습니까?
@ 과응고
저응고
회복
숨어있는
단말기
부상을 입은 환자에게 DIC 증후군이 발생했습니다. DIC-증후군의 II상에서 관찰되는 지혈의 변화는 무엇입니까?
@ 응고저하
과응고.
섬유소 용해
혈소판 감소증
혈소판병증
양립할 수 없는 혈액을 수혈한 후 환자는 DIC 증후군이 발생했습니다. 용혈에서이 합병증의 발병 기전의 주요 연결 고리는 무엇입니까?
@ 세포내 프로테아제의 혈액에 들어가는 것
혈액 내 빌리루빈 축적
혈액 내 과도한 트롬보플라스틴
혈액 내 과잉 프로트롬빈
플라스미노겐 함량 증가
만성 신부전 환자에서 파종 성 혈관 내 응고 증후군이 발생했습니다. 검사 결과 혈액 응고 시간의 증가, 혈소판 감소증, 섬유소-단량체 복합체 및 섬유소 분해 산물 수준의 증가가 나타났습니다. DIC 증후군의 어떤 단계를 생각해야 합니까?
@ 응고저하
과응고
회복
숨어있는
불안정한
만성 림프구성 백혈병 환자는 DIC 증후군의 결과로 출혈이 발생했습니다. 이 경우 말초 혈액 매개 변수의 어떤 변화가 관찰됩니까?
@ 응고저하, 혈소판감소증
적혈구 증가, 혈액 점도 증가
혈소판증가증, 혈액 응고 시간 감소
과응고성, 혈소판 응집 증가
응고 촉진제의 활성 증가
패혈증이 있는 여성은 점상출혈이 발생했고 혈소판과 섬유소원 함량이 감소했으며 섬유소 분해 산물이 나타났습니다. 주목할만한 변화의 이유는 무엇입니까?
@ DIC 증후군
백혈구 감소증
림프구감소증
혈소판증가증
 태반에 대한 탯줄 부착의 병리학 탯줄의 변연 부착
태반에 대한 탯줄 부착의 병리학 탯줄의 변연 부착 수족관용 바이오 필터 - 지침이 포함된 개요
수족관용 바이오 필터 - 지침이 포함된 개요 흰머리 : 초기 흰머리의 원인, 치료, 제거 방법, 색상 반환 흰머리에 실제로 칠하는 색
흰머리 : 초기 흰머리의 원인, 치료, 제거 방법, 색상 반환 흰머리에 실제로 칠하는 색