Uchun geometrik izomeriya xosdir. Stereokimyo asoslari
Dars davomida siz izomerizm turlari haqida umumiy tasavvurga ega bo'lasiz, izomer nima ekanligini bilib olasiz. Organik kimyoda izomeriya turlari haqida bilib oling: strukturaviy va fazoviy (stereoizomerizm). Moddalarning strukturaviy formulalaridan foydalanib, strukturaviy izomeriyaning kichik turlarini ko'rib chiqing (skelet va pozitsiyalar izomeriyasi), fazoviy izomerizmning turlari: geometrik va optik.
Mavzu: Organik kimyo faniga kirish
Dars: izomerizm. Izomerizm turlari. Strukturaviy izomeriya, geometrik, optik
1. Izomeriya nima
Organik moddalarni tavsiflovchi ilgari ko'rib chiqilgan formulalar bir nechta tuzilish formulalari bitta molekulaga to'g'ri kelishi mumkinligini ko'rsatadi.
Masalan, molekulyar formula C2H6O mos kelmoq ikkita modda turli xil strukturaviy formulalar bilan - etil spirti va dimetil efir. Guruch. bitta
Etil spirti - bu metall natriy bilan vodorod ajralishi bilan reaksiyaga kiradigan, + 78.50C da qaynaydigan suyuqlik. Xuddi shunday sharoitda natriy bilan reaksiyaga kirishmaydigan dimetil efir gazi -230C da qaynaydi.
Bu moddalar tuzilishida farq qiladi - bir xil molekulyar formulalar har xil moddalarga to'g'ri keladi.
Guruch. 1. Sinflararo izomeriya
Tarkibi bir xil, lekin tuzilishi turlicha va shuning uchun har xil xossalarga ega bo'lgan moddalar mavjudligi hodisasi izomeriya deyiladi (yunoncha "izos" - "teng" va "meros" - "qism", "ulush" so'zlaridan).
Izomerizm turlari
Izomerizmning har xil turlari mavjud.
2. Sinflararo izomeriya
Strukturaviy izomeriya molekuladagi atomlarning boshqa ulanish tartibi bilan bog'liq.
Etanol va dimetil efir - bu tizimli izomerlar. Ular turli xil organik birikmalar sinfiga mansub bo'lganligi uchun, bu turdagi izomeriya turi deyiladi shuningdek sinflararo... Guruch. bitta
3. Uglerod skeletining izomeriyasi
Strukturaviy izomerlar bir xil birikmalar sinfida bo'lishi mumkin, masalan, C5H12 formulasiga uch xil uglevodorodlar mos keladi. Bu uglerod skeletining izomeriyasi... Guruch. 2018-05-01 121 2.

Guruch. 2 Moddalarga misollar - tuzilish izomerlari
4. Lavozim izomeriyasi
Uglerod skeletlari bir xil bo'lgan tizimli izomerlar mavjud bo'lib, ular bir nechta bog'lanishlar (er -xotin va uchlik) yoki vodorod o'rnini bosuvchi atomlar holatida farq qiladi. Strukturaviy izomeriyaning bu turi deyiladi pozitsiyaning izomeriyasi.
Guruch. 3. Strukturaviy pozitsiya izomeriyasi
5. Fazoviy izomeriya
Faqat bitta bog'lanishni o'z ichiga olgan molekulalarda, xona haroratida, molekulyar bo'laklarning bog'lar atrofida deyarli erkin aylanishi mumkin va masalan, 1,2-dikloroetan formulalarining barcha tasvirlari ekvivalentdir. Guruch. 4

Guruch. 4. Xlor atomlarining bitta bog'lanish atrofidagi o'rni
Agar aylanishga to'sqinlik qilinsa, masalan, tsiklik molekulada yoki er -xotin bog'lanish bilan, demak geometrik yoki sis-trans izomeriyasi. Cis izomerlarida o'rinbosarlar halqa tekislik yoki ikki tomonlama aloqaning bir tomonida, trans izomerlarda qarama -qarshi tomonda bo'ladi.
Cis-trans izomerlari qachon mavjud ikki xil deputat. Guruch. beshta



Guruch. 5. Sis - va trans - izomerlar
6. Optik izomeriya
Izomeriyaning yana bir turi to'rtta bitta bog'langan uglerod atomi o'z o'rnini bosuvchi - tetraedr bilan fazoviy tuzilish hosil qilishi tufayli yuzaga keladi. Agar molekulada to'rt xil almashtirgich bilan bog'langan kamida bitta uglerod atomi bo'lsa, demak optik izomeriya... Bunday molekulalar ularning ko'zgu tasviriga to'g'ri kelmaydi. Bu xususiyat chirallik deb ataladi - yunon chieridan - "qo'l". Guruch. 6. Optik izomeriya tirik organizmlarni tashkil etuvchi ko'plab molekulalarga xosdir.
|
|
|
Guruch. 6. Optik izomerlarga misollar
Optik izomeriya ham deyiladi enantiomerizm(yunoncha enantios - "qarama -qarshi" va meros - "qism"), va optik izomerlar - enantiomerlar... Enantiomerlar optik jihatdan faol, ular yorug'lik qutblanish tekisligini bir xil burchak bilan, lekin qarama -qarshi yo'nalishda aylantiradi: d- yoki (+) - izomer, - o'ngda, l-, yoki ( -) - izomer, - chapda. Ratsemat deb ataladigan teng miqdordagi enantiomerlarning aralashmasi optik jihatdan faol emas va belgi bilan belgilanadi. d, l- yoki (±).
Dars xulosasi
Dars jarayonida siz izomeriya turlari, izomer nima haqida umumiy tasavvurga ega bo'ldingiz. Biz organik kimyoda izomeriya turlari: strukturaviy va fazoviy (stereoizomerizm) haqida bilib oldik. Moddalarning strukturaviy formulalari yordamida biz strukturaviy izomeriyaning kichik turlarini (skelet va pozitsiyalar izomeriyasi) ko'rib chiqdik, fazoviy izomerizmning turlari bilan tanishdik: geometrik va optik.
Adabiyotlar ro'yxati
1. Rudzitis G. E. Kimyo. Umumiy kimyo asoslari. 10 -sinf: o'quv yurtlari uchun darslik: asosiy daraja / G. E. Rudzitis, F. G. Feldman. - 14 -nashr. - M.: Ta'lim, 2012.
2. Kimyo. 10 -sinf. Profil darajasi: darslik. umumiy ta'lim uchun. muassasalar / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin va boshqalar- M.: Bustard, 2008 .-- 463 p.
3. Kimyo. 11 -sinf. Profil darajasi: darslik. umumiy ta'lim uchun. muassasalar / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin va boshqalar- M.: Bustard, 2010 .-- 462 p.
4. Xomchenko GP, Xomchenko IG Oliy o'quv yurtlariga kirganlar uchun kimyo fanidan muammolar to'plami. - 4 -nashr. - M.: "Yangi to'lqin" RIA: Nashriyotchi Umerenkov, 2012. - 278 b.
1. Internet tarmog'i. ru
2. Organik kimyo.
Uy vazifasi
1. 1,2 -sonlar (39 -bet) Rudzitis G. Ye. Kimyo. Umumiy kimyo asoslari. 10 -sinf: o'quv yurtlari uchun darslik: asosiy daraja / G. E. Rudzitis, F. G. Feldman. - 14 -nashr. - M.: Ta'lim, 2012.
2. Nima uchun etilen turkumidagi uglevodorodlar izomerlarining soni to'yingan uglevodorodlardan ko'p?
3. Qanday uglevodorodlarning fazoviy izomerlari bor?
Simulyatorlar yordamida materialni mahkamlang
1 -murabbiy 2 -murabbiy 3 -murabbiy

 I. Izomerizm (yunoncha isos - teng) Berzelius, 1830 Izomerlar bir xil molekulyar formulaga ega bo'lgan (bir xil sifat va miqdoriy tarkibga ega), lekin bog'lovchi atomlarning ketma -ketligi va (yoki) fazoda joylashishi bilan farq qiladigan va har xil xususiyatlar.
I. Izomerizm (yunoncha isos - teng) Berzelius, 1830 Izomerlar bir xil molekulyar formulaga ega bo'lgan (bir xil sifat va miqdoriy tarkibga ega), lekin bog'lovchi atomlarning ketma -ketligi va (yoki) fazoda joylashishi bilan farq qiladigan va har xil xususiyatlar.
 BERTZELIUS (Berzelius), Yens Yakob 1779 - 1848 - mashhur shved kimyogari. 1807 yildan Stokgolmda tibbiyot va farmatsevtika professori.
BERTZELIUS (Berzelius), Yens Yakob 1779 - 1848 - mashhur shved kimyogari. 1807 yildan Stokgolmda tibbiyot va farmatsevtika professori.
 C 2 H 6 O dimetil efir Bp = -24 C etil spirti Bp = 78 C n -butan Bp = -0,5 C C 4 H 10 izobutan Bp = -11,7 S
C 2 H 6 O dimetil efir Bp = -24 C etil spirti Bp = 78 C n -butan Bp = -0,5 C C 4 H 10 izobutan Bp = -11,7 S
 Alkanlar qatoridagi izomerlar soni Ism Formulalar soni Izomerlar formulasi Isomerlar soni CH 4 metan 1 C 11 H 24 undekan 159 C 2 H 6 etan 1 C 12 H 26 dodekan 355 C 3 H 8 propan 1 C 13 H 28 tridekan 802 C 4 H 10 butan 2 C 14 H 30 tetradekan 1 858 C 5 H 12 pentan 3 C 15 H 32 pentadekan 4 347 C 6 H 14 geksan 5 C 20 H 42 eikosan C 7 H 16 geptan 9 C 25 H 52 pentakosan 36 797 588 C 8 H 18 oktan 18 C 30 H 62 triakontan 4 111 846 763 C 9 H 20 nonan 35 C 40 H 82 tetrakontan 62 491 178 805 831 C 10 H 22 dekan 75 366 319
Alkanlar qatoridagi izomerlar soni Ism Formulalar soni Izomerlar formulasi Isomerlar soni CH 4 metan 1 C 11 H 24 undekan 159 C 2 H 6 etan 1 C 12 H 26 dodekan 355 C 3 H 8 propan 1 C 13 H 28 tridekan 802 C 4 H 10 butan 2 C 14 H 30 tetradekan 1 858 C 5 H 12 pentan 3 C 15 H 32 pentadekan 4 347 C 6 H 14 geksan 5 C 20 H 42 eikosan C 7 H 16 geptan 9 C 25 H 52 pentakosan 36 797 588 C 8 H 18 oktan 18 C 30 H 62 triakontan 4 111 846 763 C 9 H 20 nonan 35 C 40 H 82 tetrakontan 62 491 178 805 831 C 10 H 22 dekan 75 366 319
 II. Homologiya Uglerod zanjirida -CH 2 - guruhlari soni bo'yicha bir -biridan farq qiladigan, bir xil funktsional guruhga ega bo'lgan bir xil tuzilishga ega organik birikmalar guruhlari gomologik qatorni tashkil qiladi. Metanning gomologik seriyasi
II. Homologiya Uglerod zanjirida -CH 2 - guruhlari soni bo'yicha bir -biridan farq qiladigan, bir xil funktsional guruhga ega bo'lgan bir xil tuzilishga ega organik birikmalar guruhlari gomologik qatorni tashkil qiladi. Metanning gomologik seriyasi
 III. Izologik qatorlar. ll - bu bir xil miqdordagi uglerod atomlaridan tuzilgan, lekin H atomlarining miqdoriy tarkibi bilan farq qiladigan moddalar seriyasi, ya'ni seriyaning har bir keyingi a'zosi avvalgisidan 2 H atomdan kam: C 2 H 6 etan C 2 H 4 etilen C 2 H 2 asetilen
III. Izologik qatorlar. ll - bu bir xil miqdordagi uglerod atomlaridan tuzilgan, lekin H atomlarining miqdoriy tarkibi bilan farq qiladigan moddalar seriyasi, ya'ni seriyaning har bir keyingi a'zosi avvalgisidan 2 H atomdan kam: C 2 H 6 etan C 2 H 4 etilen C 2 H 2 asetilen






 Strukturaviy izomeriya 3. Tautomerizm (prototrop yoki dinamik izomeriya) Tautomerizm (yunoncha chτύτίςύτίς - bir xil va mέρoz - o'lchov) - harakatlanuvchi muvozanatda bo'lgan va o'z -o'zidan bir -biriga aylanishi mumkin bo'lgan ikkita izomerik shaklning birgalikda yashash hodisasi.
Strukturaviy izomeriya 3. Tautomerizm (prototrop yoki dinamik izomeriya) Tautomerizm (yunoncha chτύτίςύτίς - bir xil va mέρoz - o'lchov) - harakatlanuvchi muvozanatda bo'lgan va o'z -o'zidan bir -biriga aylanishi mumkin bo'lgan ikkita izomerik shaklning birgalikda yashash hodisasi.







Src = "https://present5.com/presentation/73124296_273676330/image-22.jpg" alt = "(! LANG: Konformatsiya> C ------- C konformatsiyasi> C ------- C
 Geometrik izomeriya Geometrik izomerlar - molekulada bir xil bog'lanish tartibiga (ketma -ketligiga) ega, lekin fazoda atomlarning (guruhlarning) er -xotin bog'lanish tekisligiga yoki kichik tsiklga nisbatan joylashishida farq qiladi.
Geometrik izomeriya Geometrik izomerlar - molekulada bir xil bog'lanish tartibiga (ketma -ketligiga) ega, lekin fazoda atomlarning (guruhlarning) er -xotin bog'lanish tekisligiga yoki kichik tsiklga nisbatan joylashishida farq qiladi.
Src = "https://present5.com/presentation/73124296_273676330/image-24.jpg" alt = "(! LANG: Buten-2 sis va trans izomerlari Har bir atom> C = C Cis va trans izomerlari buten- 2 Har bir atom> C = C
 Leyta Sisleitaniya daryosining "bu va boshqa tarafida" - Avstriya toji erlarining nomi; qizil rangda ko'rsatilgan; 1867 -1918 Translatedia - Vengriya toji erlarining nomi; yashil rangda ko'rsatilgan
Leyta Sisleitaniya daryosining "bu va boshqa tarafida" - Avstriya toji erlarining nomi; qizil rangda ko'rsatilgan; 1867 -1918 Translatedia - Vengriya toji erlarining nomi; yashil rangda ko'rsatilgan




 E, Z-nomenklatura 2 1 E-1-nitro-1-bromo-2-xloropenten 1 2 Z-1 -nitro-1-bromo-2-xloropenten 1. Cahn-Ingold-Prelog qoidalari yordamida nisbiy ustunlikni aniqlang. er -xotin bog'lanish bilan bog'langan va ularga 1 yoki 2 ustunlik raqamlarini beradigan o'rinbosarlar.
E, Z-nomenklatura 2 1 E-1-nitro-1-bromo-2-xloropenten 1 2 Z-1 -nitro-1-bromo-2-xloropenten 1. Cahn-Ingold-Prelog qoidalari yordamida nisbiy ustunlikni aniqlang. er -xotin bog'lanish bilan bog'langan va ularga 1 yoki 2 ustunlik raqamlarini beradigan o'rinbosarlar.
 a) atom raqami yuqori bo'lgan atom, past raqamli atomga nisbatan eng yuqori ko'rsatkichdir. b) Agar ikkita atom izotop bo'lsa, unda katta massali atomning afzalligi bor. 2. Agar ikkita eng katta guruh π-bog'lanish tekisligining bir tomonida joylashgan bo'lsa, unda o'rinbosarlarning konfiguratsiyasi Z. belgisi bilan belgilanadi (nemis zusammenlaridan birgalikda) Agar bu guruhlar qarama-qarshi tomonlarda bo'lsa g-bog'lanish tekisligi, keyin konfiguratsiya E belgisi bilan belgilanadi (nemis tilidan entgegen qarama-qarshi)
a) atom raqami yuqori bo'lgan atom, past raqamli atomga nisbatan eng yuqori ko'rsatkichdir. b) Agar ikkita atom izotop bo'lsa, unda katta massali atomning afzalligi bor. 2. Agar ikkita eng katta guruh π-bog'lanish tekisligining bir tomonida joylashgan bo'lsa, unda o'rinbosarlarning konfiguratsiyasi Z. belgisi bilan belgilanadi (nemis zusammenlaridan birgalikda) Agar bu guruhlar qarama-qarshi tomonlarda bo'lsa g-bog'lanish tekisligi, keyin konfiguratsiya E belgisi bilan belgilanadi (nemis tilidan entgegen qarama-qarshi)



 Lui Paster (27.12.1822-28.09.1895) frantsuz kimyogari, 19-asrning eng yirik tadqiqotchisi "Asimmetriya organik dunyoni noorganiklardan ajratib turadi" (bu qonun stereokimyo uchun asos yaratdi). Asimmetrik kristallar qutblangan nurni aylantirish qobiliyatiga ega.
Lui Paster (27.12.1822-28.09.1895) frantsuz kimyogari, 19-asrning eng yirik tadqiqotchisi "Asimmetriya organik dunyoni noorganiklardan ajratib turadi" (bu qonun stereokimyo uchun asos yaratdi). Asimmetrik kristallar qutblangan nurni aylantirish qobiliyatiga ega.
 Enantiomerlar - bu fazoviy izomerlar bo'lib, ularning molekulalari bir -biriga ob'ekt va mos kelmaydigan ko'zgu tasviri sifatida bog'lanadi. (yunon enantiosidan - aksincha).
Enantiomerlar - bu fazoviy izomerlar bo'lib, ularning molekulalari bir -biriga ob'ekt va mos kelmaydigan ko'zgu tasviri sifatida bog'lanadi. (yunon enantiosidan - aksincha).
 Chirallik (inglizcha chirality, yunon tilidan. Chéir - qo'l), kimyo ob'ektining xususiyatini ideal tekis oynada aks ettirish bilan mos kelmasligini tavsiflovchi tushuncha.
Chirallik (inglizcha chirality, yunon tilidan. Chéir - qo'l), kimyo ob'ektining xususiyatini ideal tekis oynada aks ettirish bilan mos kelmasligini tavsiflovchi tushuncha.






 Fisher Emil Xerman (9.10.1852, Eiskirchen, - 15.7.1919, Berlin), nemis organik kimyogari va biokimyogari.
Fisher Emil Xerman (9.10.1852, Eiskirchen, - 15.7.1919, Berlin), nemis organik kimyogari va biokimyogari.
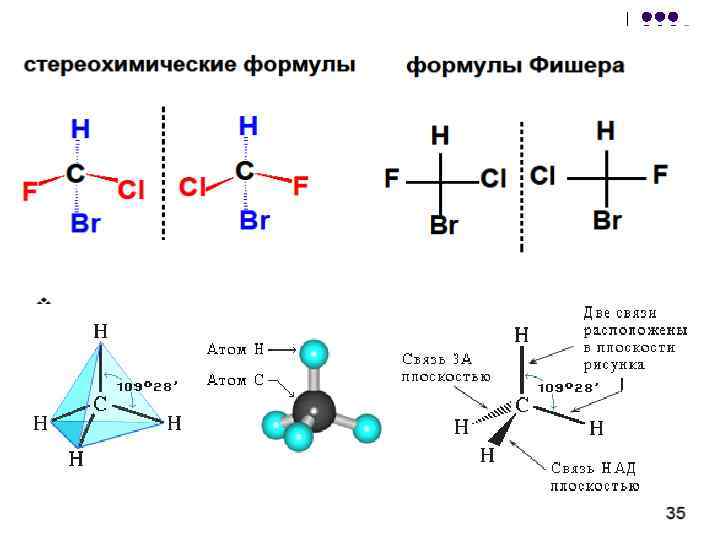


 Fisher proyeksiyalarini o'zgartirish mumkin: l l 1. o'rinbosarlarning juft sonli almashinuvi formulani o'zgartirmaydi; 2. o'rinbosarlarning almashtirishlarining toq soni antipod (enantiomer) formulasiga olib keladi; 3. formulani 90 yoki 270 ga burish, shuningdek, bu tekislikdan formulani chiqarish taqiqlanadi (bu harakatlar antipodli formulaga olib keladi); 4. butun formulani chizma tekisligida 180 ga aylantirishga ruxsat beriladi;
Fisher proyeksiyalarini o'zgartirish mumkin: l l 1. o'rinbosarlarning juft sonli almashinuvi formulani o'zgartirmaydi; 2. o'rinbosarlarning almashtirishlarining toq soni antipod (enantiomer) formulasiga olib keladi; 3. formulani 90 yoki 270 ga burish, shuningdek, bu tekislikdan formulani chiqarish taqiqlanadi (bu harakatlar antipodli formulaga olib keladi); 4. butun formulani chizma tekisligida 180 ga aylantirishga ruxsat beriladi;
 Nisbiy konfiguratsiya, MA Rozanov taklifiga binoan L- va D -izomerlari (lotincha laevus so'zlaridan - chap va dexter - o'ng).
Nisbiy konfiguratsiya, MA Rozanov taklifiga binoan L- va D -izomerlari (lotincha laevus so'zlaridan - chap va dexter - o'ng).



 Cahn - Ingold - Prelog tizimi? Robert Sidney Kan Ingold Kristofer Prelog Vladimir (09.06.1899-15.09.1981) (28.10.1893-8.10.1970) (23.07.1906-07.01.1998) (Buyuk Britaniya) (Shveytsariya)
Cahn - Ingold - Prelog tizimi? Robert Sidney Kan Ingold Kristofer Prelog Vladimir (09.06.1899-15.09.1981) (28.10.1893-8.10.1970) (23.07.1906-07.01.1998) (Buyuk Britaniya) (Shveytsariya)



 Optik izomerlarning umumiy soni N = 2 n formula bilan aniqlanadi, n - chiral markazlar soni. I III IV 2 -amino-3-gidroksibutanoik kislota
Optik izomerlarning umumiy soni N = 2 n formula bilan aniqlanadi, n - chiral markazlar soni. I III IV 2 -amino-3-gidroksibutanoik kislota
 Tartarik kislota I III IV eritro treo epimerlari diastereomerlar bo'lib, ular faqat bitta assimetrik markaz konfiguratsiyasida farqlanadi.
Tartarik kislota I III IV eritro treo epimerlari diastereomerlar bo'lib, ular faqat bitta assimetrik markaz konfiguratsiyasida farqlanadi.

 Racemate (lotincha racemus - uzum). D va L stereizomerlarining ekvolyar miqdorlarini aralashtirganda, optik faol bo'lmagan aralashmalar hosil bo'ladi, ular rasemik S (lotincha sinisterdan - chapdan) va R (lotincha rectus - o'ng) deb ataladi; rasemat RS belgisi bilan belgilanadi. Rasemik aralashmalarning hazm bo'lishi: 1. Mexanik usul (Paster usuli). 2. Mikrobiologik usul 3. Enzimatik usul. 4. Kimyoviy usul. Affinity xromatografiyasi
Racemate (lotincha racemus - uzum). D va L stereizomerlarining ekvolyar miqdorlarini aralashtirganda, optik faol bo'lmagan aralashmalar hosil bo'ladi, ular rasemik S (lotincha sinisterdan - chapdan) va R (lotincha rectus - o'ng) deb ataladi; rasemat RS belgisi bilan belgilanadi. Rasemik aralashmalarning hazm bo'lishi: 1. Mexanik usul (Paster usuli). 2. Mikrobiologik usul 3. Enzimatik usul. 4. Kimyoviy usul. Affinity xromatografiyasi
 Sterokimyoviy tuzilmaning BIOLOGIK FAOLIYAT namoyon bo'lishi bilan aloqasi. Adrenalin, epinefrin IUPAC: 1 - (3, 4 -dihidroksifenil) -2 metilaminoetanol - hayvon va odam buyrak usti bezining gormoni. Sovuq qonli asab tizimining vositachisi. Adrenalinning ikkita enantiomeridan R (-) adrenalin eng katta farmakologik faollikni ko'rsatadi.
Sterokimyoviy tuzilmaning BIOLOGIK FAOLIYAT namoyon bo'lishi bilan aloqasi. Adrenalin, epinefrin IUPAC: 1 - (3, 4 -dihidroksifenil) -2 metilaminoetanol - hayvon va odam buyrak usti bezining gormoni. Sovuq qonli asab tizimining vositachisi. Adrenalinning ikkita enantiomeridan R (-) adrenalin eng katta farmakologik faollikni ko'rsatadi.

 Sterokimyoviy tuzilmaning BIOLOGIK FAOLIYAT namoyon bo'lishi bilan aloqasi. dextrorotator izopropiladrenalin (izadrin) o'zining levorotator enantiomeridan 800 marta kuchli bronxodilatator ta'sir ko'rsatadi.
Sterokimyoviy tuzilmaning BIOLOGIK FAOLIYAT namoyon bo'lishi bilan aloqasi. dextrorotator izopropiladrenalin (izadrin) o'zining levorotator enantiomeridan 800 marta kuchli bronxodilatator ta'sir ko'rsatadi.

 Diastereomerlar - fazoviy izomerlar, ularning molekulalari ob'ekt va mos kelmaydigan ko'zgu tasviri sifatida bir -biriga bog'liq emas.
Diastereomerlar - fazoviy izomerlar, ularning molekulalari ob'ekt va mos kelmaydigan ko'zgu tasviri sifatida bir -biriga bog'liq emas.

 Konformatsion izomeriya Konformatsion izomeriya bir xil molekulaning qismlarini bir-biriga nisbatan har xil joylashishi natijasida vujudga keladi, bu ikki atomni bog'laydigan oddiy C-C aloqasi atrofida aylanadi.
Konformatsion izomeriya Konformatsion izomeriya bir xil molekulaning qismlarini bir-biriga nisbatan har xil joylashishi natijasida vujudga keladi, bu ikki atomni bog'laydigan oddiy C-C aloqasi atrofida aylanadi.
 (Lat. conformatio - shakli, joylashuvi), atrofdagi alohida bo'laklarning erkin aylanishi natijasida molekulalar tomonidan olingan turli fazoviy shakllar. oddiy C-C ulanishlar.
(Lat. conformatio - shakli, joylashuvi), atrofdagi alohida bo'laklarning erkin aylanishi natijasida molekulalar tomonidan olingan turli fazoviy shakllar. oddiy C-C ulanishlar.







 69% 31% Van der Vals stressi valentlik bilan bog'lanmagan katta hajmli o'rinbosarlar orasidagi itarish kuchlari tufayli yuzaga keladi.
69% 31% Van der Vals stressi valentlik bilan bog'lanmagan katta hajmli o'rinbosarlar orasidagi itarish kuchlari tufayli yuzaga keladi.
Ligand izomeriyasi
Ligand izomeriyasi aloqaga bo'linadi (aniqlanadi) har xil turlari bir xil ligandning koordinatsiyasi) va ligandning haqiqiy izomeriyasi.
Bog'lanish izomerizmiga misollar K 3 va K 3 tarkibli kobalt (III) ning nitro va nitrit komplekslarining mavjudligi bo'lib, ularda NO 2 - ligandining muvofiqlashtirilishi mos ravishda azot atomi yoki kislorod atomi orqali amalga oshiriladi. . Yana bir misol-NCS tiosiyanat ionining-azot atomi orqali yoki oltingugurt atomi orqali, tiosiyanato-N- yoki tiosiyanato-S-komplekslarning hosil bo'lishi bilan muvofiqlashtirilishi.
Bundan tashqari, murakkab tuzilishga ega ligandlar (masalan, aminokislotalar) o'zlari izomerlar hosil qilishi mumkin, ularning koordinatsiyasi har xil xususiyatlarga ega bo'lgan bir xil tarkibdagi komplekslarning paydo bo'lishiga olib keladi.
Geometrik izomeriya ligandlarning ichki sohada bir -biriga nisbatan notekis taqsimlanishidan kelib chiqadi. Old shart geometrik izomeriya - ichki koordinatsion sohada kamida ikki xil ligandning mavjudligi. Geometrik izomeriya asosan sakkiz qirrali, yassi kvadrat yoki piramida tuzilishga ega bo'lgan murakkab birikmalarda namoyon bo'ladi.
Tetraedral, uchburchak va chiziqli tuzilishga ega bo'lgan murakkab birikmalar geometrik izomerlarga ega emas, chunki ikkita ligandlar joylashadi. har xil turlari markaziy atom atrofida ekvivalentdir.
Yassi kvadrat tuzilishga ega komplekslar, ikki xil L 'va L' ligandlari ishtirokida, allaqachon ikkita izomerga ega bo'lishi mumkin (sis- va trans-):
Cis va trans izomerlari bo'lgan murakkab birikmaning misoli diklorodiammineplatin (II):
E'tibor bering, tekis kvadrat tuzilishga ega bo'lgan kompozitsiyaning murakkab birikmasi izomerlarga ega bo'lolmaydi: L '' ligandining pozitsiyasi kvadratning istalgan burchagida teng ehtimolli. Ikki xil ligand paydo bo'lganda, xususiyatlar jihatidan farq qiladigan ikkita izomer (tsis- va trans-) mavjud bo'lishi mumkin. Shunday qilib, sis-diklorodiammineplatin (II) to'q sariq-sariq rangli kristallar bo'lib, ular suvda yaxshi eriydi, trans-diklorodiammineplatinum (II) esa och sariq rangli kristallar bo'lib, ularning suvda eruvchanligi sis izomeridan biroz pastroqdir.
Ichki sferada turli ligandlar soni ortishi bilan geometrik izomerlar soni ortadi. Nitro (gidroksilamin) amin (piridin) platina (II) Cl xlorid uchun barcha uch izomer olingan:
Sakkiz qirrali komplekslar ko'p izomerlarga ega bo'lishi mumkin. Agar bu turdagi murakkab birikmada oltita ligandning hammasi bir xil bo'lsa () yoki faqat bittasi boshqasidan farq qilsa (), unda ligandlarning bir -biriga nisbatan boshqacha joylashishi mumkin emas. Masalan, oktaedral birikmalarda L '' ligandining boshqa beshta L 'ligandga nisbatan har qanday pozitsiyasi ekvivalent bo'ladi va shuning uchun izomerlar bo'lmasligi kerak:
Vujudga kelishi ikkita L "in ligandlari oktaedral murakkab birikmalar mavjud bo'lish imkoniyatiga olib keladi ikkita geometrik izomer... Bunda L '' ligandlarni bir -biriga nisbatan joylashtirishning ikki xil usuli bor. Masalan, dihidroksotetraamminekobalt (III) + kationining ikkita izomeri bor:
H 3 N va OH ligandlarining yuqorida ko'rsatilganidan farq qiladigan boshqa o'zaro kelishuvini topishga harakat qilganda, biz har doim berilganlardan birining tuzilishiga kelamiz.
Kompleksda har xil kimyoviy tarkibga ega ligandlar sonining ko'payishi bilan geometrik izomerlar soni tez ko'payadi. Bu turdagi birikmalar to'rtta izomerga ega bo'ladi va olti xil ligand o'z ichiga olgan birikmalar uchun geometrik izomerlar soni 15 ga etadi. Bunday murakkab birikmalar hali ham yaxshi o'rganilmagan.
Geometrik izomerlar fizikaviy va kimyoviy xossalari bilan farq qiladi: rang, eruvchanlik, zichlik, kristall tuzilishi va boshqalar.
1. Strukturaviy izomerizm.
2. Konformatsion izomeriya.
3. Geometrik izomeriya.
4. Optik izomeriya.
Izomerlar Tarkibi va molekulyar og'irligi bir xil, lekin fizikaviy va kimyoviy xossalari har xil bo'lgan moddalar. Izomerlarning xossalarining farqlanishi ularning kimyoviy yoki fazoviy tuzilishidagi farqlarga bog'liq. Shu munosabat bilan izomeriyaning ikki turi ajratiladi.
izomerizm
tizimli
fazoviy
Uglerod skeleti
Konfiguratsiya
Konformatsion
Funktsional pozitsiya
Optik
Sinflararo
Geometrik
1. Strukturaviy izomerizm
Strukturaviy izomerlar kimyoviy tuzilishida farq qiladi, ya'ni. molekuladagi atomlar orasidagi bog'lanishlarning tabiati va ketma -ketligi. Strukturaviy izomerlar sof holda ajratilgan. Ular individual, turg'un moddalar sifatida mavjud bo'lib, ularning o'zaro o'zgarishi uchun yuqori energiya talab qilinadi - taxminan 350 - 400 kJ / mol. Faqat dinamik izomerlar - tautomerlar dinamik muvozanatda bo'ladi. Tautomerizm - organik kimyoda keng tarqalgan hodisa. Harakatlanuvchi vodorod atomini molekulaga (karbonil birikmalari, ominlar, geterotsikllar va boshqalar), molekulalararo ta'sir o'tkazish (uglevodlar) paytida mumkin.
Barcha strukturaviy izomerlar strukturaviy formulalar ko'rinishida berilgan va IUPAC nomenklaturasi bo'yicha nomlangan. Masalan, strukturaviy izomerlar S 4 N 8 O tarkibiga mos keladi:
lekin)turli uglerod skeleti bilan
tarmoqlanmagan C zanjiri -CH 3 -CH2 -CH2 -CH = O (butanal, aldegid) va
tarmoqli C zanjiri -
 (2-metilpropanal, aldegid) yoki
(2-metilpropanal, aldegid) yoki
tsikl -  (siklobutanol, tsiklik spirt);
(siklobutanol, tsiklik spirt);
b)funktsional guruhning turli pozitsiyalari bilan
 butanon-2, keton;
butanon-2, keton;
ichida)funktsional guruhning har xil tarkibi bilan
 3-butenol-2, to'yinmagan spirt;
3-butenol-2, to'yinmagan spirt;
G)metamerizm
Funktsional guruhning heteroatomini uglerod skeletiga (halqa yoki zanjir) kiritish mumkin. Bu turdagi izomeriyaning mumkin bo'lgan izomerlaridan biri CH 3 -O-CH 2 -CH = CH 2 (3-metoksipropen-1, efir);
e)tautomerizm (keto-enol)
enol shakli  keto shakli
keto shakli
Tautomerlar dinamik muvozanatda, aralashmada esa ancha barqaror shakli - keto shakli ustunlik qiladi.
Aromatik birikmalar uchun strukturaviy izomeriya faqat yon zanjir uchun hisobga olinadi.
2. Fazoviy izomeriya (stereoizomerizm)
Kosmik izomerlar bir xil kimyoviy tuzilishga ega bo'lib, molekuladagi atomlarning fazoviy joylashuvi bilan farq qiladi. Bu farq fizik va kimyoviy xossalarda farq yaratadi. Kosmik izomerlar turli proektsiyalar yoki stereokimyoviy formulalar sifatida tasvirlangan. Fazoviy tuzilish va uning birikmalarning fizik -kimyoviy xossalariga, ularning reaktsiyalarining yo'nalishi va tezligiga ta'sirini o'rganadigan kimyo bo'limi stereokimyo deb ataladi.
lekin)Konformatsion (aylanma) izomeriya
Bog'lanish burchagini ham, bog'lanish uzunligini ham o'zgartirmasdan, bir-biridan uglerod tetraedralarini o'zaro bog'laydigan σ-C-C rishtasi atrofida o'zaro aylanishi bilan ajralib turadigan ko'p sonli geometrik shakllarni (konformatsiyalarni) tasavvur qilish mumkin. Bu aylanish natijasida aylanish izomerlari (konformerlar) paydo bo'ladi. Turli xil konformatorlarning energiyasi bir xil emas, lekin har xil konformatsion izomerlarni ajratuvchi energiya to'sig'i ko'pchilik organik birikmalar uchun kichikdir. Shuning uchun, normal sharoitda, qoida tariqasida, molekulalarni bitta aniq belgilangan konformatsiyada mahkamlash mumkin emas. Odatda, muvozanatda bir -biriga osongina o'tadigan bir nechta konformatsion izomerlar birga yashaydi.
Etan molekulasi misolida tasvirlash usullari va izomerlarning nomenklaturasini ko'rib chiqish mumkin. Buning uchun energiyada iloji boricha bir -biridan farq qiladigan ikkita konformatsiyaning mavjudligini oldindan ko'rish mumkin. istiqbolli prognozlar(1) ("arra tegirmoni") yoki proektsiyalar Nyuman(2):

kechiktirilgan konformatsiya tiqilib qolgan konformatsiya
Perspektivli proektsiyada (1), S-S aloqasi uzoqqa borayotganini tasavvur qilish kerak; chapdagi uglerod atomi kuzatuvchiga yaqinroq, o'ngda esa undan uzoqda.
Nyuman proektsiyasida (2) molekula C-C aloqasi bo'ylab ko'rib chiqiladi. Doira markazidan 120 ° burchak ostida ajralib turadigan uchta chiziq kuzatuvchiga eng yaqin bo'lgan uglerod atomining bog'lanishlarini ko'rsatadi; aylanadan "chiqayotgan" chiziqlar uzoq uglerod atomining bog'lanishlari.
O'ngda ko'rsatilgan konformatsiya deyiladi qorong'i ... Bu nom bizga har ikkala CH 3 -guruhining vodorod atomlari bir -biriga qarama -qarshi ekanligini eslatadi. To'siq konformatsiyasi ichki energiyani ko'paytirdi va shuning uchun noqulay. Chapda ko'rsatilgan konformatsiya deyiladi inhibe qilingan , bu holatda C-C aloqasi atrofida erkin aylanish "inhibe qilingan" degan ma'noni anglatadi, ya'ni. molekula asosan shu konformatsiyada mavjud.
Muayyan bog'lanish atrofida molekulani to'liq aylantirish uchun zarur bo'lgan minimal energiya bu bog'lanish uchun aylanish to'sig'i deb ataladi. Etan kabi molekuladagi aylanish to'sig'ini o'zgarish bilan ifodalash mumkin potentsial energiya molekulalar tizimning dihedral (burilish - τ) burchagi o'zgarishiga bog'liq. Etan tarkibidagi C - C aloqasi atrofida aylanishning energiya profili 1 -rasmda ko'rsatilgan. Etanning ikki shaklini ajratuvchi aylanish to'sig'i taxminan 3 kkal / mol (12,6 kJ / mol) ni tashkil qiladi. Potentsial energiya egri chizig'ining minimalari inhibe qilingan konformatsiyalarga, maksimal - tutilganlarga mos keladi. Xona haroratida ba'zi molekulalar to'qnashuvining energiyasi 20 kkal / molga (taxminan 80 kJ / mol) etishi mumkinligi sababli, bu 12,6 kJ / mollik to'siqni osonlikcha engib o'tish mumkin va etanning aylanishi erkin deb hisoblanadi. Barcha mumkin bo'lgan konfiguratsiyalar aralashmasida, kechiktirilgan konformatsiyalar ustunlik qiladi.

Shakl.1. Etan konformatsiyalarining potentsial energiya diagrammasi.
Murakkab molekulalar uchun mumkin bo'lgan konformatsiyalar soni ortadi. Shunday qilib, uchun n-butan, C 2 - C 3 markaziy bog'lanishini aylantirganda paydo bo'ladigan va CH 3 guruhlarining o'zaro joylashishida farq qiladigan oltita konformatsiyani tasvirlash mumkin. Butanning har xil tiqilib qolgan va kechiktirilgan konformatsiyasi energiya jihatidan farq qiladi. Kechiktirilgan konformatsiyalar energetik jihatdan qulayroqdir.

Butandagi C 2 -C3 bog atrofida aylanishning energiya profili 2 -rasmda ko'rsatilgan.

2 -rasm. N-butan konformatsiyalarining potentsial energiya diagrammasi.
Uzoq uglerod zanjiriga ega bo'lgan molekula uchun konformatsion shakllar soni ortadi.
Alitsiklik birikmalar molekulasi halqaning turli shaklli shakllari bilan tavsiflanadi (masalan, sikloheksan uchun) kreslo, Vanna, burish-shakllar).
Shunday qilib, konformatsiyalar - bu ma'lum bir konfiguratsiyaga ega bo'lgan molekulaning turli fazoviy shakllari. Konformerlar potentsial energiya diagrammasidagi energiya minimasiga mos keladigan, stereoizomerik tuzilmalar bo'lib, ular harakatlanuvchi muvozanat holatida va oddiy σ-rishtalari atrofida aylanib, bir-biriga aylanishi mumkin.
Agar bunday o'zgarishlarning to'sig'i etarlicha baland bo'lsa, stereoizomerik shakllarni ajratish mumkin (masalan, optik faol bifenillar). Bunday hollarda, endi konformerlar haqida emas, balki mavjud stereoizomerlar haqida gapirish mumkin.
b)Geometrik izomeriya
Geometrik izomerlar quyidagi molekulalarda yo'qligidan kelib chiqadi.
1. uglerod atomlarining bir -biriga nisbatan aylanishi - C = C juft bog'lanishining qattiqligi yoki tsiklik tuzilishining natijasi;
2. er -xotin bog'lanish yoki tsiklning bitta uglerod atomidagi ikkita bir xil guruh.
Geometrik izomerlar, konformatorlardan farqli o'laroq, sof holda ajratilishi va individual, turg'un moddalar sifatida mavjud bo'lishi mumkin. Ularning o'zaro o'zgarishi uchun ko'proq energiya talab qilinadi-taxminan 125-170 kJ / mol (30-40 kkal / mol).
Cis-trans- (Z, E) izomerlari bor; sis- shakllar geometrik izomerlar bo'lib, unda bir xil o'rinbosarlar g-rishtasi yoki halqasi tekisligining bir tomonida yotadi, trans- shakllar geometrik izomerlar bo'lib, bunda bir xil o'rinbosarlar g-rishtasi yoki halqasi tekisligining qarama-qarshi tomonlarida yotadi.
Eng oddiy misol-buten-2 izomerlari, ular tsis-, trans-geometrik izomerlar ko'rinishida mavjud:


sis-buten-2 trans-buten-2
erish harorati
138,9 0 S - 105,6 0 S
qaynash harorati
3.72 0 S 1.00 0 S
zichlik
1,2-diklorotsiklopropan sis-, transizomerlar shaklida mavjud:


cis-1,2-diklorosiklopropan trans-1,2-diklorosiklopropan
Ko'proq qiyin holatlar qo'llanilgan Z, Elektron nomenklatura (Kann, Ingold, Prelog nomenklaturasi - KIP, deputatlar keksalik nomenklaturasi). Birgalikda
1-bromo -2-metil-1-xlorobuten-1 (Br) (CI) C = C (CH 3)-CH 2 -CH 3 uglerod atomlaridagi er-xotin bog'langan barcha o'rinbosarlar har xil; shuning uchun bu birikma Z-, E- geometrik izomerlar ko'rinishida mavjud:


E-1-bromo-2-metil-1-xlorobuten-1 Z-1-bromo-2-metil-1-xlorobuten-1.
Izomerning konfiguratsiyasini ko'rsatish uchun ko'rsatib bering yuqori o'rinbosarlarning er -xotin bog'lanish (yoki tsikl) bo'yicha joylashuvi - Z- (nemis Zusammen - birgalikda) yoki E- (nemis Entgegen - qarama -qarshi).
Z, E-tizimida katta tartibli (atom) raqamli o'rinbosarlar katta hisoblanadi. Agar to'yinmagan uglerod atomlari bilan to'g'ridan -to'g'ri bog'langan atomlar bir xil bo'lsa, ular "ikkinchi qavat" ga, agar kerak bo'lsa, "uchinchi qavat" ga va hokazo.
Birinchi proektsiyada, katta guruhlar er-xotin bog'lanishiga nisbatan bir-biriga qarama-qarshi joylashgan, shuning uchun bu E-izomer. Ikkinchi proektsiyada katta guruhlar er-xotin bog'lanishning bir tomonida joylashgan (birga), shuning uchun bu Z-izomer.
Geometrik izomerlar tabiatda keng tarqalgan. Masalan, tabiiy polimerlar-kauchuk (sis-izomer) va gutta-percha (trans-izomer), tabiiy fumarik (trans-butenedioik kislota) va sintetik maleik (sis-butenedioik kislota) kislotalar, yog'lar tarkibida-sis-olein , linoleik, linolenik kislotalar.
ichida)Optik izomeriya
Organik birikmalar molekulalari chiral va axiral bo'lishi mumkin. Chirallik (yunoncha sheir - qo'ldan) - molekulaning ko'zgu tasviriga mos kelmasligi.
Chiral moddalar yorug'lik polarizatsiyasi tekisligini aylantira oladi. Bu hodisa optik faollik deb ataladi va unga mos keladigan moddalar - optik faol... Optik faol moddalar juft bo'lib paydo bo'ladi optik antipodlar- fizik va kimyoviy xossalari normal sharoitda bir xil bo'lgan izomerlar, bittasi bundan mustasno - qutblanish tekisligining burilish belgisi: optik antipodlardan biri qutblanish tekisligini o'ngga buradi (+, dextrorotator izomer), ikkinchisi chap tomonda (-, levogirat). Optik antipodlarning konfiguratsiyasini asbob - polarimetr yordamida eksperimental tarzda aniqlash mumkin.
Optik izomeriya molekulani o'z ichiga olganda paydo bo'ladi assimetrik uglerod atomi(molekulaning chiralligining boshqa sabablari ham bor)... Bu uglerod atomining sp 3 - gibridlanishdagi nomi va to'rt xil almashtiruvchi bilan bog'liq. Asimmetrik atom atrofidagi o'rinbosarlarning ikkita tetraedral joylashuvi mumkin. Bundan tashqari, ikkita fazoviy shaklni hech qanday aylanish bilan birlashtirish mumkin emas; ulardan biri boshqasining ko'zgu tasviri:

Ikkala oynali shakl ham bir juft optik antipodni tashkil qiladi enantiomerlar .
Optik izomerlar E. Fisher proektsion formulalari ko'rinishida tasvirlangan. Ular assimetrik uglerod atomi bo'lgan molekulani loyihalash orqali olinadi. Bunday holda, tekislikdagi assimetrik uglerod atomining o'zi nuqta bilan belgilanadi, gorizontal chiziqda chizilgan tekislik oldida chiqib turgan o'rinbosarlarning belgilari ko'rsatilgan. Vertikal chiziq (kesilgan yoki qattiq) chizilgan tekislikdan tashqariga chiqarilgan o'rinbosarlarni ko'rsatadi. Oldingi rasmdagi chap modelga mos keladigan proektsion formulani yozishning turli usullari:

Proektsiyada asosiy uglerod zanjiri vertikal ravishda ko'rsatilgan; asosiy funktsiya, agar u zanjir oxirida bo'lsa, proektsiyaning yuqori qismida ko'rsatilgan. Masalan, (+) va ( -) alanin - CH 3 - * CH (NH 2) -COOH ning stereokimyoviy va proektsion formulalari quyidagicha ifodalanadi:

Bir xil enantiomerik tarkibga ega bo'lgan aralashmani rasemat deyiladi. Racemate optik faollikka ega emas va enantiomerlardan farq qiluvchi fizik xususiyatlari bilan ajralib turadi.
Proektsion formulalar uchun konversiya qoidalari.
1. Formulalar chizilgan tekisligida stereokimyoviy ma'nosini o'zgartirmasdan 180 ° burilish mumkin:

2. Bitta assimetrik atomda o'rinbosarlarning ikkita (yoki har qanday juft sonli) almashinuvi formulaning stereokimyoviy ma'nosini o'zgartirmaydi:

3. Asimmetrik markazda o'rinbosarlarning bitta (yoki har qanday toq sonli) almashtirilishi optik antipod formulasiga olib keladi:

4. Chizma tekisligida 90 gradusga burilish formulani antipodga aylantiradi.
5. Har qanday uchta o'rinbosarni soat yo'nalishi bo'yicha yoki soat sohasi farqli ravishda aylantirish formulaning stereokimyoviy ma'nosini o'zgartirmaydi:
 6. Chizma tekisligidan proektsion formulalar olinmaydi.
6. Chizma tekisligidan proektsion formulalar olinmaydi.
Optik faollik organik birikmalarga ega, ularning molekulalarida boshqa atomlar ham chiral markazlar, masalan, kremniy, fosfor, azot, oltingugurt.
Bir nechta assimetrik uglerod atomlari bo'lgan birikmalar shaklda mavjud diastereomerlar , ya'ni bir -biri bilan optik antipodlar hosil qilmaydigan fazoviy izomerlar.
Diastereomerlar bir -biridan nafaqat optik aylanish, balki boshqa barcha fizik konstantalarda ham farq qiladi: ular har xil erish va qaynash nuqtalariga, har xil eruvchanlikka va boshqalarga ega.
Kosmik izomerlar soni Fisher formulasi bilan belgilanadi N = 2 n, bu erda n - assimetrik uglerod atomlarining soni. Ba'zi tuzilmalarda qisman simmetriya paydo bo'lishi tufayli stereoizomerlar soni kamayishi mumkin. Optik faol bo'lmagan diastereomerlar deyiladi meso-shakllar.
Optik izomerlarning nomenklaturasi:
a) D-, L- nomenklatura
Izomerning D yoki L seriyasini aniqlash uchun konfiguratsiya (assimetrik uglerod atomidagi OH guruhining pozitsiyasi) glitseraldegid (glitserin kaliti) enantiomerlarining konfiguratsiyasi bilan taqqoslanadi:

L-glitseraldegid D-glitseraldegid
Hozirgi vaqtda D-, L-nomenklaturasidan foydalanish optik faol moddalarning uchta klassi bilan cheklangan: uglevodlar, aminokislotalar va gidroksi kislotalar.
b) R -, S -nomenklatura (Kan, Ingold va Prelog nomenklaturasi)
Optik izomerning R (o'ng) yoki S (chap) konfiguratsiyasini aniqlash uchun tetraedrdagi (stereokimyoviy formulada) o'rinbosarlarni assimetrik uglerod atomi atrofida shunday tartibga solish kerakki, eng past o'rinbosar (odatda vodorod) bo'ladi. "kuzatuvchidan" yo'nalishi. Agar boshqa uchta o'rinbosarlarning katta yoshdan o'rta va keksa yoshga o'tishi soat yo'nalishi bo'yicha sodir bo'lsa, bu R-izomeridir (yoshning pasayishi R harfining yuqori qismini yozishda qo'lning harakatiga to'g'ri keladi). Agar o'tish soat sohasi farqli o'laroq sodir bo'lsa, bu S - izomer (ustuvorlikning pasayishi S harfining yuqori qismini yozishda qo'lning harakatiga to'g'ri keladi).
Optik izomerning R- yoki S-konfiguratsiyasini proektsion formulaga muvofiq aniqlash uchun, ularning eng pasti proyeksiyaning pastki qismida bo'ladigan qilib, almashtiruvchilarni juft sonli almashtirishlar bilan tartibga solish kerak. Qolgan uchta o'rinbosarlarning ustuvorligining pasayishi soat yo'nalishi bo'yicha R-konfiguratsiyasiga, soat sohasi farqli o'laroq-S-konfiguratsiyasiga to'g'ri keladi.
Optik izomerlar quyidagi usullar bilan olinadi:
a) optik faol birikmalarni o'z ichiga olgan tabiiy materiallardan ajratish, masalan, oqsillar va aminokislotalar, uglevodlar, ko'plab gidroksidli kislotalar (tartarik, molik, bodom), terpen uglevodorodlar, terpen spirtlari va ketonlar, steroidlar, alkaloidlar va boshqalar.
b) rasematlarning bo'linishi;
v) assimetrik sintez;
d) optik faol moddalarni biokimyoviy ishlab chiqarish.
BILASIZMI
Izomeriya hodisasi (yunon tilidan - mensos - boshqacha va meros - ulush, qism) 1823 yilda ochilgan. J. Liebig va F. Vyohler ikkita noorganik kislotaning tuzlari misolida: siyanik H-O-C≡N va portlovchi H-O-N = C.
1830 yilda J. Dyuma izomeriya tushunchasini organik birikmalarga kengaytirdi.
1831 yilda. organik birikmalar uchun "izomer" atamasini J. Berzelius taklif qilgan.
Tabiiy birikmalarning stereoizomerlari har xil biologik faollik bilan ajralib turadi (aminokislotalar, uglevodlar, alkaloidlar, gormonlar, feromonlar, tabiiy kelib chiqadigan dorivor moddalar va boshqalar).
Geometrik izomerlar-sis-trans izomeriyasi yoki EZ izomeriyasi. Ularning harakatlari uglerodli er -xotin yoki yakka bog'lanishlarning davriy birikmalarda cheklangan aylanishiga asoslangan, tsiklik birikmada uglerodli bitta bog'lanish orasidagi aylanish cheklangan va har bir uglerod izomeriga o'xshash tarzda ikki xil guruh biriktirilgan. Bunday geometrik izomerlar ko'pincha fizik xususiyatlari bilan farq qiladi. Bu izomerlarning shakli va umumiy dipol momenti bilan bog'liq. Agar ustuvorlikka ega bo'lgan ikkita atom izomerning bir tomonida qolsa, u holda ular Z deb belgilanadi, agar ular qarama -qarshi tomonda bo'lsa E.
Izomerizmning qisqacha tarixi
Konstitutsiyaviy izomeriya kontseptsiyasi zamonaviy kimyo tarixida va ayniqsa organik kimyo rivojlanishida muhim qadamdir. 1700 -yillarning oxiriga kelib, "hayvonlar" va "o'simliklar" kimyosini o'rganish orqali bir nechta toza moddalar ajratildi. Ko'pchilik Karl Vilgelm Scheele (1742-1786) tomonidan olingan. Organik birikmalarning xilma -xilligi tufayli har bir yangi modda "mineral" kimyo bo'yicha umumiy kuzatishga mos keladigan boshqa elementli tarkibni taqdim etdi. 1800 -yillarning boshlarida har xil moddalarni aniqlash orqali ajratilgan organik birikmalar soni oshdi.
1830 yilda Tomas Tomson kimyo tarixi haqidagi kitobida shunday yozgan edi:
Berzelius atom nazariyasini o'simlik podsholigiga ham tatbiq etdi, bir nechta o'simlik kislotalarini tahlil qilib, uning atom tuzilishini ko'rsatdi, lekin bu erda biz bilgan hozirgi sharoitda biz engib o'tolmaydigan qiyinchilik tug'iladi. Aynan bir xil atomlardan tashkil topgan ikkita kislota bor. Xo'sh, biz bu ajoyib farqni qanday hisobga olishimiz kerak? Shubhasiz har xil yo'llar, ularning har birida atomlar joylashgan.
Keyin Tomson o'sha paytda ishlatilgan atom belgilarining turli sxemalarini ishlatib, nima uchun geometrik izomerlar deb ataladigan bir xil element tarkibiga ega bo'lgan ikkita kislotaning har xil fizik va kimyoviy xossalarga ega ekanligini tushuntirdi.
19 -asrning boshlariga qadar tirik organizmlarda topilgan bu kimyoviy moddalar tirik mavjudotlar bilan bog'liq bo'lgan alohida hayotiy kuchga ega va ular tirik tizimlarda ko'payish uchun kerak deb ishonilgan. 1828 yilda Vyohler karbamid namunasini (NH2) 2CO (shuningdek CH4N2O) sintez qildi, uni biologik siydikdan chiqarilgan karbamiddan ajratib bo'lmaydi.
U bu "hayvon" moddasini ammiakli xlorid va kumush siyanat kombinatsiyasi natijasida hosil bo'lgan ammiakli siyanat (NH4) NCO (shuningdek CH4N2O) aniq noorganik (mineralologik) boshlang'ich materialidan tayyorladi. Shunday qilib, "tirik" va "tirik bo'lmagan" izomeriya o'rtasidagi to'siq qulab tushdi.
Cis izomerida ikkita o'xshash guruh ikki tomonlama aloqaning bir tomonida, trans izomerda esa qarama -qarshi tomonda qoladi. Masalan, 2-buten ikkita izomerga ega: cis va trans.
Cis izomerida ikkita bog'lanishning bir tomonida ikkita metil guruhi va ikkita vodorod guruhi qoladi, trans izomerda esa ular qarama -qarshi tomonda qoladi.
Qachonki er -xotin bog'lanish bilan bog'liq bir yoki bir nechta guruh bir xil bo'lmasa, izomerlar E yoki Z deb nomlanadi. Bu turni xabardor qilish uchun foydalanuvchi geometrik izomerlarga ega uglevodorodlarning formulalarini ko'rsatishi va eng ustuvor bo'lgan atomni aniqlashi kerak bo'ladi ( eng yuqori atom raqami). har bir er -xotin bog'lanishga biriktirilgan C. Agar eng yuqori ustuvorlikka ega bo'lgan ikkita atom izomerning bir tomonida qolsa, u Z bilan belgilanadi va agar ular qarama -qarshi tomonda bo'lsa, E sifatida belgilanadi.

Masalan, 1 - brom - 1 - floropropan ikkita izomerga ega. Z -1 - brom - 1 - floropropanda bromning C -1 ga biriktirilgan ftor (9) ga qaraganda ustunligi yoki yuqori atom raqami (35) borligini ko'rish mumkin. Uglerod vodoroddan (1) yuqori atom raqamiga ega (6), bu birikmaning C-2 ga biriktirilgan. Eng yuqori ustuvorlikka ega bo'lgan uglerod atomlari (-CH3 guruhidan) va bu ikki uglerod atomiga biriktirilgan brom atomlari bir tomonda bo'lgani uchun, bu birikma Z., boshqa tomondan, E -1 - bromo - 1 sifatida belgilanadi. - fluoropropan, C va brom ustuvorligi yuqori bo'lgan atomlar qarama-qarshi tomonda joylashgan, shuning uchun uni E-izomer deb atashadi.
Uglerod-uglerodli bog'lanish
Izomerlar bir xil atom tarkibiga ega, lekin bir xil bo'lmagan ikkita molekula. Ikki izomerdagi atomlarni boshqa tartibda bog'lash mumkin (tizimli izomeriya) yoki ular bir xil tarzda bog'lanishi mumkin, lekin boshqacha yo'nalishga ega - fazoviy stereoizomerizm.
Strukturaviy va geometrik izomer alohida holatlarda - stereoizomer ikkita talabga javob berishi kerak:
- Molekulada aylanish cheklangan.
- Cheklovchi aloqada ishtirok etadigan ikkala atom ham ular uchun ikki xil funktsional guruhga ega.
Cheklangan aylanishning keng tarqalgan misoli uglerod-uglerodli ikki tomonlama bog'lanishdir. Bu obligatsiyalar pi obligatsiyasini o'z ichiga oladi; ko'p hollarda ularni buzish foydali emas.

Geometrik izomerlar birikmaning fizik xossalariga ta'sir etuvchi tuzilishga ega.
Cis / Trans tizimi
Cis / Trans nomlanishi - eng oddiy ulanish tizimi. Birinchidan, molekuladagi eng uzun uglerod zanjiri aniqlanadi, so'ngra qiziqishning funktsional guruhlari aniqlanadi. Cis izomerida, ko'rib chiqilayotgan ikkita guruh qo'shaloq aloqaning bir tomonida joylashgan (cis lotincha "bir tomondan" degan ma'noni anglatadi). Trans izomerda ko'rib chiqilgan ikkita guruh qo'shaloq aloqaning qarama -qarshi tomonlarida joylashgan (trans degan ma'noni anglatadi) Lotin). Masalan, buten-2 ning ikki xil geometrik izomerlari.

Ikkala bog'langan atomlar ham bu ikki guruh kabi bir xil guruhga ega, lekin ular bir xil karbonli uglerodlardan birida farq qiladi. Yon zanjirlar va funktsional guruhlar murakkablashganda vazifa murakkablashadi.
IUPAC rasmiy nomlash tizimi E / Z belgisidan foydalanadi. Cis / trans va E / Z o'rtasida aniq bog'liqlik yo'q va bu ikki tizim bir -birining o'rnini bosa olmaydi. E / Z belgisi Cahn-Ingold-Prelog ustuvorlik qoidalarini qo'llaydi va yanada ishonchli hisoblanadi. Fumarik kislota uchun IUPAC nomi HO2CCH = CHCO2H formulasiga ega bo'lgan trans-izomerdir va maleik kislota sis-butendioik kislotadir.

IUPAC - Xalqaro toza va amaliy kimyo uyushmasi bo'lib, u barcha tillarda kimyoviy moddalarni nomlashning xalqaro qoidalari va standartlarini belgilaydi.
Tsiklik bog'lanishda uglerodli yagona bog'lanish orasidagi aylanish cheklangan. Shunday qilib, bu turdagi birikmalar uchun ikkita bo'lsa izomeriya ham mumkin turli guruhlar... 1,2-dimetilsiklopropanning ikkita izomeri bor.

Ulardan biri sis izomeridir, u erda ikkita metil guruhi bir tomonda, ikkinchisi esa boshqa tomonda ikkita metil guruhi bo'lgan trans izomerdir.
Geometrik izomerlar fizik xususiyatlari bilan farq qiladi. Bu izomerlarning shakli va umumiy dipol momenti bilan bog'liq. Masalan, ular qaynash nuqtasida farq qiladi. 1,2-dikloroetilenning sis va trans izomerlarining qaynash nuqtalari mos ravishda 60,3 ° S va 47,5 ° S dir.
Cis izomerida ikkita dipolli bogning (C-Cl) mavjudligi umumiy molekulyar dipolni beradi. Bu molekulalararo dipol-dipol kuchlariga olib keladi. Bu kuch uchun sis izomerining trans izomeridan yuqori qaynash nuqtasi bor, bu erda qarama-qarshi yo'nalishdagi joylashuvi tufayli ikkita dipolli aloqa (C-Cl) bekor qilinadi.
Uglerod-uglerodli er-xotin bog'lanishni aylantira olmasligining sababi shundaki, uglerod atomlarini bir-biriga bog'laydigan ikkita bog 'bor va pi aloqasi uzilishi kerak. Pi aloqalari p-orbitallar orasidagi lateral qoplama natijasida hosil bo'ladi. Agar kimdir uglerod-uglerodli bog'lanishni aylantirmoqchi bo'lsa, p-orbitallar endi bir-biriga to'g'ri kelmaydi va shuning uchun pi aloqasi uziladi. Bunga energiya sarflanadi va bu faqat ulanish juda issiq bo'lsa sodir bo'ladi.
Qisqartish paytida strukturaviy formulalar tuzishda geometrik izomerlarning muhim elementlarini e'tiborsiz qoldirish juda oson. Masalan, but-2-ene chizish juda qiziq; agar foydalanuvchi noto'g'ri yozsa, birikma izomer bo'lmaydi. Agar izomerdan foydalanish mumkinligi haqida eng kichik ko'rsatma bo'lsa, har doim uglerod atomlarining atrofida to'g'ri burchakli (120 °) ko'rsatuvchi uglerod-uglerodli bog'lanishli birikmalardan foydalanish kerak. Boshqacha aytganda, siz rasmda ko'rsatilgan formatni ishlatishingiz kerak.

Uglerod-uglerodli er-xotin bog'lanishni o'z ichiga olgan birikmalarning aylanishi cheklangan. Izomerlarni olish uchun, majburiy shartlar:
- cheklangan aylanish, odatda uglerod-uglerodli er-xotin bog'lanish;
- havolaning chap uchida ikki xil guruh va o'ng uchida ikki xil guruh.
Chap guruhlar o'ng guruhlar bilan bir xil bo'ladimi, farqi yo'q.
Alkenlarning geometrik izomerlariga uglerod zanjiridagi C va H atomlaridan tashkil topgan bir qancha birikmalar kiradi. Bu guruhga CnH2n formulali gomologik qator kiradi. Eng oddiy alken - bu eten, u ikkita C atomiga va C2H4 formulasiga ega.

Etenning strukturaviy formulasi yuqoridagi rasmda ko'rsatilgan. Uzunroq alken zanjirlarida qo'shimcha uglerod atomlari bir -biriga kovalent bog'lanishlar orqali birikadi. Har bir uglerod, shuningdek, to'rtta bitta kovalent bog'lanish hosil qilish uchun etarli vodorod atomlariga biriktirilgan.
To'rt yoki undan ortiq C atomli zanjirlarda er -xotin bog'lanish turli pozitsiyalarda joylashishi mumkin, bu esa struktur izomerlarning paydo bo'lishiga olib keladi. Alkenlar tizimli izomerlardan tashqari stereoizomerlarni ham hosil qiladi. Ko'p bog'lanish atrofida aylanish cheklanganligi sababli, er -xotin bog'lanish atomlariga biriktirilgan guruhlar har doim bir xil nisbiy pozitsiyalarda qoladi.
Bu "qulflangan" pozitsiyalar kimyogarlarga qaysi moddaning geometrik izomerlari borligini aniqlash uchun ularning o'rnini bosuvchi turli izomerlarni aniqlash imkonini beradi. Masalan, C5H10 ning bitta tizimli izomeri quyidagi stereoizomerlarga ega.

Chapdagi ikkita almashtiruvchi (metil va etil guruhlari) er-xotin bog'lanishning bir tomonida joylashgan izomer, sis izomeri, o'ng tomonida esa, vodorod bo'lmagan ikkita qarama-qarshi o'rinli izomer-trans. izomer.
Masalan, xlor og'irroq bo'lgani uchun birinchi o'rinda turadi. BILAN o'ng tomon brom ugleroddan ustun. Uchinchidan, yuqori darajadagi ikkita atomning pozitsiyalari aniqlanadi. Agar ikkita atom cis pozitsiyasida bo'lsa, tartib Z (nemis zusammenidan, "birga" degan ma'noni anglatadi). Agar atomlar yoki guruhlar trans holatida bo'lsa, tartib E (nemis entgegen so'zidan "qarama -qarshi" degan ma'noni anglatadi).
Geometrik izomerlar buten - qattiq bog'langan alken. Bu shuni anglatadiki, er -xotin bog'lanish holatida uchta emas, balki to'rtta izomer mavjud. Xuddi shu tarkibning beshinchi va oltinchi uglevodorodlari bor, lekin ular bir xil formulaga qaramay alkenlar emas.

Siklobutan yoki metilsiklopropanning halqali shakllanishi ikkita vodorod atomining bo'sh joyini er -xotin bog'lanish sifatida egallaydi, bu ularning turli butenlar uchun bir xil formulalarga ega bo'lishiga olib keladi.
Geometrik izomerlarga misollar:
- 1-butilen (1-buten);
- izo-butilen (2-metil-propen);
- sis-2-butilen (sis-2-buten);
- trans-2-butilen (trans-2-buten).
Va bonuslar: siklobutan va metilsiklopropan - ikkalasi ham buten izomerlari bilan bir xil empirik formulaga ega, lekin alkenlar emas. Birinchi ism - "umumiy" yoki "arzimas" ism, va qavs ichidagi ism - IUPAC nomi.
Butenning ko'p foydali tomonlari bor: mashinada yoqilg'idan tortib, har kuni butun dunyo bo'ylab yuz millionlab odamlar olib ketadigan oziq -ovqat sumkalariga qadar. Butenning kimyoviy formulasi C4H8, ya'ni to'rtta C atomiga va sakkizta H atomiga ega, birikma alkenni bildiradi.
Bu birikma hosil qilishi mumkin bo'lgan turli xil izomerlar yoki molekulyar tuzilmalar mavjud (IUPAC nomlari qavs ichida ko'rsatilgan):
- alfa-butilen (but-1-en);
- sis-beta-butilen-((2Z) -but-2-en);
- trans-beta-butilen-((2E) -but-2-en);
- izobutilen (2-metilprop-1-en).

Hamma bir xil formulaga ega bo'lsa -da, ularning tuzilishi boshqacha. Bu geometrik izomerlarning har biri o'rtasidagi munosabatlar asosan konstitutsiyaviydir, ya'ni ular bir xil molekulyar formulaga ega, lekin har xil bog'lanishlar. Istisno-sis-beta-butilen va trans-beta-butilen.
Ko'p odamlar trans yog'larning odamlar uchun zararli ekanligini, to'yinmagan yog'lar esa ular uchun yaxshi ekanligini bilishadi. Bu ikki yog'ning yagona farqi shundaki, birining trans aloqasi bor, ikkinchisida cis aloqasi bor, lekin bu ozgina farqlash molekulaning ishiga sezilarli ta'sir ko'rsatishi mumkin.
Cis-beta-butilen va trans-beta-butilen bilan atomlar bir xil tartibda, lekin qutblari boshqacha. Cis izomeri qutbli bo'lib, ikkala CH3 guruhi bir tomonda. Bu uni chindan ham katta va murakkab qiladi.Trans izomeri qutbsiz, katta hajmli CH3 guruhlari almashadi, bu esa molekulada ko'proq joy beradi. Bu nisbat cis-trans izomeriyasi deyiladi. Sis izomerlari qutbli, trans izomerlari esa yo'q.
Bu buten izomerlarining har biri bir xil materiallardan iborat bo'lsa -da, ularning har biri har xil fizik xususiyatlarga ega. Masalan, qaynash nuqtasi:
- Sis-beta-butilen: 3,7 ° S.
- Trans-beta-butilen: 0,8 ° S
- Izobutilen: -6,9 ° S.
- Alfa -butilen: -6,3 ° S.
Plastmassa ishlab chiqarish uchun material
Butenlar to'rt uglerod atomiga ega alkenlar, C4H8. Butenning turli xil konstruktiv yoki konfiguratsion izomerlari, shu jumladan geometrik va optik izomerlari mavjud. To'rtta buten ham xuddi shunday fizik xususiyatlarga ega, ular rangsiz gazlar, suvda og'ir, efir va alkanlarda oson eriydi. Farqlar jismoniy xususiyatlar molekulalarning tuzilishi bilan izohlanadi. Masalan, cis-But-2-en qaynash nuqtasi trans-But-2-enga qaraganda yuqori, chunki u kuchli dipol.

Cis izomerining ikkita alkil guruhi + I effekti bilan bir yo'nalishda ishlaydi va shu tariqa kuchayadi, trans izomerlarning ikkita alkil guruhi qarama -qarshi yo'nalishda harakat qiladi va shu tariqa bir -birini zaiflashtiradi. Geometrik izomerlarga ega uglevodorodlar uchun formulalar IUPAC standartlariga muvofiq ko'rsatilgan. But-1-enning erish nuqtasi juda past, chunki CC ikkinchi va uchinchi uglerod atomlari orasidagi erkin bog'lanishdir va etil guruhi aylanish o'qi atrofida hamma yo'nalishda aylana oladi.
Bu molekulani qattiq kristalli tuzilishga ajratishni qiyinlashtiradi. Ikkinchi va uchinchi C atomlari o'rtasida er -xotin bog'langan qolgan uchta buten juda qattiq va ularni kristalli tuzilmalarga oson tasniflash mumkin. Shuning uchun ular nisbatan yuqori erish nuqtalariga ega. Bu dalillar har doim ham to'g'ri emas, chunki misolda 2-metil-but-2-en (yoki izobuten) ko'rsatilgan. Ikki metil guruhi, ularning + I-effektlari bilan, cis-But-2-en bilan bir xil yo'nalishda harakat qiladi va aslida yaxshilanishi kerak. Shu bilan birga, izobuten juda past qaynash nuqtasiga ega --7 ° C.
But-1-en va But-2-en butadiyen va butan-2-ol ishlab chiqarish uchun ishlatiladi. Bundan tashqari, alkenlar alkillovchi vosita sifatida ishlatiladi. Shunday qilib, muhim yoqilg'i 2,2,4-Trimetil-pentan, yaxshi isooktan sifatida tanilgan, izobuten va izobutandan olinadi. Nihoyat, butenlar ba'zi plastmassalar uchun boshlang'ich materialdir, chunki ularni polimerizatsiya qilish oson. But-1-ga asoslangan mashhur plastmassa polibuten-1 bo'lib, undan quvurlar tayyorlanadi.
Pentan, n-pentan, izopentan
Pentan yoki n-pentan-to'yingan uglevodorod alkanlaridan biri. Deyarli hidsiz, n-pentan atrof-muhit sharoitida suyuq bo'lib, herakatexitning 3-izomer izomeridir. Tarmoqli suyuq izoalkanlar C5 - C16 tobora ko'proq yoqilg'i sifatida ishlatiladi (Otto, Dizel). Bundan tashqari, bu alkanlar yog'lar va moylash materiallarida mavjud. Ular to'liq yonishini ta'minlaydi. Bunday birikmalarning xususiyatlarini bilishdan oldin, geometrik izomerlari bo'lgan uglevodorodlarning formulalarini ko'rsatish kerak:
- Jismoniy holat suyuq.
- Rangi rangsiz.
- Hidi - deyarli yo'q.
- Oson yonadi.
- Bug'lar havoga tushganda portlovchi aralashmalar hosil qilishi mumkin.
- Suvda eruvchanligi juda past (amalda erimaydi).
- Juda beqaror aloqa.
Pentanning eng muhim manbalari neft moylari bo'lib, ular kelib chiqishiga qarab tarkibi jihatidan farq qiladi. Ajratish kasrli distillash yordamida amalga oshiriladi. Bu erda quyidagi guruhlar olinadi:
- Parafin yog'i (qaynash harorati> 320 ° C).
- Yog '(qaynash harorati 180 dan 250 ° C gacha).
- Isitish / dizel (qaynash harorati 250 dan 320 ° C gacha).
- Xom benzin (qaynash harorati taxminan 180 ° C gacha).
- Naftada C5 dan C10 gacha tarvaqaylab ketgan uglevodorodlar (alkanlar) mavjud.
- Pentanning kislorod bilan yonishi (stokiyometrik).
- Oxirgi mahsulotlar karbonat angidrid va suvdir. Geometrik izomerlarning formulalari: C5H12 + 8O2 ⟹ 5CO2 + 6H2O.
| Issiqlik qiymati HU | Issiqlik qiymati HU [kVt / kg] |
||
Penten-2 ning geometrik izomeri ko'p qirrali hal qiluvchi hisoblanadi. Fenolik qatronlar va polistirolni ko'piklashda ishlatiladi. Shuningdek, u gaz xromatografiyasida mos yozuvlar moddasi sifatida, purkagichli tsilindrlarda esa yonilg'i sifatida talab qilinadi.


 Erkaklar qishki ko'ylagi namunasi
Erkaklar qishki ko'ylagi namunasi Erkaklar qishki ko'ylagi namunasi
Erkaklar qishki ko'ylagi namunasi Sutli ona yoki emizuvchi donor
Sutli ona yoki emizuvchi donor