1 od osnovnih svojstava vode. Fizikalna svojstva vode
Voda (vodikov oksid) je prozirna tekućina koja nema boju (u malom volumenu), miris i okus. Kemijska formula: H2O. U čvrstom stanju naziva se led ili snijeg, a u plinovitom vodena para. Oko 71% Zemljine površine prekriveno je vodom (oceani, mora, jezera, rijeke, led na polovima).
Dobro je visoko polarno otapalo. U prirodnim uvjetima uvijek sadrži otopljene tvari (soli, plinovi). Voda je ključna u nastanku i održavanju života na Zemlji, u kemijskoj strukturi živih organizama, u formiranju klime i vremena.
Gotovo 70% površine našeg planeta zauzimaju oceani i mora. Čvrsta voda - snijeg i led - prekriva 20% kopna. Od ukupne količine vode na Zemlji, koja iznosi 1 milijardu 386 milijuna kubičnih kilometara, 1 milijarda 338 milijuna kubičnih kilometara otpada na udio slanih voda Svjetskog oceana, a samo 35 milijuna kubičnih kilometara otpada na udio slatkih voda. Ukupna količina oceanske vode bila bi dovoljna da prekrije zemaljsku kuglu slojem većim od 2,5 kilometara. Na svakog stanovnika Zemlje dolazi otprilike 0,33 kubična kilometra morske vode i 0,008 kubičnih kilometara slatke vode. Ali poteškoća je u tome što je velika većina slatke vode na Zemlji u stanju koje otežava pristup ljudima. Gotovo 70% slatke vode sadržano je u ledenim pločama polarnih zemalja i planinskim ledenjacima, 30% je u podzemnim vodonosnicima, a samo 0,006% slatke vode istovremeno je sadržano u kanalima svih rijeka. Molekule vode pronađene su u međuzvjezdanom prostoru. Voda je dio kometa, većine planeta Sunčeva sustava i njihovih satelita.
Sastav vode (maseni): 11,19% vodika i 88,81% kisika. Čista voda je bistra, bez mirisa i okusa. Najveću gustoću ima na 0°C (1 g/cm3). Gustoća leda je manja od gustoće tekuće vode, pa led pluta na površini. Voda se smrzava na 0°C, a vrije na 100°C pri tlaku od 101 325 Pa. Loš je vodič topline i vrlo loš vodič elektriciteta. Voda je dobro otapalo. Molekula vode ima kutni oblik, atomi vodika tvore kut od 104,5° u odnosu na kisik. Prema tome, molekula vode je dipol: pozitivno je nabijen onaj dio molekule gdje se nalazi vodik, a negativno je nabijen onaj dio gdje se nalazi kisik. Zbog polariteta molekula vode, elektroliti u njoj disociraju na ione.
U tekućoj vodi, uz obične molekule H20, postoje i pridružene molekule, tj. spojene u složenije agregate (H2O)x zbog stvaranja vodikovih veza. Prisutnost vodikovih veza između molekula vode objašnjava anomalije njegovih fizičkih svojstava: maksimalnu gustoću na 4 ° C, visoko vrelište (u seriji H20-H2S - H2Se) anomalično visok toplinski kapacitet. Kako temperatura raste, vodikove veze pucaju, a do potpunog prekida dolazi kada se voda pretvori u paru.
Voda je vrlo reaktivna tvar. U normalnim uvjetima stupa u interakciju s mnogim bazičnim i kiselim oksidima, kao i s alkalijskim i zemnoalkalijskim metalima. Voda stvara brojne spojeve - kristalne hidrate.
Očito, spojevi koji vežu vodu mogu poslužiti kao sredstva za sušenje. Ostala sredstva za sušenje uključuju P205, CaO, BaO, metalni Ma (oni također kemijski stupaju u interakciju s vodom) i silikagel. Važno kemijsko svojstvo vode je njezina sposobnost stupanja u reakcije hidrolitičke razgradnje.
Fizikalna svojstva vode.
Voda ima nekoliko neobičnih svojstava:
1. Kada se led topi, povećava se njegova gustoća (od 0,9 do 1 g/cm³). Gotovo svim ostalim tvarima gustoća se smanjuje taljenjem.
2. Pri zagrijavanju od 0 °C do 4 °C (točnije 3,98 °C) voda se skuplja. U skladu s tim, kako se hladi, gustoća se smanjuje. Zahvaljujući tome, ribe mogu živjeti u ledenim vodenim tijelima: kada temperatura padne ispod 4 ° C, hladnija voda, kao manje gusta, ostaje na površini i smrzava se, a pozitivna temperatura ostaje ispod leda.
3. Visoka temperatura i specifična toplina taljenja (0 °C i 333,55 kJ/kg), vrelište (100 °C) i specifična toplina isparavanja (2250 kJ/kg), u usporedbi s vodikovim spojevima slične molekulske težine.
4. Visoki toplinski kapacitet tekuće vode.
5. Visoka viskoznost.
6. Visoka površinska napetost.
7. Negativan električni potencijal vodene površine.
Sve te značajke povezane su s prisutnošću vodikovih veza. Zbog velike razlike u elektronegativnosti atoma vodika i kisika, elektronski oblaci su jako pomaknuti prema kisiku. Zbog toga, kao i činjenice da vodikov ion (proton) nema unutarnje elektronske slojeve i malih je dimenzija, može prodrijeti u elektronsku ljusku negativno polariziranog atoma susjedne molekule. Zbog toga se svaki atom kisika privlači prema atomima vodika drugih molekula i obrnuto. Određenu ulogu igra interakcija izmjene protona između i unutar molekula vode. Svaka molekula vode može sudjelovati u najviše četiri vodikove veze: 2 atoma vodika - svaki u jednoj, a atom kisika - u dvije; u ovom stanju, molekule su u kristalu leda. Kada se led otopi, neke od veza pucaju, što omogućuje gušće pakiranje molekula vode; kada se voda zagrijava, veze nastavljaju pucati, a njezina gustoća raste, ali na temperaturama iznad 4 ° C, taj učinak postaje slabiji od toplinskog širenja. Isparavanje kida sve preostale veze. Za kidanje veza potrebno je mnogo energije, otuda visoka temperatura i specifična toplina taljenja i vrenja te veliki toplinski kapacitet. Viskoznost vode posljedica je činjenice da vodikove veze sprječavaju molekule vode da se kreću različitim brzinama.
Iz sličnih razloga, voda je dobro otapalo za polarne tvari. Svaka molekula otopljene tvari okružena je molekulama vode, a pozitivno nabijeni dijelovi molekule otopljene tvari privlače atome kisika, a negativno nabijeni dijelovi privlače atome vodika. Budući da je molekula vode mala, mnoge molekule vode mogu okružiti svaku molekulu otopljene tvari.
Ovo svojstvo vode koriste živa bića. U živoj stanici iu međustaničnom prostoru međusobno djeluju otopine različitih tvari u vodi. Voda je neophodna za život svih, bez iznimke, jednostaničnih i višestaničnih živih bića na Zemlji.
Čista (bez nečistoća) voda je dobar izolator. U normalnim uvjetima voda je slabo disocirana, a koncentracija protona (točnije hidronijevih iona H3O+) i hidroksidnih iona HO− iznosi 0,1 µmol/l. No kako je voda dobro otapalo, u njoj su gotovo uvijek otopljene određene soli, odnosno u vodi su prisutni pozitivni i negativni ioni. Kao rezultat toga, voda provodi struju. Električna vodljivost vode može se koristiti za određivanje njezine čistoće.
Voda ima indeks loma n=1,33 u optičkom području. Međutim, snažno apsorbira infracrveno zračenje, pa je stoga vodena para glavni prirodni staklenički plin odgovoran za više od 60% efekta staklenika. Zbog velikog dipolnog momenta molekula, voda apsorbira i mikrovalno zračenje, na čemu se temelji princip rada mikrovalne pećnice.
agregatna stanja.
1. Prema stanju razlikuju:
2. Čvrsto - led
3. Tekućina - voda
4. Plinovito – vodena para
Sl.1 "Vrste snježnih pahuljica"
Pri atmosferskom tlaku voda se smrzava (pretvara u led) na 0°C, a vrije (prelazi u vodenu paru) na 100°C. Kako se tlak smanjuje, talište vode polako raste, a vrelište pada. Pri tlaku od 611,73 Pa (oko 0,006 atm), točke vrenja i tališta se podudaraju i postaju jednake 0,01 ° C. Taj tlak i temperatura nazivaju se trostruka točka vode. Pri nižim tlakovima voda ne može biti u tekućem stanju, a led se pretvara izravno u paru. Temperatura sublimacije leda opada s padom tlaka.
S porastom tlaka raste vrelište vode, povećava se i gustoća vodene pare na vrelištu, a pada tekuća voda. Pri temperaturi od 374 °C (647 K) i tlaku od 22,064 MPa (218 atm), voda prolazi kritičnu točku. U ovom trenutku, gustoća i druga svojstva tekuće i plinovite vode su iste. Pri višim tlakovima nema razlike između tekuće vode i vodene pare, stoga nema vrenja niti isparavanja.
Moguća su i metastabilna stanja - prezasićena para, pregrijana tekućina, prehlađena tekućina. Ova stanja mogu postojati dugo, ali su nestabilna i prijelaz se događa nakon kontakta sa stabilnijom fazom. Na primjer, nije teško dobiti prehlađenu tekućinu hlađenjem čiste vode u čistoj posudi ispod 0 °C, međutim, kada se pojavi centar kristalizacije, tekuća voda se brzo pretvara u led.
Izotopske modifikacije vode.
I kisik i vodik imaju prirodne i umjetne izotope. Ovisno o vrsti izotopa uključenih u molekulu, razlikuju se sljedeće vrste vode:
1. Lagana voda (samo voda).
2. Teška voda (deuterij).
3. Superteška voda (tricij).
Kemijska svojstva vode.
Voda je najčešće otapalo na Zemlji, uvelike određujući prirodu zemaljske kemije kao znanosti. Veći dio kemije, na početku kao znanosti, započeo je upravo kao kemija vodenih otopina tvari. Ponekad se smatra amfolitom - istovremeno i kiselinom i bazom (kation H + anion OH-). U nedostatku stranih tvari u vodi, koncentracija hidroksidnih iona i vodikovih iona (ili hidronijevih iona) je ista, pKa ≈ cca. 16.
Voda - jedan od najčudesnijih spojeva na Zemlji - dugo je zadivljivala istraživače neobičnošću mnogih svojih fizičkih svojstava:
1) Neiscrpnost kao supstanca i prirodni resurs; ako su svi drugi resursi zemlje uništeni ili raspršeni, tada voda, kao da bježi iz ovoga, poprimajući različite oblike ili stanja: osim tekućina, čvrsta i plinovita. To je jedina tvar i resurs ove vrste. Ovo svojstvo osigurava sveprisutnost vode, ona prožima cijeli geografski omotač Zemlje i u njemu obavlja različite poslove.
2) Širenje svojstveno samo njemu tijekom skrućivanja (smrzavanja) i smanjenja volumena tijekom taljenja (prijelaz u tekuće stanje).
3) Maksimalna gustoća na temperaturi od +4 °C i vrlo važna svojstva povezana s tim za prirodne i biološke procese, na primjer, isključivanje dubokog smrzavanja vodenih tijela. U pravilu se najveća gustoća fizičkih tijela opaža na temperaturi skrućivanja. Najveća gustoća destilirane vode opažena je u nenormalnim uvjetima - na temperaturi od 3,98-4 ° C (ili zaokruženo +4 ° C), tj. na temperaturi iznad točke skrućivanja (smrzavanja). Kada temperatura vode odstupi od 4 °C u oba smjera, gustoća vode opada.
4) Prilikom otapanja (taljenja) led pluta na površini vode (za razliku od drugih tekućina).
5) Anomalna promjena gustoće vode povlači za sobom istu anomalnu promjenu volumena vode kada se zagrijava: s porastom temperature od 0 do 4 ° C, volumen zagrijane vode se smanjuje i tek s daljnjim povećanjem počinje povećati. Ako su se s padom temperature i tijekom prijelaza iz tekućeg u čvrsto stanje gustoća i volumen vode mijenjali na isti način kao što se događa s velikom većinom tvari, tada kada se približi zima, površinski slojevi prirodnih voda bi se ohladila na 0°C i potonula na dno oslobađajući prostor.toplijih slojeva, i tako bi se nastavilo sve dok cijela masa rezervoara ne bi poprimila temperaturu od 0°C. Nadalje, voda bi se počela lediti, nastale ledene sante bi potonule na dno, a rezervoar bi se zaledio do cijele dubine. U isto vrijeme, mnogi oblici života u vodi bili bi nemogući. No budući da voda svoju najveću gustoću postiže na 4 °C, kretanje njezinih slojeva uzrokovano hlađenjem prestaje kada se postigne ta temperatura. Daljnjim sniženjem temperature ohlađeni sloj manje gustoće ostaje na površini, smrzava se i na taj način štiti podložne slojeve od daljnjeg hlađenja i smrzavanja.
6) Prijelaz vode iz jednog stanja u drugo popraćen je troškovima (isparavanje, taljenje) ili oslobađanjem (kondenzacija, smrzavanje) odgovarajuće količine topline. Za topljenje 1 g leda potrebno je 677 cal, a za isparavanje 1 g vode 80 cal manje. Visoka latentna toplina topljenja leda osigurava sporo topljenje snijega i leda.
7) Sposobnost relativno lakog prijelaza u plinovito stanje (isparavanje) ne samo pri pozitivnim, već i pri negativnim temperaturama. U potonjem slučaju dolazi do isparavanja zaobilazeći tekuću fazu - iz čvrste (led, snijeg) odmah u parnu fazu. Taj se fenomen naziva sublimacija.
8) Usporedimo li vrelište i ledište hidrida koje tvore elementi šeste skupine periodnog sustava (selen H 2 Se, telur H 2 Te) i voda (H 2 O), tada po analogiji s njima, vrelište točka vode treba biti oko 60 ° C, a točka smrzavanja ispod 100 ° C. Ali čak i ovdje se očituju anomalna svojstva vode - pri normalnom tlaku od 1 atm. Voda vrije na +100°C, a smrzava se na 0°C.
9) Od velikog značaja za život prirode je činjenica da voda ima anomalno visok toplinski kapacitet, 3000 puta veći od zraka. To znači da kada se 1 m 3 vode ohladi za 1 0 C, 3000 m 3 zraka se zagrije za istu količinu. Stoga ocean akumulirajući toplinu djeluje omekšavajuće na klimu obalnih područja.
10) Voda apsorbira toplinu tijekom isparavanja i taljenja, oslobađajući je tijekom kondenzacije iz pare i smrzavanja.
11) Sposobnost vode da u disperziranim medijima, npr. u fino poroznim tlima ili biološkim strukturama, prijeđe u vezano ili raspršeno stanje. U tim slučajevima jako se mijenjaju svojstva vode (njena pokretljivost, gustoća, ledište, površinski napon i drugi parametri), koji su iznimno važni za procese u prirodnim i biološkim sustavima.
12) Voda je univerzalno otapalo, stoga ne samo u prirodi, već ni u laboratorijskim uvjetima ne postoji idealno čista voda iz razloga što je sposobna otopiti svaku posudu u kojoj se nalazi. Postoji pretpostavka da bi površinska napetost idealno čiste vode bila takva da bi se po njoj moglo klizati. Sposobnost topljivosti vode osigurava prijenos tvari u zemljopisnom omotaču, u osnovi je izmjene tvari između organizama i okoliša te je osnova prehrane.
13) Od svih tekućina (osim žive), voda ima najveći površinski tlak i površinsku napetost: \u003d 75 10 -7 J / cm 2 (glicerin - 65, amonijak - 42, a sve ostalo - ispod 30 10 -7 J / cm 2). Zbog toga kap vode nastoji poprimiti oblik lopte, a kada dođe u dodir s krutim tvarima, namoči površinu većine njih. Zbog toga se može uzdizati u kapilare stijena i biljaka, osiguravajući formiranje tla i ishranu biljaka.
14) Voda ima visoku toplinsku stabilnost. Vodena para počinje se raspadati na vodik i kisik tek na temperaturama iznad 1000 °C.
15) Kemijski čista voda je vrlo loš vodič elektriciteta. Zbog male kompresivnosti zvučni i ultrazvučni valovi dobro se šire u vodi.
16) Svojstva vode jako se mijenjaju pod utjecajem tlaka i temperature. Dakle, s povećanjem tlaka, vrelište vode raste, a točka smrzavanja, naprotiv, smanjuje se. Kako temperatura raste, površinska napetost, gustoća i viskoznost vode se smanjuju, a električna vodljivost i brzina zvuka u vodi se povećavaju.
Anomalna svojstva vode zajedno, koja ukazuju na njezinu izuzetno visoku otpornost na vanjske čimbenike, uzrokovana su prisutnošću dodatnih sila između molekula, koje se nazivaju vodikove veze. Bit vodikove veze je da vodikov ion vezan na neki ion drugog elementa može elektrostatski privući ion istog elementa iz druge molekule. Molekula vode ima kutnu strukturu: jezgre koje ulaze u njen sastav tvore jednakokračni trokut, u čijem se dnu nalaze dva protona, a na vrhu je jezgra atoma kisika (slika 2.2).

Slika 2.2 - Struktura molekule vode
Od 10 elektrona (5 parova) prisutnih u molekuli, jedan par (unutarnji elektroni) nalazi se u blizini jezgre kisika, a od preostala 4 para elektrona (vanjski), jedan par je socijaliziran između svakog od protona i kisika. jezgre, dok 2 para ostaju nedefinirana i usmjerena su na suprotne vrhove tetraedra od protona. Dakle, u molekuli vode postoje 4 pola naboja smještena na vrhovima tetraedra: 2 negativna, nastala viškom elektronske gustoće na mjestima nepodijeljenih parova elektrona, i 2 pozitivna, nastala njezinim nedostatkom na mjesta protona.
Kao rezultat, ispada da je molekula vode električni dipol. Pozitivni pol jedne molekule vode privlači negativni pol druge molekule vode. Rezultat su nakupine (ili asocijacije molekula) od dvije, tri ili više molekula (slika 2.3).

Slika 2.3 - Formiranje pridruženih molekula vodenim dipolima:
1 - monohidrol H2O; 2-dihidrol (H2O)2; 3 - trihidrol (H 2 O) 3
Stoga su u vodi istovremeno prisutne jednostruke, dvostruke i trostruke molekule. Njihov sadržaj varira s temperaturom. Led sadrži uglavnom trihidrole, čiji je volumen veći od monohidrola i dihidrola. S porastom temperature povećava se brzina gibanja molekula, slabe privlačne sile među molekulama, a u tekućem stanju voda je mješavina tri-, di- i monohidrola. Daljnjim porastom temperature dolazi do razgradnje molekula trihidrola i dihidrola, pri temperaturi od 100 °C voda se sastoji od monohidrola (para).
Postojanje nepodijeljenih elektronskih parova određuje mogućnost stvaranja dviju vodikovih veza. Još dvije veze nastaju zbog dva atoma vodika. Kao rezultat toga, svaka molekula vode može formirati četiri vodikove veze (slika 2.4).

Slika 2.4 - Vodikove veze u molekulama vode:
– oznaka vodikove veze
Zbog prisutnosti vodikovih veza u vodi, bilježi se visok stupanj reda u rasporedu njegovih molekula, što ga približava čvrstom tijelu, au strukturi se pojavljuju brojne šupljine, čineći je vrlo labavom. Struktura leda spada u strukture najmanje gustoće. U njemu postoje šupljine, čije dimenzije nešto premašuju dimenzije molekule H 2 O. Kada se led otopi, njegova struktura se uništava. Ali čak iu tekućoj vodi očuvane su vodikove veze između molekula: pojavljuju se suradnici - embriji kristalnih formacija. U tom smislu, voda je, takoreći, u srednjem položaju između kristalnog i tekućeg stanja i sličnija je krutom nego idealnoj tekućini. Međutim, za razliku od leda, svaki suradnik postoji vrlo kratko: neprestano se odvija uništavanje jednih i stvaranje drugih agregata. U prazninama takvih "ledenih" agregata mogu se smjestiti pojedinačne molekule vode, dok pakiranje molekula vode postaje gušće. Zato kada se led topi, volumen koji zauzima voda se smanjuje, a gustoća se povećava. Na + 4 °C voda ima najgušće pakiranje.
Kada se voda zagrijava, dio topline se troši na kidanje vodikovih veza. To objašnjava visok toplinski kapacitet vode. Vodikove veze između molekula vode potpuno se uništavaju kada voda prijeđe u paru.
Složenost strukture vode posljedica je ne samo svojstava njezine molekule, već i činjenice da, zbog postojanja izotopa kisika i vodika, voda sadrži molekule različite molekulske mase (od 18 do 22). Najčešća je "obična" molekula molekulske mase 18. Sadržaj molekula velike molekulske mase je mali. Dakle, "teška voda" (molekulska težina 20) je manje od 0,02% svih rezervi vode. Ne nalazi se u atmosferi, u toni riječne vode nije više od 150 g, morske vode - 160-170 g. Međutim, njegova prisutnost daje "običnoj" vodi veću gustoću, utječe na druga svojstva.
Nevjerojatna svojstva vode omogućila su nastanak i razvoj života na Zemlji. Zahvaljujući njima, voda može imati nezamjenjivu ulogu u svim procesima koji se odvijaju u geografskoj ovojnici.
Peptidi ili kratki proteini nalaze se u mnogim namirnicama – mesu, ribi i nekim biljkama. Kada pojedemo komad mesa, protein se tijekom probave razgrađuje na kratke peptide; apsorbiraju se u želudac, tanko crijevo, ulaze u krv, stanice, zatim u DNK i reguliraju aktivnost gena.Preporučljivo je povremeno koristiti navedene lijekove za sve osobe nakon 40 godina za prevenciju 1-2 puta godišnje, nakon 50 godina - 2-3 puta godišnje. Ostali lijekovi - po potrebi.
Kako uzimati peptide
Budući da se obnavljanje funkcionalne sposobnosti stanica događa postupno i ovisi o razini njihovog postojećeg oštećenja, učinak se može pojaviti i 1-2 tjedna nakon početka uzimanja peptida i 1-2 mjeseca kasnije. Preporuča se provesti tečaj unutar 1-3 mjeseca. Važno je uzeti u obzir da tromjesečno uzimanje prirodnih peptidnih bioregulatora ima produljeni učinak, tj. djeluje u tijelu još 2-3 mjeseca. Dobiveni učinak traje šest mjeseci, a svaki sljedeći ciklus ima potencirajuće djelovanje, tj. već postignut učinak pojačanja.Budući da je svaki peptidni bioregulator usmjeren na određeni organ i ni na koji način ne utječe na druge organe i tkiva, istodobna primjena lijekova različitog djelovanja ne samo da nije kontraindicirana, već se često preporučuje (do 6-7 lijekova u jednom isto vrijeme).
Peptidi su kompatibilni sa svim lijekovima i biološkim dodacima. U pozadini uzimanja peptida, preporučljivo je postupno smanjivati doze istodobno uzetih lijekova, što će pozitivno utjecati na tijelo pacijenta.

Kratki regulatorni peptidi ne prolaze transformaciju u gastrointestinalnom traktu, tako da ih gotovo svi mogu sigurno, lako i jednostavno koristiti u kapsuliranom obliku.
Peptidi se u gastrointestinalnom traktu razgrađuju na di- i tri-peptide. Daljnja razgradnja do aminokiselina događa se u crijevima. To znači da se peptidi mogu uzimati i bez kapsule. Ovo je vrlo važno kada osoba iz nekog razloga ne može progutati kapsule. Isto vrijedi i za jako oslabljene osobe ili djecu, kada je potrebno smanjiti dozu.
Peptidni bioregulatori mogu se uzimati i profilaktički i terapijski.

Učinkovitost prirodni(PC) 2-2,5 puta niže od inkapsuliranog. Stoga bi njihovo uzimanje u ljekovite svrhe trebalo biti duže (do šest mjeseci). Tekući peptidni kompleksi nanose se na unutarnju površinu podlaktice u projekciji toka vena ili na zapešće i utrljavaju do potpunog upijanja. Nakon 7-15 minuta peptidi se vežu za dendritične stanice koje vrše njihov daljnji transport do limfnih čvorova, gdje peptidi vrše “transplantaciju” i krvotokom se šalju do željenih organa i tkiva. Iako su peptidi proteinske tvari, njihova molekularna težina je puno manja od proteina, pa lako prodiru u kožu. Prodiranje peptidnih pripravaka dodatno se pospješuje njihovom lipofilizacijom, odnosno povezivanjem s masnom bazom, zbog čega gotovo svi peptidni kompleksi za vanjsku primjenu sadrže masne kiseline.
Ne tako davno pojavila se prva serija peptidnih lijekova u svijetu za sublingvalnu upotrebu—
 Temeljno nova metoda primjene i prisutnost niza peptida u svakom od pripravaka osigurava im najbrže i najučinkovitije djelovanje. Ovaj lijek, ulazeći u sublingvalni prostor s gustom mrežom kapilara, može prodrijeti izravno u krvotok, zaobilazeći apsorpciju kroz sluznicu probavnog trakta i metaboličku primarnu deaktivaciju jetre. Uzimajući u obzir izravan ulazak u sustavnu cirkulaciju, brzina nastupa učinka je nekoliko puta veća od stope kada se lijek uzima oralno.
Temeljno nova metoda primjene i prisutnost niza peptida u svakom od pripravaka osigurava im najbrže i najučinkovitije djelovanje. Ovaj lijek, ulazeći u sublingvalni prostor s gustom mrežom kapilara, može prodrijeti izravno u krvotok, zaobilazeći apsorpciju kroz sluznicu probavnog trakta i metaboličku primarnu deaktivaciju jetre. Uzimajući u obzir izravan ulazak u sustavnu cirkulaciju, brzina nastupa učinka je nekoliko puta veća od stope kada se lijek uzima oralno.
Revilab SL linija- to su složeni sintetizirani pripravci koji sadrže 3-4 komponente vrlo kratkih lanaca (po 2-3 aminokiseline). Što se tiče koncentracije peptida, to je prosjek između inkapsuliranih peptida i PC-a u otopini. Što se tiče brzine djelovanja, zauzima vodeću poziciju, jer. apsorbira i vrlo brzo pogađa cilj.
Ima smisla uvesti ovu liniju peptida u tečaj u početnoj fazi, a zatim prijeći na prirodne peptide.
Još jedna inovativna serija je linija višekomponentnih peptidnih pripravaka. Linija uključuje 9 pripravaka, od kojih svaki sadrži niz kratkih peptida, kao i antioksidanse i građevne materijale za stanice. Idealna opcija za one koji ne vole uzimati puno lijekova, već više vole dobiti sve u jednoj kapsuli.
Djelovanje ovih bioregulatora nove generacije usmjereno je na usporavanje procesa starenja, održavanje normalne razine metaboličkih procesa, prevenciju i korekciju raznih stanja; rehabilitacija nakon teških bolesti, ozljeda i operacija.
Peptidi u kozmetologiji
Peptidi se mogu uključiti ne samo u lijekove, već iu druge proizvode. Na primjer, ruski znanstvenici razvili su izvrsnu staničnu kozmetiku s prirodnim i sintetiziranim peptidima koji utječu na duboke slojeve kože.Vanjsko starenje kože ovisi o mnogim čimbenicima: načinu života, stresu, sunčevoj svjetlosti, mehaničkim podražajima, klimatskim fluktuacijama, dijetalnim hobijima itd. S godinama koža dehidrira, gubi elastičnost, postaje gruba, a na njoj se pojavljuje mreža bora i dubokih brazda. Svi znamo da je proces prirodnog starenja prirodan i nepovratan. Nemoguće mu je odoljeti, ali se može usporiti zahvaljujući revolucionarnim sastojcima kozmetologije - peptidima niske molekularne mase.
Jedinstvenost peptida leži u činjenici da oni slobodno prolaze kroz stratum corneum u dermis do razine živih stanica i kapilara. Obnova kože ide dubinski iznutra i kao rezultat toga koža dugo zadržava svježinu. Ne postoji ovisnost o peptidnoj kozmetici – čak i ako je prestanete koristiti, koža će jednostavno fiziološki ostarjeti.
Kozmetički divovi stvaraju sve više i više "čudesnih" sredstava. S povjerenjem kupujemo, koristimo, ali čudo se ne događa. Slijepo vjerujemo natpisima na bankama, ne sluteći da je to često samo marketinški trik.
Na primjer, većina kozmetičkih tvrtki u punoj je proizvodnji i reklamira kreme protiv bora s kolagena kao glavni sastojak. U međuvremenu, znanstvenici su došli do zaključka da su molekule kolagena toliko velike da jednostavno ne mogu prodrijeti kroz kožu. Talože se na površini epidermisa, a zatim se isperu vodom. Odnosno, kupnjom krema s kolagenom doslovno bacamo novac u odvod.
Kao još jedan popularan aktivni sastojak u kozmetici protiv starenja, koristi se resveratrol. Zaista je snažan antioksidans i imunostimulans, ali samo u obliku mikroinjekcija. Ako ga utrljate u kožu, čudo se neće dogoditi. Eksperimentalno je dokazano da kreme s resveratrolom praktički ne utječu na proizvodnju kolagena.
NPCRIZ je u suradnji sa znanstvenicima Instituta za bioregulaciju i gerontologiju iz Sankt Peterburga razvio jedinstvenu peptidnu seriju stanične kozmetike (na bazi prirodnih peptida) i seriju (na bazi sintetiziranih peptida).
Temelje se na skupini peptidnih kompleksa s različitim točkama primjene koji imaju snažan i vidljiv učinak pomlađivanja kože. Kao rezultat primjene potiče se regeneracija stanica kože, prokrvljenost i mikrocirkulacija, te sinteza kolagensko-elastinskog kostura kože. Sve se to očituje u liftingu, te poboljšanju teksture, boje i vlažnosti kože.

Trenutno je razvijeno 16 vrsta krema, uklj. pomlađivanje i za problematičnu kožu (s peptidima timusa), za lice protiv bora i za tijelo protiv strija i ožiljaka (s peptidima koštanog i hrskavičnog tkiva), protiv paučastih vena (s vaskularnim peptidima), protiv celulita (s peptidima jetre) ), za kapke od edema i podočnjaka (s peptidima gušterače, krvnih žila, koštano-hrskavičnog tkiva i timusa), protiv proširenih vena (s peptidima krvnih žila i koštano-hrskavičnog tkiva) itd. Sve kreme, osim do peptidnih kompleksa, sadrže druge moćne aktivne sastojke. Važno je da kreme ne sadrže kemijske komponente (konzervansi i sl.).

Učinkovitost peptida dokazana je brojnim eksperimentalnim i kliničkim studijama. Naravno, da biste izgledali lijepo, neke kreme nisu dovoljne. Morate pomladiti svoje tijelo iznutra, koristeći s vremena na vrijeme različite komplekse peptidnih bioregulatora i mikronutrijenata.
Linija kozmetičkih proizvoda s peptidima, osim krema, uključuje i šampone, maske i balzame za kosu, dekorativnu kozmetiku, tonike, serume za kožu lica, vrata i dekoltea i dr.
Također treba imati na umu da na izgled znatno utječe i konzumirani šećer.
Kroz proces koji se zove glikacija, šećer je destruktivan za kožu. Višak šećera povećava brzinu razgradnje kolagena, što dovodi do bora.

Glikacija - interakcija šećera s proteinima, prvenstveno kolagenom, uz stvaranje poprečnih veza - prirodan je za naše tijelo, trajni ireverzibilni proces u našem tijelu i koži, koji dovodi do otvrdnjavanja vezivnog tkiva.
Proizvodi glikacije - A.G.E čestice. (Advanced Glycation Endproducts) – talože se u stanicama, akumuliraju u našem tijelu i dovode do mnogih negativnih učinaka.
Kao rezultat glikacije, koža gubi tonus i postaje bez sjaja, opuštena je i izgleda staro. To je izravno povezano sa stilom života: smanjite unos šećera i brašna (što je dobro za normalnu težinu) i njegujte kožu svaki dan!
Kako bi se suzbila glikacija, spriječila razgradnja proteina i promjene kože povezane sa starenjem, tvrtka je razvila lijek protiv starenja sa snažnim učinkom uklanjanja glikemije i antioksidansa. Djelovanje ovog proizvoda temelji se na poticanju procesa deglikacije, što utječe na dubinske procese starenja kože te pomaže u izglađivanju bora i povećanju njezine elastičnosti. Lijek uključuje snažan kompleks za borbu protiv glikacije - ekstrakt ružmarina, karnozin, taurin, astaksantin i alfa-lipoičnu kiselinu.
Peptidi - lijek za starost?
Prema kreatoru peptidnih pripravaka V. Khavinsonu, starenje uvelike ovisi o načinu života: „Nikakvi lijekovi neće spasiti ako osoba nema skup znanja i pravilno ponašanje - to je poštivanje bioritmova, pravilna prehrana, tjelesni odgoj i uzimanje određenih bioregulatora.” Što se tiče genetske predispozicije za starenje, prema njegovim riječima, o genima ovisimo samo 25 posto.Znanstvenik tvrdi da peptidni kompleksi imaju ogroman redukcijski potencijal. Ali uzdići ih u rang panaceje, pripisati nepostojeća svojstva peptidima (najvjerojatnije iz komercijalnih razloga) kategorički je pogrešno!

Brinuti se o svom zdravlju danas znači dati sebi priliku za život sutra. Mi sami moramo poboljšati svoj način života - baviti se sportom, odreći se loših navika, jesti bolje. I naravno, u mjeri u kojoj je to moguće, koristite peptidne bioregulatore koji pomažu u održavanju zdravlja i produljuju životni vijek.
Peptidni bioregulatori, koje su ruski znanstvenici razvili prije nekoliko desetljeća, postali su dostupni široj javnosti tek 2010. godine. Postupno sve više i više ljudi diljem svijeta uči o njima. Tajna očuvanja zdravlja i mladolikosti mnogih poznatih političara, umjetnika, znanstvenika leži u korištenju peptida. Ovdje su samo neki od njih:
Ministar energetike UAE Sheikh Saeed,
Predsjednik Bjelorusije Lukašenko,
Predsjednik Kazahstana Nazarbajev,
Kralj Tajlanda
Akademik Zh.I. Alferov, pilot-kozmonaut G.M. Grečko i njegova supruga L.K. Grečko,
umjetnici: V. Leontiev, E. Stepanenko i E. Petrosyan, L. Izmailov, T. Povaliy, I. Kornelyuk, I. Viner (trener ritmičke gimnastike) i mnogi, mnogi drugi...
Peptidne bioregulatore koriste sportaši 2 ruske olimpijske reprezentacije - u ritmičkoj gimnastici i veslanju. Korištenje lijekova omogućuje povećanje otpornosti naših gimnastičara na stres i pridonosi uspjesima reprezentacije na međunarodnim prvenstvima.
Ako si u mladosti možemo priuštiti zdravstvenu prevenciju povremeno, kad želimo, onda s godinama, nažalost, nemamo takav luksuz. I ako ne želiš sutra biti u takvom stanju da će tvoji najmiliji biti iscrpljeni s tobom i nestrpljivo čekati tvoju smrt, ako ne želiš umrijeti među strancima, jer se ničega ne sjećaš i sve oko vas se čini strancima zapravo, trebali biste od danas nešto poduzeti i brinuti se ne toliko o sebi koliko o svojim najmilijima.
Biblija kaže: "Tražite i naći ćete." Možda ste pronašli svoj način ozdravljenja i pomlađivanja.
Sve je u našim rukama i samo se mi sami možemo pobrinuti za sebe. Nitko to neće učiniti umjesto nas!
 |
 |
 |

|

|
 |
 |
 |
|
Uvod……………………………………………………………………….. 1. SVOJSTVA VODE……………………………………………………………… 2. DISTRIBUCIJA I STANJE VODA………………………………. 3. ULOGA VODE U PRIRODI………………………………………………………. 4. KRUŽENJE VODE U PRIRODI…………………………………………. 5. Glavni uzroci onečišćenja voda i načela postupanja s njima………………………………………….. 6. PROBLEM NEDOSTATKA SLATKE VODE……………………………. 7. Regulacija kakvoće vode………………………………………. 8. Metode pročišćavanja vode……………………………………………………… 9. Izračun otpadnih voda iz industrijskog mjesta………………….. Bibliografski popis………………………………………........ |
Uvod
Poznata su četiri staništa: tlo-zrak (atmosfera), voda (hidrosfera), tlo (edafski) i živi organizmi. Ove se smjernice odnose na onečišćenje hidrosfere.
Ove su smjernice namijenjene studentima tehničkih sveučilišta svih specijalnosti. Državni obrazovni standardi predviđaju proučavanje kolegija "Ekologija" i pitanja vezana uz zaštitu okoliša od strane studenata svih specijalnosti. Savladavanje discipline traje jedan semestar - predavanje i vježbe od 34 sata nastave. Metodološke smjernice omogućit će studentima najučinkovitije proučavanje problematike onečišćenja hidrosfere, kao i pitanja zaštite vodnih tijela.
Ekološki odgoj i rješavanje ekoloških pitanja treba prožimati proces formiranja stručnjaka bilo kojeg profila. Pritom je najvažnije da svi stručnjaci koji završe visokoškolsko obrazovanje, uz solidno pravno i praktično znanje, dobiju visok moralni naboj i sposobnost rješavanja problema zaštite prirode u odnosu na svoje stručno područje.
Intenzivan razvoj industrije, transporta, prenaseljenosti u nizu regija planete doveli su do značajnog onečišćenja hidrosfere. Prema WHO-u (Svjetska zdravstvena organizacija), oko 80% svih zaraznih bolesti u svijetu povezano je s lošom kvalitetom vode za piće i kršenjem sanitarnih i higijenskih standarda vodoopskrbe. Onečišćenje površine vodenih tijela filmovima ulja, masti, maziva sprječava izmjenu plinova između vode i atmosfere, što smanjuje zasićenost vode kisikom i negativno utječe na stanje fitoplanktona i uzrok je masovne smrti ribe i ptice.
Prema podacima UN-a, u svijetu se proizvodi do milijun proizvoda, od kojih je 100 tisuća kemijskih spojeva, uključujući 15 tisuća potencijalnih otrovnih tvari. Prema procjenama stručnjaka, do 80% svih kemijskih spojeva koji uđu u vanjski okoliš prije ili kasnije završi u izvorima vode.
Procjenjuje se da se godišnje u svijetu ispusti više od 420 km 3 otpadnih voda, što može oko 7 tisuća km 3 čiste vode učiniti neupotrebljivim.
1. Svojstva vode
Rezerve vode na Zemlji su ogromne, one tvore hidrosferu - jednu od najmoćnijih sfera našeg planeta. Hidrosfera, litosfera, atmosfera i biosfera međusobno su povezane, prožimaju se iu stalnoj su bliskoj interakciji. Sve kugle sadrže vodu. Vodni resursi sastoje se od statičkih (sekularnih) rezervi i obnovljivih resursa. Hidrosfera objedinjuje Svjetski ocean, mora, rijeke i jezera, močvare, bare, rezervoare, polarne i planinske ledenjake, podzemne vode, vlagu u tlu i atmosfersku paru.
Voda - kemijski spoj vodika i kisika (H 2 O) - tekućina bez mirisa, okusa i boje (plavičasta u debelim slojevima); s gustoćom od 1 g / cm 3 na temperaturi od 3,98 ° C. Na 0°C voda se pretvara u led, na 100°C pretvara se u paru. Molekularna težina vode je 18,0153. Prema V. I. Vernadskom, kemijski sastav vode može se prikazati formulom H 2 n O n s vrijednošću n jednakom 1-6. Nisu sve molekule vode iste: uz uobičajene molekule s masom od 18, postoje molekule s molekulskom masom od 19, 20, 21 pa čak i 22. Voda je jedinstvena tvar po svojim fizikalnim i kemijskim svojstvima. Polarnost molekula vode i prisutnost "vodikovih" veza između njih određuju njezina jedinstvena svojstva. Gustoća vode najveća je pri temperaturi od 3,98 ° C, daljnje hlađenje dovodi do njenog prijelaza u led i praćeno je smanjenjem gustoće. Smanjenje volumena umjesto širenja događa se tijekom otapanja (taljenja) leda. Hlapljivost vode je niska. Voda ima nenormalno visoku toplinu taljenja i specifični toplinski kapacitet; kad se led otopi, toplinski kapacitet se više nego udvostručuje. Toplinski kapacitet vode opada s povećanjem temperature na 27 ° C, a zatim ponovno počinje rasti. Viskoznost vode (na temperaturama od 0 do 30 °C) opada s povećanjem tlaka.
2. Rasprostranjenost i stanje vode
Voda je najzastupljenija tvar na zemlji. Nalazi se u tri faze: plinovito (vodena para), tekuće i kruto. Razlikovati atmosferske, površinske i podzemne vode.
U atmosferi se voda nalazi u parovitom stanju u zračnom omotaču koji okružuje Zemlju, u kapljevito-tekućem stanju - u oblacima, magli i u obliku kiše, u krutom stanju - u obliku snijega, tuče i ledenih kristala. visoki oblaci.
U tekućem stanju voda se nalazi u hidrosferi: voda oceana, mora, jezera, rijeka, močvara, bara i akumulacija. U čvrstom stanju voda u obliku leda i snijega nalazi se na polovima planeta, na planinskim vrhovima, a zimi prekriva velike površine vodenih tijela. Postoji kapilarna, gravitacijska, kristalizacijska voda.
Ukupna površina oceana i mora je 2,5 puta veća od površine kopna, a volumen vode na Zemlji je 1,5-109 km3. Više od 95% vode je slano. Rezerve vode i njihov omjer prikazani su u tablici 1. Svjetski ocean pokriva površinu od 361 milijuna km 2, što je 70,8% Zemljine površine. Uz prosječnu dubinu oceana od 3800 m, ukupna količina vode doseže 1370 milijuna km3. Pri proračunu resursa podzemnih voda pretpostavlja se da Zemljin plašt sadrži 0,5% vode, čiji ukupni volumen iznosi približno 13-15 milijardi km3 vode. Mogući dotok dubokih voda u zemljinu koru i na površinu planeta iznosi prosječno 1 km 3 godišnje. Uz prosječnu apsolutnu starost Zemlje od 3,5 milijardi godina, volumen površinske vode trebao bi biti oko 3,3 milijarde km 3 (Makarenko, 1966). Volumen slobodne vode u zemljinoj kori (podzemne vode) V.I. Vernadsky procijenjen na 60 milijuna km3.
Tablica 1 - Ukupne svjetske rezerve vode
|
Dijelovi hidrosfere |
Prema M. I. Lvovichu |
Prema R.K. Klige |
||
|
% po volumenu |
% po volumenu |
|||
|
Svjetski ocean | ||||
|
Podzemna voda | ||||
|
Jezera, močvare | ||||
|
vlažnost tla | ||||
|
Atmosferska vlaga | ||||
|
riječne vode | ||||
|
Cijela hidrosfera | ||||
Rusiju zapljuskuju vode 12 mora koja pripadaju trima oceanima. Na području Rusije postoji više od 2,5 milijuna velikih i malih rijeka, više od 2 milijuna jezera. Vodni resursi Rusije sastoje se od statičkih (sekularnih) i obnovljivih resursa. Prvi se smatraju relativno konstantnima dugo vremena, obnovljivi vodni resursi procjenjuju se volumenom godišnjeg protoka rijeke. Riječno otjecanje nastaje otapanjem snijega i padalinama; rijeke se napajaju močvarama i podzemnim vodama. Ukupni vodni resursi Rusije prikazani su u tablici 2.
U društveno-ekonomskom razvoju zemlje, riječno otjecanje iz površinskih slatkih voda ima prioritetno značenje. Što se tiče riječnog otjecanja, Rusija je na drugom mjestu nakon Brazila. Rijeke temelj su vodnog fonda. Gotovo 65% velikih gradova u Rusiji (Moskva, Sankt Peterburg, Nižnji Novgorod, Jekaterinburg, Perm i drugi) koristi površinske vode, uglavnom riječne, za piće i tehničke potrebe.
Tablica 2 - Ukupni vodni resursi Rusije
|
Vrste resursa |
obnovljiv, |
% ukupnih resursa |
Statički, km 3 |
% iz zajedničkih izvora |
|
riječno otjecanje | ||||
|
Podzemna voda | ||||
|
vlažnost tla | ||||
|
Više od 97 000 |
Kroz teritorij Rusije protječe više od 120 tisuća rijeka, duljine veće od 10 km i ukupne dužine preko 2,3 milijuna km. Oko 90% godišnjeg riječnog otjecanja Rusije pada na slivove Arktičkog i Tihog oceana, a samo 8% - na slivove Kaspijskog i Azovskog mora. Međutim, u bazenima ovih mora živi više od 80% stanovništva Rusije, a koncentriran je i glavni dio gospodarske infrastrukture.
U Rusiji ih ima preko 2 milijuna. slatka i slana jezera. Među njima su najdublje slatkovodno jezero Baikal i najveća zatvorena slana voda, Kaspijsko more. Glavni dio slatkovodnih resursa jezera koncentriran je u jezerima: Baikal (23 tisuće km 3, ili 20% svjetskih i 90% nacionalnih rezervi), Ladoga (903 km 3), Onjega (285 km 3), Čudsko -Pskovskoye (35,2 km 3). Najveći rezervoari u Rusiji sadrže oko 450 km 3 slatke vode.
Ledenjaci su značajan akumulator vode, koncentrirani su uglavnom u polarnim regijama: na Antarktici, na arktičkim otocima, uključujući ruski sektor Arktika, iu planinskim regijama.
Podzemna voda Zajedno s površinskim vodama rijeka, jezera i ribnjaka, one su osnova vodnog fonda Rusije i služe za piće. Prirodni resursi slatke podzemne vode iznose 787,5 km 3 /god., predviđeno pogodni za korištenje - preko 300 km 3 /god. Mineralne i ljekovite podzemne vode koriste se na 450 nalazišta od strane lječilišnih i zdravstvenih ustanova, kao i postrojenja za punjenje mineralnih ljekovitih voda. Potencijalni resursi mineralne vode procjenjuju se na 800 tisuća m 3 /dan. Toplina i energija (toplinska, mješavina pare i vode s temperaturom od 40 do 200 ° S ) podzemne vode se koriste za opskrbu toplinom i proizvodnju električne energije. Njihovi značajni resursi (više od 7081,5 milijuna m 3 /dan) koncentrirani su na Sjevernom Kavkazu i Dalekom istoku. Resursi industrijskih podzemnih voda iznose više od 4 milijuna m 3 /dan (hidromineralne sirovine). Izvor su joda, broma i niza drugih rijetkih elemenata i metala. Velika nalazišta industrijskih podzemnih voda nalaze se u Krasnodarskom teritoriju, na Uralu iu zapadnom Sibiru.
Voda je prozirna tekućina, bezbojna (u malom volumenu) i bez mirisa. Voda je ključna u nastanku i održavanju života na Zemlji, u kemijskoj strukturi živih organizama, u formiranju klime i vremena. U čvrstom stanju naziva se led ili snijeg, a u plinovitom vodena para. Oko 71% Zemljine površine prekriveno je vodom (oceani, mora, jezera, rijeke, led na polovima).
Svojstva vode su kombinacija fizikalnih, kemijskih, biokemijskih, organoleptičkih, fizikalno-kemijskih i drugih svojstava vode.
Voda - vodikov oksid - jedna je od najčešćih i najvažnijih tvari. Površina Zemlje koju zauzima voda je 2,5 puta veća od površine kopna. U prirodi nema čiste vode - ona uvijek sadrži nečistoće. Destilacijom se dobiva čista voda. Destilirana voda naziva se destilirana. Sastav vode (maseni): 11,19% vodika i 88,81% kisika.
Čista voda je bistra, bez mirisa i okusa. Ima najveću gustoću na 0 ° C (1 g / cm 3). Gustoća leda je manja od gustoće tekuće vode, pa led pluta na površini. Voda se smrzava na 0°C, a vrije na 100°C pri tlaku od 101 325 Pa. Loš je vodič topline i vrlo loš vodič elektriciteta. Voda je dobro otapalo. Molekula vode ima kutni oblik, atomi vodika tvore kut od 104,5° u odnosu na kisik. Prema tome, molekula vode je dipol: pozitivno je nabijen onaj dio molekule gdje se nalazi vodik, a negativno je nabijen onaj dio gdje se nalazi kisik. Zbog polariteta molekula vode, elektroliti u njoj disociraju na ione.
U tekućoj vodi, uz obične molekule H20, postoje i pridružene molekule, tj. spojene u složenije agregate (H2O)x zbog stvaranja vodikovih veza. Prisutnost vodikovih veza između molekula vode objašnjava anomalije njegovih fizičkih svojstava: maksimalnu gustoću na 4 ° C, visoko vrelište (u seriji H20-H2S - H2Se) anomalično visok toplinski kapacitet. Kako temperatura raste, vodikove veze pucaju, a do potpunog prekida dolazi kada se voda pretvori u paru.
Voda je vrlo reaktivna tvar. U normalnim uvjetima stupa u interakciju s mnogim bazičnim i kiselim oksidima, kao i s alkalijskim i zemnoalkalijskim metalima. Voda stvara brojne spojeve - kristalne hidrate.
Očito, spojevi koji vežu vodu mogu poslužiti kao sredstva za sušenje. Ostala sredstva za sušenje uključuju P205, CaO, BaO, metalni Ma (oni također kemijski stupaju u interakciju s vodom) i silikagel. Važno kemijsko svojstvo vode je njezina sposobnost stupanja u reakcije hidrolitičke razgradnje.
Kemijska svojstva vode određena su njezinim sastavom. Voda se sastoji od 88,81% kisika i samo 11,19% vodika. Kao što smo gore spomenuli, voda se smrzava na nula Celzijevih stupnjeva, ali ključa na sto. Destilirana voda ima vrlo nisku koncentraciju pozitivno nabijenih hidronijevih iona HO i H3O+ (samo 0,1 µmol/l), pa se može nazvati izvrsnim izolatorom. Međutim, svojstva vode u prirodi ne bi se ispravno ostvarila da ona nije dobro otapalo. Molekula vode je vrlo male veličine. Kada druga tvar uđe u vodu, njezini pozitivni ioni privučeni su atomima kisika koji čine molekulu vode, a negativni ioni privučeni su atomima vodika. Voda, takoreći, sa svih strana okružuje kemijske elemente otopljene u njoj. Stoga voda gotovo uvijek sadrži različite tvari, posebno metalne soli, koje osiguravaju provođenje električne struje.
Fizička svojstva vode "podarila" su nam fenomene poput efekta staklenika i mikrovalne pećnice. Oko 60% efekta staklenika stvara vodena para koja savršeno apsorbira infracrvene zrake. U ovom slučaju optički indeks loma vode n=1,33. Osim toga, voda također apsorbira mikrovalove zbog visokog dipolnog momenta svojih molekula. Ova svojstva vode u prirodi potaknula su znanstvenike na razmišljanje o izumu mikrovalne pećnice.
Uloga vode u prirodi i ljudskom životu nemjerljivo je velika. Možemo reći da se sva živa bića sastoje od vode i organskih tvari. Aktivna je sudionica u formiranju fizičkog i kemijskog okoliša, klime i vremena. Istodobno utječe i na gospodarstvo, industriju, poljoprivredu, promet i energetiku.
Bez hrane možemo živjeti nekoliko tjedana, ali bez vode - samo 2-3 dana. Da bi osigurao normalan život, osoba mora unijeti u tijelo oko 2 puta više vode po težini nego hranjivih tvari. Gubitak više od 10% vode u ljudskom tijelu može dovesti do smrti. U prosjeku tijelo biljaka i životinja sadrži više od 50% vode, u tijelu meduze do 96%, u algama 95-99%, u sporama i sjemenkama od 7 do 15%. Tlo sadrži najmanje 20% vode, dok ljudsko tijelo sadrži oko 65% vode. Različiti dijelovi ljudskog tijela sadrže nejednaku količinu vode: staklasto tijelo oka sastoji se od 99% vode, 83% je sadržano u krvi, 29% u masnom tkivu, 22% u kosturu, a čak 0,2% % u zubnoj caklini. Tijekom života čovjek gubi vodu iz tijela, a bioenergetski potencijal opada. U ljudskom embriju starom šest tjedana sadržaj vode je do 97%, u novorođenčetu - 80%, u odrasloj osobi - 60-70%, au tijelu starije osobe - samo 50-60%.
Voda je apsolutno neophodna za sve ključne sustave održavanja ljudskog života. Voda i tvari sadržane u njoj postaju prehrambeni medij i opskrbljuju žive organizme mikroelementima potrebnim za život. Sadrži ga krv (79%) i potiče prijenos tisuća esencijalnih tvari i elemenata kroz krvožilni sustav u otopljenom stanju (geokemijski sastav vode blizak je sastavu krvi životinja i ljudi.).
U limfi, koja vrši razmjenu tvari između krvi i tkiva živog organizma, voda je 98%.
Voda, više od drugih tekućina, pokazuje svojstva univerzalnog otapala. Nakon određenog vremena može otopiti gotovo svaku čvrstu tvar.
Ovako sveobuhvatna uloga vode posljedica je njezinih jedinstvenih svojstava.
Nedavno su napori istraživača usmjereni na ubrzano proučavanje procesa koji se odvijaju na granici faza. Pokazalo se da voda u graničnim slojevima ima mnoga zanimljiva svojstva koja se ne pojavljuju u masovnoj fazi. Ove informacije su neophodne za rješavanje niza važnih praktičnih problema. Primjer je stvaranje temeljno nove elementarne baze mikroelektronike, gdje će se daljnja minijaturizacija sklopova temeljiti na principu samoorganizacije makromolekula na površini vode. Razvijena površina karakteristična je i za biološke sustave, zbog važnosti površinskih pojava za njihovo funkcioniranje. Gotovo uvijek prisutnost vode ima značajan utjecaj na prirodu procesa koji se odvijaju u području blizu površine. S druge strane, pod utjecajem površine, svojstva same vode radikalno se mijenjaju, a voda u blizini granice mora se smatrati temeljno novim fizičkim objektom proučavanja. Vrlo je vjerojatno da će proučavanje molekularno-statističkih svojstava vode blizu površine, koje, u biti, tek počinje, omogućiti učinkovito upravljanje mnogim fizikalnim i kemijskim procesima.
Nedavno je povećan interes za proučavanje svojstava vode na mikroskopskoj razini. Dakle, da bismo razumjeli mnoge aspekte fizike površinskih pojava, potrebno je poznavati svojstva vode na granici faza. Nedostatak strogih ideja o strukturi vode, o organizaciji vode na molekularnoj razini dovodi do činjenice da se pri proučavanju svojstava vodenih otopina u masovnoj fazi iu kapilarnim sustavima voda često smatra medijem bez strukture. . Međutim, poznato je da se svojstva vode u graničnim slojevima mogu znatno razlikovati od onih u masi. Stoga, uzimajući u obzir vodu kao tekućinu bez strukture, gubimo jedinstvene informacije o svojstvima graničnih slojeva, koji, kako se pokazalo, uvelike određuju prirodu procesa koji se odvijaju u tankim porama. Na primjer, ionska selektivnost celuloznih acetatnih membrana objašnjava se posebnom molekularnom organizacijom vode u porama, što se posebno odražava u konceptu "neotapajućeg volumena". Daljnji razvoj teorije koja uzima u obzir specifičnosti intermolekulskih interakcija koje su u osnovi selektivnog membranskog transporta pridonijet će potpunijem razumijevanju membranske desalinizacije otopina. To će omogućiti davanje dobrih preporuka za poboljšanje učinkovitosti procesa desalinizacije vode. To implicira važnost i nužnost proučavanja svojstava tekućina u graničnim slojevima, posebice u blizini površine čvrstog tijela.
 Društvene igre koje je postavila Melissa & Doug u dobi od 2 godine
Društvene igre koje je postavila Melissa & Doug u dobi od 2 godine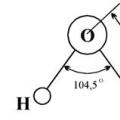 Fizikalna svojstva vode
Fizikalna svojstva vode Kako vam optimizam pomaže u postizanju vaših ciljeva
Kako vam optimizam pomaže u postizanju vaših ciljeva