A geometriai izomerizmus jellemző. A sztereokémia alapjai
A lecke során általános elképzelést kap az izomeria típusairól, megtudhatja, mi az izomer. Ismerje meg az izomeria típusát szerves kémiai: szerkezeti és térbeli (sztereoizomeria). A rendszer segítségével a szerkezeti képletét anyagok, úgy a alfaja a szerkezeti izoméria (csontváz és izoméria rendelkezések), megismerhetik a fajta térbeli izoméria: geometriai és optikai.
Téma: Bevezetés szerves kémia
Lecke: izomeria. Az izomeria típusai. Szerkezeti izomerizmus, geometriai, optikai
1. Mi az isomeria
A típusú képleteket leírt általunk korábban leírja szerves anyagok azt mutatják, hogy több különböző szerkezeti képletek megfelelnek az egy molekuláris képlete.
Például molekuláris formula C2.H6.O. megfelel két anyag Különböző szerkezeti formulákkal - etil-alkohollal és dimetil-éterrel. Ábra. egy.
Az etil-alkohol olyan folyadék, amely hidrogéntartással metál-nátriummal reagál, + 78,50 ° C-on. Ugyanolyan körülmények között a dimetil-éter olyan gáz, amely nem reagál a nátriummal, -230 ° C-on.
Ezek az anyagok különböznek a szerkezetükben - a különböző anyagok ugyanazon molekuláris formulanak felelnek meg.
Ábra. 1. Interclív izomeria
A megjelenése a létezését anyagok azonos összetételű, de eltérő szerkezetű, ezért különböző tulajdonságokkal nevezik isomeria (a görög szó „Izos” - „egyenlő” és a „Meros” - „rész”, „share”).
Az izomeria típusai
Vannak különböző típusú izomeria.
2. Interclív izomeria
A szerkezeti izomerizmus a molekulában lévő atomok különböző rendeléseihez kapcsolódik.
Etanol és dimetil-éter - szerkezeti izomerek. Mivel a szerves vegyületek különböző osztályaihoz kapcsolódnak, az ilyen típusú szerkezeti izomerizmust hívják az interclass is. Ábra. egy.
3. Mermermy a szén vázának
A szerkezeti izomerek is a vegyületek egy osztályában is lehetnek, például a C5H12 képlet három különböző szénhidrogéneknek felel meg. azt izomeriusz szén váz. Ábra. 2.

Ábra. 2 példák az anyagokra - szerkezeti izomerek
4. A helyzet izomerizációja
Vannak szerkezeti izomerek az ugyanazon szénvázhoz, amelyek kitűnnek a helyzetét többszörös kötések (kettős és hármas) vagy atomok helyettesítő hidrogénatom. Az ilyen típusú szerkezeti izomerizmust hívják isomerius.
Ábra. 3. Szerkezeti izomerizmus
5. térbeli izomeria
A molekulák, amelyek csak egyszeres kötést, szobahőmérsékleten, majdnem teljesen szabadon forognak a fragmentumok a molekula körüli kötések lehetséges, és például, az összes képet, 1,2-diklór-etán képletek egyenértékűek. Ábra. négy

Ábra. 4. A klóratomok helyzete egyetlen kapcsolat körül
Ha a forgatás nehéz, például ciklikus molekulában vagy kettős kötéssel, akkor ez bekövetkezik geometriai vagy cisz-trance izomeria.A cisz-izomereknél a szubsztituensek a ciklus egyik oldalán vagy kettős kötés síkján, transz-izomerekben - különböző irányokban.
A CIS-TRANS izomerek léteznek abban az esetben, ha egy szénatom társul két különböző Helyettes. Ábra. öt.



Ábra. 5. CIS - és TRAN-izomerek
6. Optikai izomeria
Egy másik típusú izomerizmus felmerül annak a ténynek köszönhetően, hogy a négy egyetlen kapcsolattal rendelkező szénatom térbeli struktúrát képez, a tetraéder. Ha egy molekula legalább egy szénatomot tartalmaz, amely négy különböző szubsztituenssel jár, merül fel optikai izomeria. Az ilyen molekulák nem egyeznek meg a tükörképével. Ezt a tulajdonságot Chiralitynek nevezik - a görög shier - "Hand" -től. Ábra. 6. Az optikai izomerizmus számos olyan molekulára jellemző, amely az élő szervezetek részét képezi.
|
|
|
Ábra. 6. Példák az optikai izomerekre
Az optikai izomeriát is hívják enantiomeria (a görög enantios - "ellentétes" és a meros - "rész") és az optikai izomerek - enantiomerek. Az enantiomerek optikailag aktívak, ugyanolyan szögben forognak a fény polarizációjának síkját, de az ellenkező oldalon: d-, vagy (+) - izomer, - jobb, l-, vagy (-) - izomer, - maradt. Az enantiomerek, az úgynevezett racemát, optikailag feltüntetett, a szimbólum jelzi d, L- vagy (±).
A lecke összegzése
A lecke során általános ötletet kaptál az izomeria típusáról, amely izomer. Megtanultak az izomeria típusát szerves kémiai: szerkezeti és térbeli (sztereoizomeria). A rendszer segítségével a szerkezeti képletét anyagok, alfaj a strukturális izoméria (csontváz és az izomerizációs rendelkezések) tekintették, ismerik a fajta a térbeli izomériát: geometriai és optikai.
Referenciák listája
1. Rudzitis G. E. Kémia. Az általános kémia alapjai. 10. osztály: Általános oktatási intézmények tankönyve: Alapszint / G. E. Rudzitis, F. G. Feldman. - 14. kiadás. - M.: Megvilágosodás, 2012.
2. Kémia. 10-es fokozat. Profilszint: Tanulmányok. Általános oktatásra. Intézmények / V. V. Eremin, N. E. Kuzmenko, V. V. Luniin és mások. - M.: Drop, 2008. - 463 p.
3. Kémia. 11. fokozat. Profilszint: Tanulmányok. Általános oktatásra. Intézmények / V. V. Eremin, N. E. KUZMENKO, V. V. LUNIN et al. - M.: Drop, 2010. - 462 p.
4. Homchenko G. P., Homchenko I. G. Gyűjtemény feladatok kémiából, hogy a kérelmezők egyetemeken. - 4. ed. - M.: RIA "új hullám": Publisers kiadója, 2012. - 278 p.
1. Interneturok. Ruha.
2. Szerves kémia.
Házi feladat
1. № 1.2 (39. o.) Rudzitis G. E. Kémia. Az általános kémia alapjai. 10. osztály: Általános oktatási intézmények tankönyve: Alapszint / G. E. Rudzitis, F. G. Feldman. - 14. kiadás. - M.: Megvilágosodás, 2012.
2. Miért van az izomerek száma szénhidrogénben egy olyan etilén szénhidrogénben, mint az extrém szénhidrogének?
3. Milyen szénhidrogéneknek van térbeli izomerjei?
Biztosítsa az anyagot szimulátorokkal
Simulator 1 Simulator 2 Simulator 3

 I. Isomeria (görögülől. ISOS - egyenlő) Britzer, 1830. Az izomerek olyan anyagok, amelyek ugyanolyan molekuláris képletűek (azonos minőségi és mennyiségi összetétel), de különböznek a kötő atomok szekvenciájában és (vagy) helyet és különböző tulajdonságokkal rendelkeznek.
I. Isomeria (görögülől. ISOS - egyenlő) Britzer, 1830. Az izomerek olyan anyagok, amelyek ugyanolyan molekuláris képletűek (azonos minőségi és mennyiségi összetétel), de különböznek a kötő atomok szekvenciájában és (vagy) helyet és különböző tulajdonságokkal rendelkeznek.
 Berzelius (Berzelius), Jonx Jacob 1779 - 1848. A híres svéd kémikus. 1807-től az orvostudományi professzor és a gyógyszertár Stockholmban.
Berzelius (Berzelius), Jonx Jacob 1779 - 1848. A híres svéd kémikus. 1807-től az orvostudományi professzor és a gyógyszertár Stockholmban.
 C 2H 6O dimetil-éter TKIP \u003d -24 etil-alkohollal TKIP \u003d 78 n-bután TKIP \u003d -0, 5 C 4H 10 izobután TKIP \u003d -11, 7 s
C 2H 6O dimetil-éter TKIP \u003d -24 etil-alkohollal TKIP \u003d 78 n-bután TKIP \u003d -0, 5 C 4H 10 izobután TKIP \u003d -11, 7 s
 Az izomerek száma az alkanánok sorában Név Formula Név Az izomerek képletének száma Izomerek száma CH 4 metán 1 C 11H 24 UndeCan 159 C 2H6 etán 1 C 12H 26 DodeAn 355 C 3H 8 propán 1 C 13 óra 28 TRIDEKAN 802 C 4H 10 bután 2 C 14H 30 Tetradecan 1 858 C 5H 12 pentán 3 C 15H 32 Pentadecan 4 347 C 6H 14 hexán 5 C 20H 42 EKOAN C 7H 16 heptán 9 C 25H 52 Pentacoosan 36 797 588 C 8H 18 oktán 18 C 30H 62 TRIAKONTAN 4 111 846 763 C 9H 20 NONAN 35 C 40H 82 TETRACOTAN 62 491 178 805 831 C 10H 22 Dean 75 366 319
Az izomerek száma az alkanánok sorában Név Formula Név Az izomerek képletének száma Izomerek száma CH 4 metán 1 C 11H 24 UndeCan 159 C 2H6 etán 1 C 12H 26 DodeAn 355 C 3H 8 propán 1 C 13 óra 28 TRIDEKAN 802 C 4H 10 bután 2 C 14H 30 Tetradecan 1 858 C 5H 12 pentán 3 C 15H 32 Pentadecan 4 347 C 6H 14 hexán 5 C 20H 42 EKOAN C 7H 16 heptán 9 C 25H 52 Pentacoosan 36 797 588 C 8H 18 oktán 18 C 30H 62 TRIAKONTAN 4 111 846 763 C 9H 20 NONAN 35 C 40H 82 TETRACOTAN 62 491 178 805 831 C 10H 22 Dean 75 366 319
 II. Az azonos típusú szerkezetű szerves vegyületek csoportjának homológiája ugyanazokkal a funkcionális csoportokkal, amelyek különböznek egymástól a 2-es csoportok számával - a szénláncban, homológ sorozat. A metán homológiai sora
II. Az azonos típusú szerkezetű szerves vegyületek csoportjának homológiája ugyanazokkal a funkcionális csoportokkal, amelyek különböznek egymástól a 2-es csoportok számával - a szénláncban, homológ sorozat. A metán homológiai sora
 III. Az izológiai rangok. LL Ezek ugyanolyan szénatomból épített anyagok sorai, amelyek ugyanolyan szénatomból vannak kialakítva, de különböznek az atomok mennyiségi összetételében, azaz a sor következő tagja 2 atomdal kevesebb, mint az előző: C 2H6 etán C 2n 4 etilén C 2H2-acetilén
III. Az izológiai rangok. LL Ezek ugyanolyan szénatomból épített anyagok sorai, amelyek ugyanolyan szénatomból vannak kialakítva, de különböznek az atomok mennyiségi összetételében, azaz a sor következő tagja 2 atomdal kevesebb, mint az előző: C 2H6 etán C 2n 4 etilén C 2H2-acetilén






 Strukturális isomeria 3. Tautomeria (prototróp vagy dinamikus Isomerius) Tautomeri I (görögből. Ταύτίς ugyanaz és έέρος - intézkedés) - a jelenség egymás mellett a két izomer formája található ingó egyensúly és képes spontán egymást keresztező.
Strukturális isomeria 3. Tautomeria (prototróp vagy dinamikus Isomerius) Tautomeri I (görögből. Ταύτίς ugyanaz és έέρος - intézkedés) - a jelenség egymás mellett a két izomer formája található ingó egyensúly és képes spontán egymást keresztező.







Src \u003d "https://present5.com/presentation/73124296_273676330/image-22.jpg" alt \u003d "(! Lang: konformáció\u003e C ------- konformáció\u003e C -------
 Geometriai izoméria geometriai izomerek - azonos sorrendben (szekvenciája) a kötések a molekulában, de különböznek a helyét az atomok (csoportok) viszonyított térben a kettős kötés vagy a kis ciklus síkban.
Geometriai izoméria geometriai izomerek - azonos sorrendben (szekvenciája) a kötések a molekulában, de különböznek a helyét az atomok (csoportok) viszonyított térben a kettős kötés vagy a kis ciklus síkban.
Src \u003d "https://present5.com/presentation/73124296_273676330/image-24.jpg" alt \u003d "(! Lang: Cisz- és transz-izomerek a Bouthena-2 minden atomban\u003e c \u003d c cis és transz izomerek bootena -2 minden atomra\u003e c \u003d c
 "Su és a másik oldalán a Lite Tsisletania - az osztrák korona földének neve; piros; 1867-1918 Transrastion - a magyar korona földének neve; Zölden látható
"Su és a másik oldalán a Lite Tsisletania - az osztrák korona földének neve; piros; 1867-1918 Transrastion - a magyar korona földének neve; Zölden látható




 E, Z-Nómenklatúra 2 1 E-1 -NTRO-1 -BROM-2-klóropentén 1 2 Z-1 -NTRO-1 -BROM-2 -Hlorpenten 1. A Kan-Ingold-csupasz szabályai alapján határozza meg a relatív Senioritás mondatok, amelyek kettős kötéssel vannak összekötve, és adják nekik számokat az 1. vagy 2. időtartamra.
E, Z-Nómenklatúra 2 1 E-1 -NTRO-1 -BROM-2-klóropentén 1 2 Z-1 -NTRO-1 -BROM-2 -Hlorpenten 1. A Kan-Ingold-csupasz szabályai alapján határozza meg a relatív Senioritás mondatok, amelyek kettős kötéssel vannak összekötve, és adják nekik számokat az 1. vagy 2. időtartamra.
 a) A nagy atomszámú atom egy kisebb számú idősebb atom. b) Ha két atom izotóp, az előnynek egy nagy tömegszámú atomja van. 2. Ha a két legmagasabb rangú csoport található az egyik oldalon a π-kommunikációs síkban, a konfiguráció a szubsztituensek jelzi a Z szimbólum. A német entgegen éppen ellenkezőleg)
a) A nagy atomszámú atom egy kisebb számú idősebb atom. b) Ha két atom izotóp, az előnynek egy nagy tömegszámú atomja van. 2. Ha a két legmagasabb rangú csoport található az egyik oldalon a π-kommunikációs síkban, a konfiguráció a szubsztituensek jelzi a Z szimbólum. A német entgegen éppen ellenkezőleg)



 Louis Pasteur (Louis Pasteur) (Louis Pasteur) (27. 12. 1822 -28. 1895. 09. 1895) A francia kémikus, a legnagyobb felfedező XIX. Század "aszimmetria olyan, amely megkülönbözteti az ökológiai világot egy szervetlenből" (ez a törvény a sztereokémiai kezdetét jelezte). Az aszimmetrikus kristályok forgó polarizált fényt tartalmaznak.
Louis Pasteur (Louis Pasteur) (Louis Pasteur) (27. 12. 1822 -28. 1895. 09. 1895) A francia kémikus, a legnagyobb felfedező XIX. Század "aszimmetria olyan, amely megkülönbözteti az ökológiai világot egy szervetlenből" (ez a törvény a sztereokémiai kezdetét jelezte). Az aszimmetrikus kristályok forgó polarizált fényt tartalmaznak.
 Enantiomerek - térbeli izomerek, amelyek molekulái közé tartoznak az objektum és az inkompatibilis tükörkép. (görögül. Enantios - az ellenkezője).
Enantiomerek - térbeli izomerek, amelyek molekulái közé tartoznak az objektum és az inkompatibilis tükörkép. (görögül. Enantios - az ellenkezője).
 Chirality (ENG. CRIRALITALITER, Görögországból. Chérir - Kéz), a kémia koncepciója, amely jellemzi az objektum tulajdonát, hogy inkompatibilis legyen a tökéletes lapos tükör kijelzőjével.
Chirality (ENG. CRIRALITALITER, Görögországból. Chérir - Kéz), a kémia koncepciója, amely jellemzi az objektum tulajdonát, hogy inkompatibilis legyen a tökéletes lapos tükör kijelzőjével.






 Fisher (Fischer) Emil Herman (9. 10. 1852, Eiskrhen, - 15. 7. 1919, Berlin), Német vegyész és biokémista.
Fisher (Fischer) Emil Herman (9. 10. 1852, Eiskrhen, - 15. 7. 1919, Berlin), Német vegyész és biokémista.


 Fisher vetületei átalakíthatók: L L 1. A szubsztituensek átrendeződésének egyértelmű száma nem változtatja meg a képletet; 2. A szubsztituensek átrendeződésének páratlan száma az antipode (enantiomer) képletéhez vezet; 3. Tilos a képletet 90 vagy 270-re fordítani, valamint a képlet eltávolítását ebből a síkból (ezek az intézkedések az antipode-képlethez vezetnek); 4. Megengedett, hogy a teljes képletet a rajz síkban 180 ° C-on forgassa;
Fisher vetületei átalakíthatók: L L 1. A szubsztituensek átrendeződésének egyértelmű száma nem változtatja meg a képletet; 2. A szubsztituensek átrendeződésének páratlan száma az antipode (enantiomer) képletéhez vezet; 3. Tilos a képletet 90 vagy 270-re fordítani, valamint a képlet eltávolítását ebből a síkból (ezek az intézkedések az antipode-képlethez vezetnek); 4. Megengedett, hogy a teljes képletet a rajz síkban 180 ° C-on forgassa;
 Az 1906-os relatív konfiguráció, az M. A. Rozanova L- és D-izomerek javaslata alapján (latin szavak Laevus - bal és dexter - jobbra).
Az 1906-os relatív konfiguráció, az M. A. Rozanova L- és D-izomerek javaslata alapján (latin szavak Laevus - bal és dexter - jobbra).



 CAN-INGOLD PRAVOGA rendszer? Robert Sidney Kan Ingold Christopher Prelog Vladimir (9. 06. 1899 -15. 09. 1981) (1981) (28. 1893- 8. 10. 1970) (23. 07. 1906- 07. 1998) (Egyesült Királyság) (Svájc)
CAN-INGOLD PRAVOGA rendszer? Robert Sidney Kan Ingold Christopher Prelog Vladimir (9. 06. 1899 -15. 09. 1981) (1981) (28. 1893- 8. 10. 1970) (23. 07. 1906- 07. 1998) (Egyesült Királyság) (Svájc)



 Az optikai izomerek teljes számát az N \u003d 2 N, N számú királis központok száma határozza meg. Iii iv 2 -mino-3-hidroxi-extentánsav
Az optikai izomerek teljes számát az N \u003d 2 N, N számú királis központok száma határozza meg. Iii iv 2 -mino-3-hidroxi-extentánsav
 Borsav I III iii IV ERYTO TREOT EPIMERS - diasztereomerek, amelyek csak egy aszimmetrikus központ konfigurációjával jellemezhetők
Borsav I III iii IV ERYTO TREOT EPIMERS - diasztereomerek, amelyek csak egy aszimmetrikus központ konfigurációjával jellemezhetők

 Racemus (latin Racemus-szőlőből). Ha összekeverjük a ekvimoláris mennyiségű D - és L - sztereoizomer, optikailag inaktív nyert keverékek a neve racém s (lat. Sinister - bal) és R (lat. Rectus - jobb); A Racewate-t az RS szimbólum jelöli. Racém keverékek felosztása: 1. Mechanikai módszer (Pasteur módszer). 2. Mikrobiológiai módszer 3. Enzimatikus módszer. 4. Kémiai módszer. Athenium-kromatográfia
Racemus (latin Racemus-szőlőből). Ha összekeverjük a ekvimoláris mennyiségű D - és L - sztereoizomer, optikailag inaktív nyert keverékek a neve racém s (lat. Sinister - bal) és R (lat. Rectus - jobb); A Racewate-t az RS szimbólum jelöli. Racém keverékek felosztása: 1. Mechanikai módszer (Pasteur módszer). 2. Mikrobiológiai módszer 3. Enzimatikus módszer. 4. Kémiai módszer. Athenium-kromatográfia
 A sztereokémiai struktúra viszonya a biológiai aktivitás megnyilvánulásával. Adrenalin, Epinefrine Jouple: 1 - (3, 4-digidroxifenil) -2 metil-amino-etanol - mongo agyi hormon a mellékvese állatok és az emberek. A mediátor idegrendszer hidegvérű. Az adrenalin két enantiomerje, a legnagyobb farmakológiai aktivitás r (-) adrenalint mutat.
A sztereokémiai struktúra viszonya a biológiai aktivitás megnyilvánulásával. Adrenalin, Epinefrine Jouple: 1 - (3, 4-digidroxifenil) -2 metil-amino-etanol - mongo agyi hormon a mellékvese állatok és az emberek. A mediátor idegrendszer hidegvérű. Az adrenalin két enantiomerje, a legnagyobb farmakológiai aktivitás r (-) adrenalint mutat.

 A sztereokémiai struktúra viszonya a biológiai aktivitás megnyilvánulásával. A megtorlásos izopropialaterenalin (Izadrin) 800-szor erősebb bezártási hatást mutat, mint az enantiomer elhagyása.
A sztereokémiai struktúra viszonya a biológiai aktivitás megnyilvánulásával. A megtorlásos izopropialaterenalin (Izadrin) 800-szor erősebb bezártási hatást mutat, mint az enantiomer elhagyása.

 Diasztereomerek - A térbeli izomerek, amelyek molekulái nem tartoznak egymáshoz, mint objektum, és egy inkompatibilis tükörkép.
Diasztereomerek - A térbeli izomerek, amelyek molekulái nem tartoznak egymáshoz, mint objektum, és egy inkompatibilis tükörkép.

 Konformációs izoméria konformációs izoméria eredményeként keletkezik a különböző helyeken az alkatrészek az ugyanazon molekula egymáshoz képest, érjük el, ha ezek a részek körül forgatják egy egyszerű C-re kommunikációs két atomot összekötő.
Konformációs izoméria konformációs izoméria eredményeként keletkezik a különböző helyeken az alkatrészek az ugyanazon molekula egymáshoz képest, érjük el, ha ezek a részek körül forgatják egy egyszerű C-re kommunikációs két atomot összekötő.
 (Lat. Konformációból - formanyomtatvány, helyszín), a molekulák különböző térbeli formái az egyes fragmensek szabad forgásának eredményeként egyszerű C-C-Connections körül.
(Lat. Konformációból - formanyomtatvány, helyszín), a molekulák különböző térbeli formái az egyes fragmensek szabad forgásának eredményeként egyszerű C-C-Connections körül.







 69% 31% van der Waalso feszültség - a Repulision erőknek köszönhetően a Valenlyally Unlocked nagy szubsztituensek között.
69% 31% van der Waalso feszültség - a Repulision erőknek köszönhetően a Valenlyally Unlocked nagy szubsztituensek között.
Isomeria ligandumok
Isomeria ligandumoka kötésre oszlik (amelyet ugyanazon ligandum különböző koordinációja határoz meg), és valójában a ligandum isomerizmus.
Példák a csatlakoztatott izoméria lehet a létezését nitro- és nitrit komplexek kobalt (III) összetétele K 3 és K 3, amelyeknél a koordináció a ligandum NO 2 végezzük, illetve egy nitrogénatomon keresztül kapcsolódnak, vagy egy oxigénatom. Egy másik példa a koordináció a NCS tiocianát-ion - egy nitrogénatomon keresztül kapcsolódnak, vagy egy kénatomon keresztül kapcsolódik, a formáció tiocianáto-n- vagy thiocianate-S-komplexek.
Ezenkívül a komplex szerkezet (például aminosavak) ligandusa önmagukban az izomereket alkotja, amelyek koordinációja ugyanazon összetételű komplexek kialakulásához vezet különböző tulajdonságokkal.
Geometriai izomeria a belső térben a ligandok egyenlőtlen elhelyezése okozza egymást. A geometriai izomerizmus előfeltétele legalább két különböző ligandum a belső koordinációs szférában. A geometriai izomerizmus túlnyomórészt komplex vegyületekben mutatkozik be, amelynek oktahedrális szerkezete, egy lapos négyzet vagy négyzet alakú piramis szerkezete.
Komplex vegyületek tetraéderes, háromszög alakú és lineáris szerkezet geometriai izomerek nem rendelkezik, mivel a helyét a ligandumok a két különböző faj körül a központi atom egyenértékű.
A lapos tér szerkezetével rendelkező komplexek két különböző ligandum jelenlétében L 'és L' 'már két izomerrel (cisz és transz-) lehetnek:
A cisz- és transz-izomereknek megfelelő komplex vegyület példája diklóraminplatin (II):
Megjegyezzük, hogy a komplex vegyület vegyületet egy sík, négyzet alakú szerkezetet nem lehet izomerek: helyzetének L „ligandum” egyformán minden sarkában a tér. Ha két különböző ligandum jelenik meg, két izomer létezése (cisz és transz-) különbözik a tulajdonságokban. Így cisz-dichlorodamminplain (II) narancssárga-sárga kristályok, jól oldódik vízben, és a transz-dichlorodaminplain (II) - halványsárga kristályok, az oldhatósága, amely vízben valamivel alacsonyabb, mint a cisz-izomer.
A belső szférában lévő különböző ligandumok számának növekedésével növekszik a geometriai izomerek száma. A klorid nitro (hidroxil-amin) amin (piridin) Platinum (II) CL kapta mind a három izomert:
Az oktahedral komplexek sok izomerrel rendelkeznek. Ha a komplex kapcsolatban ilyen jellegű, mind a hat ligandumok azonos (), vagy különböznek minden más egy (), a lehetőséget a különböző helyeken a ligandumok egymáshoz képest, hiányzik. Például az oktahedrális vegyületekben az L "ligand" ligandum pozíciója az öt ligandum többi részével kapcsolatban egyenértékű, ezért az izomerek nem lehetnek itt:
Kinézet kettő ligand l '' in oktahedrikusa komplex vegyületek a létezés lehetőségéhez vezetnek két geometriai izomer. Ebben az esetben a ligandok ligandumok helyének két különböző módja jelenik meg egymáshoz képest. Például a dihidroxotraimminlalty (III) + kation (III) + két izomerrel rendelkezik:
Amikor próbál találni egy másik kölcsönös helyét 3N és OH ligandumok -, ami eltér a fenti, akkor mindig jön a szerkezet egyik a már megadott.
A különböző kémiai összetételű ligandumok számának növekedésével a geometriai izomerek száma gyorsan növekszik. A típusú vegyület lesz négy izomer, és a típusú vegyületek, amelyek hat különböző ligandumok, száma geometriai izomerek eléri 15. Az ilyen komplex vegyületek még kevésbé vizsgálták.
A geometriai izomerek szignifikánsan különböznek a fizikai-kémiai tulajdonságokban, például a szín, az oldhatóság, a sűrűség, a kristályszerkezet stb.
1. Szerkezeti izomeria.
2. Konformációs izomeria.
3. Geometriai izomeria.
4. Optikai izomeria.
Izomerek - Ezek olyan anyagok, amelyek ugyanolyan összetételűek és molekulatömegűek, de különböző fizikai és kémiai tulajdonságok. Az izomerek tulajdonságainak különbségei a kémiai vagy térszerkezetük közötti különbségek miatt következnek be. E tekintetben kétféle izomeria megkülönbözteti.
isomeria
szerkezeti
térbeli
Szénváz
Konfiguráció
Konformációs
Funkcionális helyzet
Optikai
Intenzív
Geometriai
1. Szerkezeti izomeria
A szerkezeti izomereket kémiai szerkezet jellemzi, vagyis A molekulában lévő atomok közötti kapcsolatok jellege és sorrendje. A szerkezeti izomerek tiszta formában vannak kiemelve. Ők léteznek egyéni, stabil anyagok, kölcsönös átalakulásukért, nagy energiát igényelnek - körülbelül 350 - 400 kJ / mol. A dinamikus egyensúlyban csak szerkezeti izomerek - tautomerek. A tautomeria közös jelenség a szerves kémia területén. Lehetőség van egy mozgó hidrogénatomot a molekulában (karbonilvegyületek, aminok, heterociklusok stb.), Intramolekuláris kölcsönhatások (szénhidrátok).
Minden szerkezeti izomer strukturális képletek formájában jelenik meg, és a zsidó nómenklatúráját nevezik. Például a 4H8 O-vel ellátott készítmény megfelel a szerkezeti izomereknek:
de) különböző szénvázakkal
fáradt C-lánc - CH 3 -CH 2 -CH 2 -CH \u003d O (Boutanal, Aldehid) és
elágazó C-lánc -
 (2-metilpoopanal, aldehid) vagy
(2-metilpoopanal, aldehid) vagy
ciklus -  (ciklobutanol, ciklikus alkohol);
(ciklobutanol, ciklikus alkohol);
b) A funkcionális csoport különböző pozíciói
 butanon-2, keton;
butanon-2, keton;
nál nél) A funkcionális csoport különböző összetételével
 3-Bentol-2, nem szándékos alkohol;
3-Bentol-2, nem szándékos alkohol;
d) Uralom
A funkcionális csoport heteroatom is szerepelhet a szén vázában (ciklus vagy áramkör). Az ilyen típusú izomerizmus egyik lehetséges izomerje - CH 3 -O-CH 2-CH \u003d CH 2 (3-metoxi-propen-1, egyszerű éter);
e) Tautomeria (keto-enol)
ealny forma  ketoform
ketoform
A tautomerek dinamikus egyensúlyban vannak, míg a keverékben egy stabilabb forma uralja - ketoformák.
Az aromás vegyületek esetében a szerkezeti izomerizmust csak az oldalláncra tekintik.
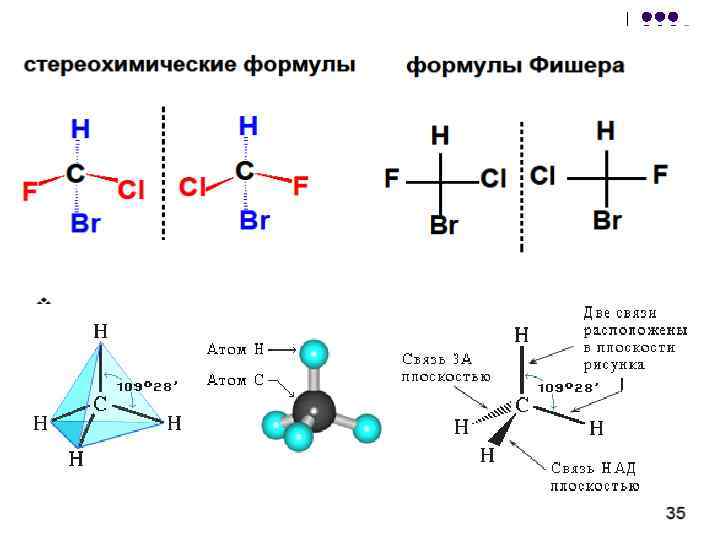
2. térbeli izomeria (sztereoizomeria)
A térbeli izomerek ugyanolyan kémiai szerkezettel rendelkeznek, különböznek a molekulában lévő atomok térbeli elhelyezkedésében. Ez a különbség, és különbséget tesz a fizikai és kémiai tulajdonságokban. A térbeli izomereket különböző előrejelzések vagy sztereokémiai képletek formájában ábrázolják. A szakasz a kémia, amely tanulmányozza a térbeli szerkezete és hatása a fizikai és kémiai tulajdonságai vegyületek, a irányát és sebességét a reakciók, az úgynevezett sztereokémiájú.
de)Konformációs (forgó) izomeria
A változó vagy a valentált szögek nélkül, nincs linkhossz, elképzelheted a molekulák több geometriai formáját (konformációit), amelyek különböznek egymástól, a szén-tetrahederek kölcsönös forgása az σ-C-C-C-C-kommunikáció körül. Ennek a forgatásnak köszönhetően forgó izomerek merülnek fel (konformers). A nem Etinakov különböző kontrollerei energiája, de a különböző konformációs izomereket elválasztó energiabezéret a legtöbb szerves vegyület esetében kicsi. Ezért a normál körülmények között általában a molekulákat nem lehet rögzíteni egy szigorúan meghatározott konformációban. Jellemzően számos könnyen mozgatható konformációs izomer van az egyensúlyban.
A képmódok és az izomerek tartománya az etán molekula példáján tekinthető. Számára lehetséges, hogy két, a konformáció energiájánál előfordulhat, amely a perspektív előrejelzések (1) ("fűrészmunka") vagy előrejelzések Új ember(2):

gátolt konformáció megfigyelt konformáció
Egy ígéretes előrejelzésben (1) az S-C közötti kapcsolatot a kimenő távolságnak kell benyújtania; A bal szénatomon állva a megfigyelő közelében, a jobb oldalon állva - eltávolították tőle.
A Newman (2) kialakításában a molekulát a C-S csatlakozás mentén tekintjük. A kör közepétől 120 o szögben három vonal eltér, amely a megfigyelőhöz legközelebb eső szénatom linkjei; Vonalak, "szerető" a kör miatt - a távoli szénatom csatlakoztatása.
A konformációt jobbra hívják bájos . Ez a név emlékeztet arra, hogy mindkét CH3-csoport hidrogénatomjai egymással szemben vannak. A megfigyelt konformáció növelte a belső energiát, ezért veszteséges. A bal oldalon látható konformációt hívják gátolt , azt jelenti, hogy a szabad forgás a kommunikáció körül C-with "márkák" ebben a helyzetben, azaz. A molekula főként ebben a konformációban létezik.
A molekula teljes körű forgatásához szükséges energia legalább egy bizonyos kapcsolat körüli forgási akadályt hívják fel. Az akadály forgás a molekulában, hasonló a etán, ki lehet fejezni a változás a potenciális energia a molekula függvényében változik a diéderes (torziós - τ) szög a rendszer. Az energia profilja körüli forgás a kommunikációs C-C etán az 1. ábrán bemutatott A forgási választva a két formája etán körülbelül 3 kcal / mol (12,6 kJ / mól). A potenciális energia görbe minimuma megfelel a gátolt konformációnak, a maxima-sütőnek. Mivel szobahőmérsékleten, az energia bizonyos ütközések molekulák képes elérni a 20 kcal / mol (körülbelül 80 kJ / mol), ezt az akadályt a 12,6 kJ / mól könnyen legyőzi és forgás etán minősül szabad. Az összes lehetséges konformáció keverékében a gátolt konformációt uralják.

1. ábra. Az etán megfelelő energiájának diagramja.
A bonyolultabb molekulák esetében a lehetséges konformációk száma nő. Így n.-Butan, amely már hatalmazhat, hogy a központi kapcsolás körüli 2 - 3-as, és különbözik a CH3 csoport kölcsönös elrendezésében. A bután különböző megfigyelt és gátolt konformációja az energiában eltérő. Energetikusan jövedelmezőbb gátolt konformáció.

Az energia profilja körüli forgás kommunikációs C 2-C 3 Bhután van a 2. ábrán látható.

2. ábra. A H-Bhutánnak megfelelő energiájának diagramja.
A hosszú szén-szén-dioxid-szén-dioxid-molekulához a konformációs formák száma növekszik.
Az aliciklusos vegyületmolekulához a ciklus különböző konformációs formáit jellemzik (például ciklohexán esetében fotel, fürdőkád, csavar- formák).
Tehát a konformáció egy bizonyos konfigurációjú molekula különböző térbeli formái. A konformer sztereoizomer szerkezetek, amelyek megfelelnek energia minimum a potenciális energia diagram található ingó egyensúly és képes kölcsönös szórakozás körül forog egyszerű σ-kötések.
Ha az ilyen transzformációk akadályai eléggé válnak, akkor a sztereoizomer formák oszthatók (példa optikailag aktív difenilcsoport). Ilyen esetekben még nem beszélnek a konformerzőkről, hanem a ténylegesen meglévő sztereoizomerekről.
b) Geometriai izomeria
A geometriai izomerek a molekula hiánya miatt következnek be:
1. A szénatomok elforgatása egymáshoz képest - a kettős kötés merevségének következménye \u003d C vagy ciklikus szerkezet;
2. Két azonos csoport kettős kötéssel vagy ciklusú szénatommal.
A geometriai izomerek, a konformerrel ellentétben tiszta formában izolálhatók, és egyedi, stabil anyagokként létezhetnek. A kölcsönös átalakulásukért nagyobb energia szükséges - körülbelül 125-170 kJ / mol (30-40 kcal / mol).
Megkülönbözteti a cisz-transz- (z, e) izomereket; cisz az űrlapokat geometriai izomereknek nevezik, amelyekben ugyanazok a szubsztituensek az egyik oldalon fekszenek az π kommunikációs vagy ciklus síkból, trance- az űrlapokat geometriai izomereknek nevezik, amelyekben ugyanazok a szubsztituensek a π kommunikációs vagy ciklus sík különböző irányai mentén fekszenek.
A legegyszerűbb példa a bouthen-2 izomerek, amelyek a cisz-, transz-geometriai izomerek formájában léteznek:


cisz-butén-2 transz-butén-2
olvadási hőmérséklet
138.9 0 C - 105,6 0 s
forráshőmérséklet
3.72 0 C 1.00 0 C
sűrűség
1,2 - diklór-klór-propán van a cisz-, transz-izomerek formájában:


cisz-1,2-diklór-klór-propin transz-1,2-diklór-klór-qlopropán
Összetettebb esetekben alkalmazott Z., E-nómenklatúra (Cannes-nómenklatúra, Ingold, Pravoga - KIP, a szubsztituensek mondatainak nómenklatúrája). Összefüggésben
1-BROM-2-metil-1-klór-butén-1 (BR) (CI) C \u003d C (CH3) - CH 2 -CH3 Minden szubsztituens kettős kötésű szénatomokkal különböző; Ezért ez a vegyület Z-, E-geometriai izomerek formájában létezik:


E-1-BROM-2-metil-1-klór-butén-1 Z-1-bróm-2-metil-1-klór-butén-1.
Az izomer konfigurációjának kijelöléséhez jelezze a helyszín a vezető szubsztituensek kettős kapcsolás (vagy ciklusban) - Z- (a német zusammen - együtt), vagy E- (a német Entgegen - éppen ellenkezőleg).
Z-ben a vének e-rendszere nagy szekvencia (Atomic) számú szubsztituensek. Ha a telítetlen szénatomokhoz közvetlenül kapcsolódó atomok megegyeznek, akkor szükség esetén menj a "második rétegre", szükség esetén a "harmadik rétegre", és így tovább.
Az első vetítésben a vezető csoportok egymással ellentétesek a kettős kötéshez képest, ezért ez egy e-izomer. A második vetítésben a vezető csoportok az egyik oldalon helyezkednek el a kettős kötéshez képest (együtt), ezért Z-izomer.
A geometriai izomerek széles körben elterjedtek a természetben. Például, a természetes gumi polimerek (cisz-izomer) és a guttapercha (transz-izomer), a természetes fumarone (transz-boatenic sav) és szintetikus malein (cisz-hajó sav) savat, részeként zsír - olein, linolsav, linolénsav.
nál nél) Optikai izomeria
A szerves vegyületek molekulái lehetnek királis és ahral. Sorabilitás (görögtől. Sheir - kéz) - A molekula összeférhetetlensége tükör visszaverődésével.
A királis anyagok forgathatják a fény polarizációjának síkját. Ezt a jelenséget optikai aktivitásnak és a megfelelő anyagoknak nevezik - optikailag aktív. Az optikailag aktív anyagok gőz formájában találhatók optikai antipódok - Az izomereket, a fizikai és kémiai tulajdonságai, amelyek normál körülmények azonosak, kivéve az egyik - a forgatás előjelétől polarizációs síkját: az egyik az optikai antipódokra visszapattan polarizációs síkját jobbra (+, a degradáló izomer ), a másik - bal (-, bal oldali). Határozza meg az optikai antipódok konfigurációját kísérletileg a műszerrel - polariméterrel.
Az optikai izomeria akkor jelenik meg, ha molekula van aszimmetrikus szénatom(A molekula kiralitásának más okai vannak). Ezt az SP3-hibridizációban szénatomnak nevezik és négy különböző szubsztituenssel társítják. Az aszimmetrikus atom körüli szubsztituensek két tetraéderes helye lehetséges. Ugyanakkor két térbeli forma nem kombinálható bármilyen rotációval; Az egyik a másik tükörképe:

Mindkét tükörforma egy pár optikai antipódot alkot, vagy enantiomerek .
Kép optikai izomerek az E. Fisher vetítési képlet formájában. Ezeket a molekulát egy aszimmetrikus szénatommal végzett vetítés eredményeként kapják meg. Ugyanakkor a síkban lévő aszimmetrikus szénatomot egy pont jelöli, a vízszintes vonal jelzi a szubsztituensek szimbólumait a minta síkja előtt kiálló szimbólumai. A függőleges vonal (szakaszos vagy szilárd) jelzi a szubsztituenseket, amelyek eltávolítják a minta síkját. Az alábbiakban különböző módok lehetnek egy vetítési képlet írására, amely megfelel az előző ábrán a bal oldali modellnek:

A vetületben a fő szénlánc függőlegesen ábrázolódik; A fő funkció, ha a lánc végén van, jelezze a vetítés tetejét. Például sztereokémiai és vetítőanyag (+) és (-) alanin - CH 3 - * CH (NN 2) -on a következők:

Az enantiomerek azonos tartalmú keverékét racemátnak nevezik. A racemát nem rendelkezik optikai aktivitással, és az enantiomereken kívüli fizikai tulajdonságok jellemzik.
A vetítési képletek átalakítására vonatkozó szabályok.
1. A formulák 180 o-os rajz síkjában forgathatók, anélkül, hogy megváltoztatnák sztereokémiai jelentését:

2. Két (vagy bármilyen egyenletes szám) az egyik aszimmetrikus atom szubsztituenseinek átrendeződése nem változtatja meg a képlet sztereokémiai jelentését:

3. Egy (vagy bármilyen páratlan szám) Az aszimmetrikus középpontban lévő szubsztituensek átrendeződése az optikai antipód képletéhez vezet:

4. A 90 o rajzsíkban bekapcsolja a képletet antipode-ba.
5. A három szubsztituens forgása az óramutató járásával megegyező irányban vagy ellen, nem változtatja meg a képlet sztereokémiai jelentését:
 6. A vetítési képletek nem adhatók ki a rajz síkból.
6. A vetítési képletek nem adhatók ki a rajz síkból.
Az optikai aktivitás szerves vegyületekkel rendelkezik, amelynek molekulái királis centrumok más atomok, például szilícium, foszfor, nitrogén, kén.
A több aszimmetrikus szénatommal rendelkező vegyületek léteznek diasztereomerek . A térbeli izomerek, amelyek nem állítanak össze egymással optikai antipódokkal.
A diasztereomerek nemcsak optikai forgástól eltérnek egymástól, hanem minden más fizikai konstans is: különböző olvadáspontú és forráspontú pontok, különböző oldhatóság stb.
A térbeli izomerek számát az N \u003d 2 N izomer, ahol n az aszimmetrikus szénatomok száma. A sztereoizomerek száma csökkenhet bizonyos struktúrákban megjelenő részleges szimmetria miatt. Optikailag inaktív diasztereomerek hívás Meso-Formok.
Az optikai izomerek nómenklatúrája:
a) D-, L-nómenklatúra
Ahhoz, hogy meghatározzuk a D-vagy L-sorban olyan izomert tartalmaz, a konfiguráció (a helyzet az OH-csoport egy aszimmetrikus szénatom) összehasonlítjuk a konfigurációk az enantiomerek a glicerin-aldehid (glicerin kulcs):

L-glicerin aldehid d-glicerin aldehid
A D-, L-Nómenklatúra alkalmazása jelenleg három optikailag aktív anyagot tartalmaz: szénhidrátok, aminosavak és oxisavak.
b) R -, S-Nómenklatúra (kana nómenklatúrája, Ingold és Pravoga)
Annak meghatározására, R (jobb) - vagy S (bal) -konfigurációjú optikai izomer, szükséges, hogy helyezze a szubsztituensek a tetraéder (B sztereokémiái képletű) körül aszimmetrikus szénatom, oly módon, hogy a legfiatalabb szubsztituens (rendszerint hidrogénatom) van az iránya "a megfigyelőtől". Ha a három fennmaradó képviselők átmenete az idősebbekig a középső és a fiatalabb a szenioritás az óramutató járásával megegyező irányban fordul elő, akkor ez egy R-izomer (a szenioritás csökkenése egybeesik a kéz mozgásával, amikor az r betű felső része ). Ha az átmenet az óramutató járásával ellentétes irányba fordul - ez S - izomer (a szenioritás csökkenése egybeesik a kéz mozgásának mozgásával, amikor az s betűk felső részét írja.
Az optikai izomer R- vagy S-konfigurációjának meghatározásához a vetületi képletben a szubsztituenseket a legkisebb permutációkkal kell elhelyezni, hogy a legfiatalabb, hogy a vetület alján legyenek. A fennmaradó három szubsztituens időtartamának csökkenése az óramutató járásával megegyező irányban megfelel az R konfigurációnak, az óramutató járásával ellentétes irányba.
Az optikai izomereket a következő módszerekkel kapjuk meg:
a) izolálása tartalmazó természetes anyagok optikailag aktív vegyületek, mint például a fehérjék és aminosavak, szénhidrátok, sok oxi savak (bor, alma, mandula), terpén-szénhidrogének, terpén-alkoholok és ketonok, szteroidok, alkaloidok, stb
b) a racemátok felosztása;
c) aszimmetrikus szintézis;
d) optikailag aktív anyagok biokémiai termelése.
TUDOD, AZT
Az izomerizmus jelensége (görögtől. ÉN.sOS. - Különböző I. meros. - részvény, rész) nyitott 1823-ban. Y. Libik és F. Völ a két szervetlen sav sói példáján: Cyanova N-O-S≡N és a csörgő N-O-N \u003d S.
1830-ban J. Deuma kiterjesztette az izomerizmus eszméjét szerves vegyületekre.
1831-ben Az "izomer" kifejezés a szerves vegyületekhez Y. Berzelius.
A természetes vegyületek sztereoizomerjeit különböző biológiai aktivitás jellemzi (aminosavak, szénhidrátok, alkaloidok, hormonok, feromonok, természetes eredetű gyógyszerek stb.).
A geometriai izomerek a cisz-transz-izomerizmus vagy az izomerizmus EZ. Műveleteik a kettős vagy egy szén-dioxid-kötés korlátozott forgatásán alapulnak ciklikus vegyületekben. A ciklikus vegyületben a szénetlen kötés közötti forgás korlátozott, és a két különböző csoport mindegyik szén-izomerizmushoz hasonlóan van. Az ilyen geometriai izomerek gyakran különböznek fizikai tulajdonságaikban. Ez az izomerek és a közös dipólus pillanatának köszönhető. Ha a legmagasabb prioritású két atom az izomer ugyanazon oldalán marad, akkor Z-nek nevezik, és ha az ellenkező oldalon vannak - E.
Isomeria rövid története
Az alkotmányos izomerizmus fogalma jelentős előrelépés a modern kémia történetében, különösen a szerves kémia kialakulásában. Az 1700-as évek végére számos tiszta anyagot izoláltunk az "Állat" és "növény" kémia tanulmányozásával. Sokakat Karl Wilhelm Shelelele (1742-1786) szerezte meg. A szerves vegyületek nagyobb sokféleségének köszönhetően minden új anyag egy másik elemi összetételt képviselt, amely megfelelt az ásványi kémia általánosított megfigyelésével. Az izolált szerves vegyületek mennyisége az 1800-as évek elején nőtt, különböző anyagok azonosításával.
A Kémia történelméről szóló könyvében Thomas Thomson 1830-ban írta:
Britzelius alkalmazott elmélet az atomok is, hogy a növényvilágban, elemezve több növényi savak, és bemutatja az atomi alkotmány, de van egy nehézség, hogy a jelenlegi ismereteinkre, nem tudjuk legyőzni. Két sav van, amelyek pontosan ugyanazok az atomokból állnak. Most, hogyan kell figyelembe venni ezt a feltűnő különbséget a tulajdonságokban? Kétségtelenül, különböző módon, ahol mindegyik atomok találhatóak.
Ezután Thomson használt különböző diagramokból atomi használt szimbólumok egy időben, hogy miért két sav egy és ugyanazon elemi összetétele vonatkozó geometriai izomerek eltérő fizikai és kémiai tulajdonságokat.
A XIX. Század elejéig úgy vélték, hogy ezek az élő szervezetekben található vegyi anyagok különleges életciklussal rendelkeznek az élő lényekkel kapcsolatban, és hogy szükség van az élő rendszerekre a reprodukcióra. 1828-ban, Veller szintetizált a karbamid mintát, (NH2) 2CO (szintén CH4N2O), amely nem volt megkülönböztethető a karbamid izolált biológiai vizeletben.
Ezt az "állati" anyagot elkészítette az ammónium-cianát (NH4) NCO (szintén CH4N2O) kifejezetten szervetlen (ásványtani) forrásából, amely az ammónium-klorid és ezüst-cianát egyesítésének eredménye. Így az "él" és az "élettelen" izomeria közötti akadályt összeomlik.
A cisz-izomerben két hasonló csoport marad a kettős kötés egyik oldalán, és a transz-izomerben az ellenkező oldalon maradnak. Például a 2-butén két izomerje van a cisz és a trance.
A cisz-izomerben két metilcsoport és két hidrogéncsoport a kettős kötés ugyanazon oldalán marad, míg a transz-izomerben az ellenkező oldalon maradnak.
Ha egy vagy több kettős kötéssel járó csoport nem azonos, akkor az izomereket E vagy Z-nek nevezzük. Az ilyen típusú értesítésre a felhasználónak meg kell jelölnie a geometriai izomerekkel rendelkező szénhidrogének képleteit, és meghatározza az atomot a legmagasabb prioritással (a legmagasabb atomszám), amelyek mindegyik kettős kötéshez kapcsolódnak C. Ha két, legmagasabb prioritású atom marad az izomer ugyanazon oldalán, amelyet Z, és ha az ellenkező oldalon vannak, akkor e .

Például 1 - bróm - 1 - fluoropropánnal rendelkezik két izomerrel. A Z-1-brómban - 1-fluor-propánban látható, hogy a brómnak nagyobb prioritású vagy magasabb atomszám (35) van, mint a fluor (9), amelyek C-1-hez kapcsolódnak. A szén magasabb atomszám (6), mint a hidrogén (1), amely a vegyület C-2-jéhez kapcsolódik. Mivel a legmagasabb prioritású szénatomok (a Group-CH3-ból) és a két szénatomhoz kapcsolódó brómok egyik oldalán vannak, ez a vegyület Z. Min. A legmagasabb a C és a bróm prioritás az ellenkező oldalon, ezért e-izomernek nevezik.
Szén-szén kettős kapcsolat
Az izomerek két molekula, amelyek ugyanolyan atomkészítményt tartalmaznak, de nem azonosak. Atomok két izomer kapcsolatban lehet más sorrendben (a szerkezeti izoméria), vagy kapcsolatban lehet azonos módon, de van egy másik orientáció - térbeli stereoisomeria.
Szerkezeti és geometriai izomer speciális esetekben - sztereoizomer, meg kell felelnie a két követelménynek:
- A molekulában korlátozott forgás van.
- A korlátozó kommunikációban részt vevő atomok két különböző funkcionális csoportot tartalmaznak nekik.
A korlátozott forgás egy szén-szén kettős kapcsolat. Ezek a hivatkozások közé tartozik a PI-kapcsolat, a legtöbb esetben nem nyereséges.

A geometriai izomerek olyan struktúrával rendelkeznek, amely befolyásolja a kapcsolat fizikai tulajdonságait.
Cisz / transz rendszer
A CIS / TRANS elnevezés a vegyületek legegyszerűbb rendszere. Először is, a molekulában a leghosszabb szénláncot azonosítják, majd azonosítják a funkcionális kamatcsoportokat. A cisz-izomerben a két vizsgált csoport a kettős kötés egyik oldalán van (a cisz "ugyanazon az oldalon" a latinul). A transz-izomerben a vizsgált két csoport a kettős kötés ellentétes oldalán található (trance eszközök a latin nyelven). Például két különböző geometriai izome bouthen-2.

Mindkét kettős kötés atomnak ugyanolyan két csoportja van, mint a két csoport, de egymástól különböznek egymástól a kettős szén egyikén. A feladat bonyolult, mivel az oldalláncok és a funkcionális csoportok összetettebbé válnak.
A hivatalos IUPAC elnevezési rendszerben az E / Z kijelölést használják. A CIS / TRANS és E / Z között nincs konkrét kapcsolat, és ez a két rendszer nem cserélhető. Az E / Z-kijelölés a CAHN-INGOLD-PRESSOG-szabályokat használja, és megbízhatóbbnak tartják. A név IUPAC for fumársav egy transz-izomer a HO2CCH \u003d CHCO2H képletű, és a maleinsav sav cisz-buldic sav.

Az IUPAC egy tiszta és alkalmazott kémiai nemzetközi szakszervezet, amely nemzetközi szabályokat és szabványokat hoz létre a vegyi anyagok kijelölésére minden nyelven.
A ciklikus kapcsolatban a szén egyszeres kötés közötti forgás korlátozott. Így az ilyen típusú vegyületek esetében az izomeria is lehetséges, ha két különböző csoport csatlakozik minden egyes szénhez. Két izomer 1,2-dimetil-ciklopropán van.

Az egyikük egy cisz-izomer, ahol két metilcsoport van az egyik oldalon, a másik pedig transz-izomer, ahol két metilcsoport van a másik oldalon.
A geometriai izomerek fizikai tulajdonságaikban különböznek. Ez az izomerek és a közös dipólus pillanatának köszönhető. Például a forrásponton eltérőek. Az 1,2-diklór-etilén CIS és transz-izomerek forráspontja 60,3 ° C és 47,5 ° C.
A cisz-izomerben két dipóljel (C-CL) jelenléte egy közös molekuláris dipólot ad. Ez az intermolekuláris dipól-dipol erőkhöz vezet. Ehhez az erő esetében a cisz-izomer nagyobb forrásponttal rendelkezik, mint a transz-izomer, ahol két dipól kötés (C-CL) van törölve az ellenkező irányba való pozíciójuk miatt.
A szén-szén kettős kötés nem forgatható, hogy két kötés van összekötő szénatomot együtt, és meg kell szakítani a PI-kapcsolatot. A PI kommunikáció oldalirányú átfedéssel van kialakítva a p-orbitálok között. Ha megpróbálja a szén-szén kettős kötést megfordítani, a P-orbitalt már nem építik be a vonalba, ezért a PI-kapcsolat megszakad. Energiát töltenek rá, és ez csak akkor történik, ha a kapcsolatot erősen melegítik.
Nagyon könnyű kihagyni a geometriai izomerek fontos elemeit a strukturális képletek felépítése során. Például nagyon csábító, hogy felhívja, de-2-ene. Ha a felhasználó rosszul írja, a kapcsolat már nem lesz izomer. Ha legalább a legkisebb tipp, hogy egy izomer alkalmazható, mindig szükséges a szén-szén kettős kötéseket tartalmazó vegyületek használata, amelyek a kommunikáció végén a megfelelő szögeket (120 °) a megfelelő szögeket (120 °) tartalmazzák. Más szóval, az ábrán látható formátumot kell használni.

A szén-szén kettős kötést tartalmazó vegyületek korlátozott forgás. Az izomerek megszerzéséhez kötelező feltételeket kell teljesíteni:
- korlátozott forgás, általában, beleértve a szén-szén kettős kommunikációt;
- két különböző csoport a kommunikáció bal oldalán és két különböző csoport a jobb oldalon.
Nem számít, hogy a bal csoportok egybeesnek-e a joggal vagy sem.
Az alkének geometriai izomerjei számos olyan vegyületet tartalmaznak, amelyek C és H atomokból állnak a szénláncban. Ez a csoport homológ sorozat CNH2N formulával rendelkezik. A legegyszerűbb alkén-eten, két atom és a C2H4 képlet.

Az eten szerkezeti képletét a fenti ábrán mutatjuk be. A hosszabb alkén láncokban további szénatomok vannak egymáshoz kapcsolódó kovalens kötésekkel. Mindegyik szénatom is elegendő hidrogénatomhoz van csatlakoztatva, hogy összesen négy egy kovalens kötést kapjunk.
Négy és több Atom láncokban a kettős kötés különböző pozíciókban helyezhető el, ami strukturális izomerek kialakulásához vezet. Az alkének szerkezeti izomerjein kívül a sztereoizomerek is formosak. Mivel a többszörös kötés körüli forgatás korlátozott, a kettős kötésű atomokhoz kapcsolódó csoportok mindig ugyanabban a relatív pozíciókban maradnak.
Ezek a "blokkolt" pozíciók lehetővé teszik a vegyészek azonosítása különböző izomereket a szubsztituensekből annak meghatározása érdekében, hogy melyik anyag geometriai izomerjei vannak. Például egy C5H10 szerkezeti izomernek van a következő sztereoizomerjei.

A bal oldalon lévő izomert, amelyben két szubsztituens (metil- és etilcsoport) a kettős kötés egyik oldalán található, cisz-izomernek nevezzük, míg a két nem hidraulikus szubsztituenssel ellentétes oldalakon lévő izomer egy transz -izomer.
Például a klór elsőbbsége van, mert nehezebb. A jobb oldalon a bróm jobb a szén. Harmadszor, a két magasabb rangú atom rendelkezéseit határozzák meg. Ha két atom van a cisz-helyzetben, a Z helyszín (a német zusammenből, ami "együtt"). Ha az atomok vagy csoportok transzpozícióban vannak, az E hely (a német entergéntől, ami "ellentétes").
A geometriai izomerek Butene egy merev kettős kötésű alkén. Ez azt jelenti, hogy valójában négy izomer van, nem három, a kettős csatlakozási helyzetben. Van egy ötödik és hatodik szénhidrogén ugyanazon összetételű, de ezek nem alkének, annak ellenére, hogy ugyanezen képlet.

A ciklobután vagy a metil-ciklopropán gyűrűképződése két hidrogénatom térét kettős kötésként foglalja el, ami azt a tényt eredményezi, hogy a különböző roothenesekkel azonos formulákkal rendelkeznek.
Geometriai izomerek Példák:
- 1-butilén (1-butén);
- izo-butilén (2-metil-propén);
- cisz-2-butilén (CIS-2-butén);
- transz-2-butilén (transz-2-butén).
És bónuszokat: ciklobután és metil-ciklopropán - mindkettő ugyanazon tapasztalati képlet, mint a Boothness izomerek, de nem alkének. Az első név egy "közös" vagy "triviális" név, és a zárójelben lévő név az iupac név.
A hajlított sok alkalmazással rendelkezik az autó üzemanyagtól az élelmiszerboltokhoz, amelyek naponta több száz millió lakosát a bolygón. Kémiai képlet a BUTCHE: C4H8, ami azt jelenti, hogy négy atomot tartalmaz, és nyolc atomot tartalmaz, a vegyület alkénre vonatkozik.
Számos különböző izomer vagy molekuláris szerkezet áll rendelkezésre, amelyek ezt a vegyületet képezhetik (az IUPAC címek zárójelben vannak feltüntetve):
- alfa-butilén (de-1-ene);
- cisz-béta-butilén - ((2z) -but-2-ene);
- transz-béta-butilén - ((2e) -but-2-ene);
- izobutilén (2-metilprop-1-ene).

Bár mindegyiknek ugyanaz a képlete van, a struktúrák eltérnek. Az egyes geometriai izomerek közötti kapcsolat elsősorban alkotmányos, ami azt jelenti, hogy ugyanolyan molekuláris formula, de különböző kötések. A kivétel a cisz-béta-butilén és a transz-béta-butilén.
Sokan tudják, hogy a transz-zsírok ártalmasak az emberekre, és a telítetlen zsírok hasznosak neki. Az egyetlen különbség e két zsír között van, hogy van egy transzkommunikáció, és a másiknak van egy CIS-kötvénye, mindazonáltal ez a kis differenciálódás jelentősen befolyásolhatja a molekula funkcióját.
A cisz-béta-butilénnel és transz-béta-butilénnel az atomok egy sorrendben vannak, de a polaritások eltérőek. A cisz-izomer poláris, és mindkét CH3 csoport egyik oldalon van. Ez tényleg nehézkes és összetett. Taptrans-izomer nem poláris, a CH3 térfogatcsoportok, amelyek több helyet biztosítanak a molekulában. Ezt az arányt cisz-transz izomeria nevezik. A Ciss-izomerek polárisak, míg a transz-izomerek nem így vannak.
Annak ellenére, hogy a Bouthen ezen izomerek mindegyike ugyanazon anyagokból áll, amelyeknek különböző fizikai tulajdonságai vannak. Például egy forráspont:
- CIS-béta-butilén: 3,7 ° C.
- Transz-béta-butilén: 0,8 ° C.
- Izobutilén: -6,9 ° C.
- Alpha-butilén: -6,3 ° C.
A műanyagok előállítására szolgáló anyag
A buthenesek négy szénatommal rendelkező alkének, C4H8. A booten különböző szerkezeti vagy konfigurációs izomerjei vannak, beleértve a geometriai és optikai izomereket is. Mind a négy butchem hasonló fizikai tulajdonságokkal rendelkezik, a színtelen gázok, a vízben, jól oldódnak a levegőben és az alkánokon. A fizikai tulajdonságok közötti különbségeket a molekulák szerkezete magyarázza. Például a cisz-de-2-en magasabb forrásponttal rendelkezik, mint a transz-de-2-en, mert ez egy erősebb dipólus.

A cisz-izomer két alkilcsoportja az + I hatással egy irányban működik, és ezáltal növeli, míg a transz-izomerek két alkilcsoportja ellentétes irányban működik, és ezáltal gyengíti egymást. A geometriai izomerekkel rendelkező szénhidrogének formulái jelzik az IUPAC szabványokat. De-1-HU van egy alacsony olvadáspontú, mivel a CC egy egyszeres kémiai kötés a második és a harmadik szénatom szabad forgását, és az etil-csoport körül forognak a forgástengely minden irányban.
Ez megnehezíti a molekulát szilárd kristályszerkezetbe történő osztályozására. A fennmaradó három bouton kettős kötéssel a 2. és 3. C atom között, nagyon merev és könnyen besorolható a kristályszerkezetbe. Ezért viszonylag magas olvadáspontúak. Ezek az érvek nem mindig érvényesek, mivel a példa 2-metil-but-2-en (vagy izobutén) mutatja. Két metilcsoport a + i-effektusukkal ugyanabba az irányba, mint a cisz-de-2-en, és valójában javítani kell. Mindazonáltal nagyon alacsony forráspontja csak -7 ° C.
A butadién és a bután-2-ol butadién és bután-2-ol. Ezenkívül alkileket alkalmazunk alkilezőszerként. Így az izobuténből és az izobutánból fontos üzemanyag-2,2,4-trimetil-pentánt kapunk, amelyet izochatánként ismerünk. Végül, Butenes a forrásanyagok a műanyagok előállításához, mivel könnyen polimerizálhatók. Az ismert műanyag a but-1-en-en-en-alapú polibutén-1, amelyből a csövek készülnek.
Pentán, n-pentán, izopentán
A pentán vagy az N-pentán, az egyik telített szénhidrogének az alkanánok. Szinte szagtalan N-pentán folyékony környezeti körülmények között, és egy Herakeleton izomer 3 izomerből. Az elágazó folyékony izoalkán C5 - C16-at egyre inkább üzemanyagként (OTTO, DIESEL) használják. Ezenkívül ezek az alkánok fűtőolajokban és kenőolajokban vannak jelen. Teljes égést biztosítanak. Mielőtt ismeri az ilyen vegyületek jellemzőit, meg kell határoznia a geometriai izomerekkel rendelkező szénhidrogének képletét:
- Fizikai állapot - folyadék.
- Szín - színtelen.
- A szaga szinte nem.
- Gyúlékony.
- A párok robbanásveszélyes keverékeket képezhetnek levegő befolyása alatt.
- A vízben oldható nagyon alacsony (gyakorlatilag nem oldhatatlan).
- Nagyon instabil kapcsolat.
A pentán legfontosabb forrásai olyan olajolajok, amelyek eredetétől függően jelentősen különböznek. Az elválasztás frakcionált desztillációval történik. Íme a következő frakciók:
- Paraffinolaj (forráspont\u003e 320 ° C).
- Olaj (forráspont 180 és 250 ° C között).
- Fűtés / dízel üzemanyag (forráspont 250-320 ° C).
- Nyers benzin (forráspont körülbelül 180 ° C).
- A ligroinben az elágazó szénhidrogének (alkánok) vannak C5 és C10 között.
- A pentán égése oxigénnel (sztöchiometrikus).
- A végtermékek széndioxid és víz. Geometriai izomerek formulái: C5H12 + 8O2 ⟹ 5CO2 + 6H2O.
| Hu fűtőérték | Hu / kwh / kg] |
||
A Penten-2 geometriai izomerje univerzális oldószer. A fenolgyanta és polisztirol habzására szolgál. A gázkromatográfiás referenciaanyagként is szükség van, és a permetezőhengerek hajtóanyagként is szükséges.


 Ha egy nőnek nincs figyelem egy embertől
Ha egy nőnek nincs figyelem egy embertől Panzió a kenyérsütő elvesztéséről - Feltételek, méret és átvételi sorrend
Panzió a kenyérsütő elvesztéséről - Feltételek, méret és átvételi sorrend Egy terhes nő elbocsátása, amikor és milyen esetekben megengedett, hogy milyen esetekben elutasíthatók
Egy terhes nő elbocsátása, amikor és milyen esetekben megengedett, hogy milyen esetekben elutasíthatók