जल के मुख्य गुणों में से 1. जल के भौतिक गुण
पानी (हाइड्रोजन ऑक्साइड) एक पारदर्शी तरल है जो रंगहीन (छोटी मात्रा में), गंधहीन और स्वादहीन होता है। रासायनिक सूत्र: H2O. ठोस अवस्था में इसे बर्फ या हिम कहते हैं तथा गैसीय अवस्था में इसे जलवाष्प कहते हैं। पृथ्वी की सतह का लगभग 71% हिस्सा पानी (महासागर, समुद्र, झीलें, नदियाँ, ध्रुवों पर बर्फ) से ढका हुआ है।
यह एक अच्छा उच्च ध्रुवीय विलायक है। प्राकृतिक परिस्थितियों में, इसमें हमेशा घुले हुए पदार्थ (लवण, गैसें) होते हैं। पृथ्वी पर जीवन के निर्माण और रखरखाव में, जीवित जीवों की रासायनिक संरचना में, जलवायु और मौसम के निर्माण में पानी का महत्वपूर्ण महत्व है।
हमारे ग्रह की लगभग 70% सतह पर महासागरों और समुद्रों का कब्जा है। कठोर जल - बर्फ और हिम - भूमि के 20% हिस्से को कवर करता है। पृथ्वी पर पानी की कुल मात्रा में से, 1 अरब 386 मिलियन घन किलोमीटर के बराबर, 1 अरब 338 मिलियन घन किलोमीटर विश्व महासागर के खारे पानी का हिस्सा है, और केवल 35 मिलियन घन किलोमीटर ताजे पानी का हिस्सा है। समुद्र के पानी की कुल मात्रा विश्व को 2.5 किलोमीटर से अधिक की परत से ढकने के लिए पर्याप्त होगी। पृथ्वी के प्रत्येक निवासी के लिए लगभग 0.33 घन किलोमीटर समुद्री जल और 0.008 घन किलोमीटर ताज़ा पानी है। लेकिन कठिनाई यह है कि पृथ्वी पर ताजे पानी का अधिकांश हिस्सा ऐसी स्थिति में है जिससे मनुष्यों के लिए उस तक पहुँचना मुश्किल हो जाता है। लगभग 70% ताजा पानी ध्रुवीय देशों की बर्फ की चादरों और पहाड़ी ग्लेशियरों में निहित है, 30% भूमिगत जलभृतों में है, और केवल 0.006% ताजा पानी सभी नदियों के तल में निहित है। अंतरतारकीय अंतरिक्ष में पानी के अणुओं की खोज की गई है। पानी धूमकेतुओं, सौर मंडल के अधिकांश ग्रहों और उनके उपग्रहों का हिस्सा है।
पानी की संरचना (द्रव्यमान द्वारा): 11.19% हाइड्रोजन और 88.81% ऑक्सीजन। शुद्ध पानी पारदर्शी, गंधहीन और स्वादहीन होता है। इसका घनत्व 0°C (1 g/cm3) पर सबसे अधिक होता है। बर्फ का घनत्व तरल पानी के घनत्व से कम होता है, इसलिए बर्फ सतह पर तैरती रहती है। पानी 0°C पर जम जाता है और 100°C पर 101,325 Pa के दबाव पर उबलता है। यह गर्मी का संचालन बहुत खराब तरीके से करता है और बिजली का संचालन भी बहुत खराब तरीके से करता है। जल एक अच्छा विलायक है. पानी के अणु का आकार कोणीय होता है; हाइड्रोजन परमाणु ऑक्सीजन के संबंध में 104.5° का कोण बनाते हैं। इसलिए, पानी का अणु एक द्विध्रुव है: अणु का वह भाग जहाँ हाइड्रोजन स्थित है, धनात्मक रूप से आवेशित है, और वह भाग जहाँ ऑक्सीजन स्थित है, ऋणात्मक रूप से आवेशित है। पानी के अणुओं की ध्रुवीयता के कारण, इसमें मौजूद इलेक्ट्रोलाइट्स आयनों में विघटित हो जाते हैं।
तरल पानी में सामान्य H20 अणुओं के साथ, संबंधित अणु होते हैं, यानी, हाइड्रोजन बांड के गठन के कारण अधिक जटिल समुच्चय (H2O)x में जुड़े होते हैं। पानी के अणुओं के बीच हाइड्रोजन बांड की उपस्थिति इसके भौतिक गुणों की विसंगतियों को बताती है: 4 डिग्री सेल्सियस पर अधिकतम घनत्व, उच्च क्वथनांक (श्रृंखला H20-H2S - H2Se में) और असामान्य रूप से उच्च ताप क्षमता। जैसे-जैसे तापमान बढ़ता है, हाइड्रोजन बंधन टूट जाते हैं, और जब पानी भाप में बदल जाता है तो पूरी तरह टूट जाता है।
जल एक अत्यधिक क्रियाशील पदार्थ है। सामान्य परिस्थितियों में, यह कई मूल और अम्लीय ऑक्साइड के साथ-साथ क्षार और क्षारीय पृथ्वी धातुओं के साथ प्रतिक्रिया करता है। पानी अनेक यौगिक बनाता है - क्रिस्टलीय हाइड्रेट्स।
जाहिर है, पानी को बांधने वाले यौगिक सुखाने वाले एजेंट के रूप में काम कर सकते हैं। अन्य सुखाने वाले पदार्थों में P2O5, CaO, BaO, धातु Ma (वे पानी के साथ रासायनिक रूप से प्रतिक्रिया भी करते हैं), साथ ही सिलिका जेल शामिल हैं। पानी के महत्वपूर्ण रासायनिक गुणों में हाइड्रोलाइटिक अपघटन प्रतिक्रियाओं में प्रवेश करने की इसकी क्षमता शामिल है।
जल के भौतिक गुण.
पानी में कई असामान्य विशेषताएं हैं:
1. जब बर्फ पिघलती है तो उसका घनत्व बढ़ जाता है (0.9 से 1 ग्राम/सेमी³ तक)। लगभग सभी अन्य पदार्थों के पिघलने पर घनत्व कम हो जाता है।
2. जब 0 डिग्री सेल्सियस से 4 डिग्री सेल्सियस (अधिक सटीक रूप से, 3.98 डिग्री सेल्सियस) तक गर्म किया जाता है, तो पानी सिकुड़ जाता है। तदनुसार, ठंडा होने पर घनत्व कम हो जाता है। इसके लिए धन्यवाद, मछलियाँ ठंडे जलाशयों में रह सकती हैं: जब तापमान 4 डिग्री सेल्सियस से नीचे चला जाता है, तो ठंडा पानी, कम घना होने के कारण, सतह पर रहता है और जम जाता है, और बर्फ के नीचे एक सकारात्मक तापमान बना रहता है।
3. समान आणविक भार वाले हाइड्रोजन यौगिकों की तुलना में उच्च तापमान और संलयन की विशिष्ट गर्मी (0 डिग्री सेल्सियस और 333.55 केजे / किग्रा), क्वथनांक (100 डिग्री सेल्सियस) और वाष्पीकरण की विशिष्ट गर्मी (2250 केजे / किग्रा)।
4. तरल जल की उच्च ताप क्षमता।
5. उच्च चिपचिपापन.
6. उच्च सतह तनाव.
7. पानी की सतह की नकारात्मक विद्युत क्षमता।
ये सभी विशेषताएं हाइड्रोजन बांड की उपस्थिति से जुड़ी हैं। हाइड्रोजन और ऑक्सीजन परमाणुओं के बीच इलेक्ट्रोनगेटिविटी में बड़े अंतर के कारण, इलेक्ट्रॉन बादल ऑक्सीजन के प्रति दृढ़ता से पक्षपाती होते हैं। इसके कारण, और इस तथ्य के कारण कि हाइड्रोजन आयन (प्रोटॉन) में आंतरिक इलेक्ट्रॉनिक परतें नहीं होती हैं और आकार में छोटा होता है, यह पड़ोसी अणु के नकारात्मक ध्रुवीकृत परमाणु के इलेक्ट्रॉन खोल में प्रवेश कर सकता है। इसके कारण, प्रत्येक ऑक्सीजन परमाणु अन्य अणुओं के हाइड्रोजन परमाणुओं की ओर आकर्षित होता है और इसके विपरीत। पानी के अणुओं के बीच और भीतर प्रोटॉन विनिमय अंतःक्रिया एक निश्चित भूमिका निभाती है। प्रत्येक जल अणु अधिकतम चार हाइड्रोजन बंधों में भाग ले सकता है: 2 हाइड्रोजन परमाणु - प्रत्येक एक में, और एक ऑक्सीजन परमाणु - दो में; इस अवस्था में, अणु एक बर्फ के क्रिस्टल में होते हैं। जब बर्फ पिघलती है, तो कुछ बंधन टूट जाते हैं, जिससे पानी के अणु अधिक कसकर पैक हो जाते हैं; जब पानी को गर्म किया जाता है, तो बंधन टूटते रहते हैं और इसका घनत्व बढ़ता है, लेकिन 4 डिग्री सेल्सियस से ऊपर के तापमान पर यह प्रभाव थर्मल विस्तार की तुलना में कमजोर हो जाता है। वाष्पीकरण के दौरान, शेष सभी बंधन टूट जाते हैं। बंधनों को तोड़ने के लिए बहुत अधिक ऊर्जा की आवश्यकता होती है, इसलिए पिघलने और उबलने की उच्च तापमान और विशिष्ट गर्मी और उच्च ताप क्षमता होती है। पानी की चिपचिपाहट इस तथ्य के कारण है कि हाइड्रोजन बांड पानी के अणुओं को अलग-अलग गति से चलने से रोकते हैं।
समान कारणों से, पानी ध्रुवीय पदार्थों के लिए एक अच्छा विलायक है। विलेय का प्रत्येक अणु पानी के अणुओं से घिरा होता है, और विलेय के अणु के धनात्मक रूप से आवेशित भाग ऑक्सीजन परमाणुओं को आकर्षित करते हैं, और ऋणात्मक रूप से आवेशित भाग हाइड्रोजन परमाणुओं को आकर्षित करते हैं। चूँकि पानी का अणु आकार में छोटा होता है, पानी के कई अणु प्रत्येक विलेय अणु को घेर सकते हैं।
जल के इस गुण का उपयोग जीव-जन्तु करते हैं। एक जीवित कोशिका में और अंतरकोशिकीय स्थान में, पानी में विभिन्न पदार्थों के घोल परस्पर क्रिया करते हैं। बिना किसी अपवाद के पृथ्वी पर सभी एककोशिकीय और बहुकोशिकीय जीवित प्राणियों के जीवन के लिए पानी आवश्यक है।
शुद्ध (अशुद्धियों से मुक्त) पानी एक अच्छा इन्सुलेटर है। सामान्य परिस्थितियों में, पानी कमजोर रूप से विघटित होता है और प्रोटॉन (अधिक सटीक रूप से, हाइड्रोनियम आयन H3O+) और हाइड्रॉक्सिल आयन HO− की सांद्रता 0.1 μmol/l होती है। लेकिन चूंकि पानी एक अच्छा विलायक है, इसलिए इसमें कुछ लवण लगभग हमेशा घुले रहते हैं, यानी पानी में सकारात्मक और नकारात्मक आयन होते हैं। इसके कारण, पानी बिजली का संचालन करता है। पानी की विद्युत चालकता का उपयोग उसकी शुद्धता निर्धारित करने के लिए किया जा सकता है।
ऑप्टिकल रेंज में पानी का अपवर्तनांक n=1.33 है। हालाँकि, यह दृढ़ता से अवरक्त विकिरण को अवशोषित करता है, और इसलिए जल वाष्प मुख्य प्राकृतिक ग्रीनहाउस गैस है, जो 60% से अधिक ग्रीनहाउस प्रभाव के लिए जिम्मेदार है। अणुओं के बड़े द्विध्रुवीय क्षण के कारण, पानी माइक्रोवेव विकिरण को भी अवशोषित करता है, जिस पर माइक्रोवेव ओवन का संचालन सिद्धांत आधारित है।
समग्र अवस्थाएँ.
1. स्थिति के अनुसार, वे प्रतिष्ठित हैं:
2. ठोस - बर्फ़
3. द्रव - जल
4. गैसीय - जलवाष्प
चित्र 1 "बर्फ के टुकड़ों के प्रकार"
वायुमंडलीय दबाव पर, पानी 0°C पर जम जाता है (बर्फ में बदल जाता है) और 100°C पर उबल जाता है (जलवाष्प में बदल जाता है)। जैसे-जैसे दबाव कम होता है, पानी का गलनांक धीरे-धीरे बढ़ता है और क्वथनांक कम हो जाता है। 611.73 पा (लगभग 0.006 एटीएम) के दबाव पर, क्वथनांक और पिघलने बिंदु मेल खाते हैं और 0.01 डिग्री सेल्सियस के बराबर हो जाते हैं। इस दबाव और तापमान को जल का त्रिक बिंदु कहा जाता है। कम दबाव पर पानी तरल नहीं हो सकता और बर्फ सीधे भाप में बदल जाती है। बर्फ का ऊर्ध्वपातन तापमान घटते दबाव के साथ गिरता है।
जैसे-जैसे दबाव बढ़ता है, पानी का क्वथनांक बढ़ता है, क्वथनांक पर जल वाष्प का घनत्व भी बढ़ता है और तरल पानी का घनत्व कम हो जाता है। 374 डिग्री सेल्सियस (647 के) के तापमान और 22.064 एमपीए (218 एटीएम) के दबाव पर, पानी महत्वपूर्ण बिंदु से गुजरता है। इस बिंदु पर, तरल और गैसीय पानी का घनत्व और अन्य गुण समान हैं। उच्च दबाव पर तरल पानी और जल वाष्प के बीच कोई अंतर नहीं होता है, इसलिए कोई उबाल या वाष्पीकरण नहीं होता है।
मेटास्टेबल अवस्थाएँ भी संभव हैं - सुपरसैचुरेटेड भाप, सुपरहीटेड तरल, सुपरकूल्ड तरल। ये अवस्थाएँ लंबे समय तक मौजूद रह सकती हैं, लेकिन ये अस्थिर होती हैं और अधिक स्थिर चरण के संपर्क में आने पर एक संक्रमण होता है। उदाहरण के लिए, 0 डिग्री सेल्सियस से नीचे एक साफ बर्तन में शुद्ध पानी को ठंडा करके सुपरकूल्ड तरल प्राप्त करना मुश्किल नहीं है, लेकिन जब एक क्रिस्टलीकरण केंद्र दिखाई देता है, तो तरल पानी जल्दी से बर्फ में बदल जाता है।
जल का समस्थानिक संशोधन.
ऑक्सीजन और हाइड्रोजन दोनों में प्राकृतिक और कृत्रिम आइसोटोप होते हैं। अणु में शामिल आइसोटोप के प्रकार के आधार पर, निम्नलिखित प्रकार के पानी को प्रतिष्ठित किया जाता है:
1. हल्का पानी (सिर्फ पानी)।
2. भारी जल (ड्यूटेरियम)।
3. अतिभारी जल (ट्रिटियम)।
जल के रासायनिक गुण.
पानी पृथ्वी पर सबसे आम विलायक है, जो एक विज्ञान के रूप में स्थलीय रसायन विज्ञान की प्रकृति को काफी हद तक निर्धारित करता है। अधिकांश रसायन विज्ञान, एक विज्ञान के रूप में अपनी शुरुआत में, पदार्थों के जलीय घोल के रसायन विज्ञान के रूप में शुरू हुआ। इसे कभी-कभी एम्फोलाइट के रूप में माना जाता है - एक ही समय में एसिड और बेस दोनों (धनायन H+ आयन OH-)। पानी में विदेशी पदार्थों की अनुपस्थिति में, हाइड्रॉक्साइड आयनों और हाइड्रोजन आयनों (या हाइड्रोनियम आयनों) की सांद्रता समान होती है, pKa ≈ लगभग। 16.
पानी, पृथ्वी पर सबसे आश्चर्यजनक यौगिकों में से एक, लंबे समय से शोधकर्ताओं को इसके कई भौतिक गुणों की असामान्यता से आश्चर्यचकित करता रहा है:
1) पदार्थ और प्राकृतिक संसाधन दोनों की अटूटता; यदि पृथ्वी के अन्य सभी संसाधन नष्ट या बिखर जाते हैं, तो पानी इससे बचता हुआ प्रतीत होता है, तरल, ठोस और गैस के अलावा विभिन्न रूप या अवस्थाएँ लेता है। यह अपनी तरह का एकमात्र पदार्थ और संसाधन है। यह गुण जल की सर्वव्यापकता को सुनिश्चित करता है; यह पृथ्वी के संपूर्ण भौगोलिक आवरण में व्याप्त है और इसमें विभिन्न प्रकार के कार्य करता है।
2) जमने (ठंड) के दौरान इसका अंतर्निहित विस्तार और पिघलने (तरल अवस्था में संक्रमण) के दौरान मात्रा में कमी।
3) +4 डिग्री सेल्सियस के तापमान पर अधिकतम घनत्व और प्राकृतिक और जैविक प्रक्रियाओं के लिए संबंधित बहुत महत्वपूर्ण गुण, उदाहरण के लिए, जल निकायों की गहरी ठंड का बहिष्कार। एक नियम के रूप में, भौतिक निकायों का अधिकतम घनत्व जमने के तापमान पर देखा जाता है। आसुत जल का अधिकतम घनत्व असामान्य परिस्थितियों में देखा जाता है - 3.98-4 डिग्री सेल्सियस (या गोल +4 डिग्री सेल्सियस) के तापमान पर, यानी जमने (ठंड) बिंदु से ऊपर के तापमान पर। जब पानी का तापमान दोनों दिशाओं में 4°C से कम हो जाता है, तो पानी का घनत्व कम हो जाता है।
4) पिघलने (पिघलने) पर बर्फ पानी की सतह पर तैरती है (अन्य तरल पदार्थों के विपरीत)।
5) पानी के घनत्व में असामान्य परिवर्तन से गर्म होने पर पानी की मात्रा में वही असामान्य परिवर्तन होता है: तापमान में 0 से 4 डिग्री सेल्सियस की वृद्धि के साथ, गर्म पानी की मात्रा कम हो जाती है और केवल आगे बढ़ने पर ही बढ़ना शुरू हो जाता है। . यदि, तापमान में कमी के साथ और तरल से ठोस अवस्था में संक्रमण के दौरान, पानी का घनत्व और मात्रा उसी तरह बदल जाती है, जैसा कि अधिकांश पदार्थों के साथ होता है, तो जब सर्दी आती है, तो प्राकृतिक जल की सतह परतें बदल जाती हैं 0 डिग्री सेल्सियस तक ठंडा हो जाएगा और नीचे की ओर डूब जाएगा, जिससे गर्म परतें खाली हो जाएंगी, और यह तब तक जारी रहेगा जब तक जलाशय के पूरे द्रव्यमान का तापमान 0 डिग्री सेल्सियस नहीं हो जाता। फिर पानी जमना शुरू हो जाएगा, परिणामस्वरूप बर्फ की परतें नीचे तक डूब जाएंगी, और जलाशय अपनी पूरी गहराई तक जम जाएगा। हालाँकि, पानी में जीवन के कई रूप असंभव होंगे। लेकिन चूंकि पानी 4 डिग्री सेल्सियस पर अपने अधिकतम घनत्व तक पहुंचता है, इसलिए इस तापमान तक पहुंचने पर शीतलन के कारण इसकी परतों में होने वाली हलचल समाप्त हो जाती है। तापमान में और कमी के साथ, ठंडी परत, जिसका घनत्व कम होता है, सतह पर बनी रहती है, जम जाती है, और इस तरह अंतर्निहित परतों को और अधिक ठंडा होने और जमने से बचाती है।
6) पानी का एक अवस्था से दूसरी अवस्था में संक्रमण गर्मी की एक समान मात्रा के व्यय (वाष्पीकरण, पिघलने) या रिलीज (संघनन, जमने) के साथ होता है। 1 ग्राम बर्फ को पिघलाने में 677 कैलोरी और 1 ग्राम पानी को वाष्पित करने में 80 कैलोरी कम लगती है। बर्फ के संलयन की उच्च गुप्त ऊष्मा यह सुनिश्चित करती है कि बर्फ और बर्फ धीरे-धीरे पिघलें।
7) न केवल सकारात्मक, बल्कि नकारात्मक तापमान पर भी अपेक्षाकृत आसानी से गैसीय अवस्था में जाने (वाष्पीकरण) करने की क्षमता। बाद के मामले में, वाष्पीकरण तरल चरण को दरकिनार करते हुए होता है - ठोस (बर्फ, बर्फ) से सीधे वाष्प चरण में। इस घटना को उर्ध्वपातन कहा जाता है।
8) यदि हम आवर्त सारणी के छठे समूह के तत्वों (सेलेनियम एच 2 से, टेल्यूरियम एच 2 टी) और पानी (एच 2 ओ) से बने हाइड्राइड के उबलने और जमने के तापमान की तुलना करते हैं, तो उनके अनुरूप क्वथनांक होता है पानी का तापमान लगभग 60 डिग्री सेल्सियस होना चाहिए, और हिमांक बिंदु 100 डिग्री सेल्सियस से नीचे होना चाहिए। लेकिन यहां भी पानी के असामान्य गुण दिखाई देते हैं - 1 एटीएम के सामान्य दबाव पर। पानी +100°C पर उबलता है और 0°C पर जम जाता है।
9) प्रकृति के जीवन में अत्यधिक महत्व यह तथ्य है कि पानी में असामान्य रूप से उच्च ताप क्षमता होती है, जो हवा से 3000 गुना अधिक होती है। इसका मतलब यह है कि जब 1 m 3 पानी को 1 0 C तक ठंडा किया जाता है, तो 3000 m 3 हवा को समान मात्रा में गर्म किया जाता है। इसलिए, गर्मी जमा करके महासागर तटीय क्षेत्रों की जलवायु पर मध्यम प्रभाव डालता है।
10) जब पानी वाष्पित होता है और पिघलता है तो वह गर्मी को अवशोषित करता है, और जब वह भाप से संघनित होता है और जम जाता है तो उसे छोड़ देता है।
11) बिखरे हुए मीडिया में पानी की क्षमता, उदाहरण के लिए बारीक छिद्रपूर्ण मिट्टी या जैविक संरचनाओं में, एक बंधी हुई या बिखरी हुई अवस्था में जाने की। इन मामलों में, पानी के गुण बहुत बदल जाते हैं (इसकी गतिशीलता, घनत्व, हिमांक, सतह तनाव और अन्य पैरामीटर), जो प्राकृतिक और जैविक प्रणालियों में प्रक्रियाओं की घटना के लिए बेहद महत्वपूर्ण हैं।
12) पानी एक सार्वभौमिक विलायक है, इसलिए, न केवल प्रकृति में, बल्कि प्रयोगशाला स्थितियों में भी, आदर्श रूप से शुद्ध पानी नहीं है क्योंकि यह किसी भी बर्तन में घुलने में सक्षम है जिसमें यह संलग्न है। यह सुझाव दिया गया है कि आदर्श रूप से शुद्ध पानी का सतह तनाव ऐसा होगा कि कोई उस पर स्केटिंग कर सकता है। पानी में घुलने की क्षमता भौगोलिक आवरण में पदार्थों के हस्तांतरण को सुनिश्चित करती है, जीवों और पर्यावरण के बीच पदार्थों के आदान-प्रदान को रेखांकित करती है, और पोषण का आधार है।
13) सभी तरल पदार्थों (पारा को छोड़कर) में, पानी का सतह दबाव और सतह तनाव सबसे अधिक होता है: = 75 10 -7 जे/सेमी 2 (ग्लिसरॉल - 65, अमोनिया - 42, और अन्य सभी 30 10 -7 जे/सेमी 2 से नीचे) ). इसके कारण, पानी की एक बूंद एक गेंद का आकार ले लेती है और जब यह ठोस पिंडों के संपर्क में आती है, तो उनमें से अधिकांश की सतह को गीला कर देती है। इसीलिए यह चट्टानों और पौधों की केशिकाओं के माध्यम से ऊपर उठ सकता है, जिससे मिट्टी का निर्माण और पौधों को पोषण मिलता है।
14) पानी में उच्च तापीय स्थिरता होती है। जलवाष्प 1000 डिग्री सेल्सियस से ऊपर के तापमान पर ही हाइड्रोजन और ऑक्सीजन में विघटित होना शुरू हो जाता है।
15) रासायनिक रूप से शुद्ध पानी बिजली का बहुत खराब संवाहक है। कम संपीड्यता के कारण, ध्वनि और अल्ट्रासोनिक तरंगें पानी में अच्छी तरह से फैलती हैं।
16) दबाव और तापमान के प्रभाव में पानी के गुण बहुत बदल जाते हैं। इस प्रकार, जैसे-जैसे दबाव बढ़ता है, पानी का क्वथनांक बढ़ता है, और इसके विपरीत, हिमांक कम हो जाता है। बढ़ते तापमान के साथ, पानी की सतह का तनाव, घनत्व और चिपचिपाहट कम हो जाती है और पानी में विद्युत चालकता और ध्वनि की गति बढ़ जाती है।
एक साथ लिए गए पानी के असामान्य गुण, बाहरी कारकों के प्रति इसके अत्यधिक उच्च प्रतिरोध का संकेत देते हैं, अणुओं के बीच अतिरिक्त बलों की उपस्थिति के कारण होते हैं, जिन्हें हाइड्रोजन बांड कहा जाता है। हाइड्रोजन बंधन का सार यह है कि किसी अन्य तत्व के आयन से बंधा हाइड्रोजन आयन इलेक्ट्रोस्टैटिक रूप से उसी तत्व के आयन को दूसरे अणु से आकर्षित करने में सक्षम होता है। पानी के अणु में एक कोणीय संरचना होती है: इसकी संरचना में शामिल नाभिक एक समद्विबाहु त्रिभुज बनाते हैं, जिसके आधार पर दो प्रोटॉन होते हैं, और शीर्ष पर - एक ऑक्सीजन परमाणु का नाभिक होता है (चित्र 2.2)।

चित्र 2.2 - पानी के अणु की संरचना
अणु में मौजूद 10 इलेक्ट्रॉनों (5 जोड़े) में से एक जोड़ा (आंतरिक इलेक्ट्रॉन) ऑक्सीजन नाभिक के पास स्थित होता है, और शेष 4 जोड़े इलेक्ट्रॉनों (बाहरी) में से प्रत्येक प्रोटॉन और ऑक्सीजन के बीच एक जोड़ा साझा होता है नाभिक, जबकि 2 जोड़े अपरिभाषित रहते हैं और प्रोटॉन के विपरीत टेट्राहेड्रोन के शीर्षों की ओर निर्देशित होते हैं। इस प्रकार, एक पानी के अणु में टेट्राहेड्रोन के शीर्ष पर स्थित 4 आवेश ध्रुव होते हैं: 2 नकारात्मक, इलेक्ट्रॉनों के एकाकी जोड़े के स्थानों पर इलेक्ट्रॉन घनत्व की अधिकता से निर्मित, और 2 सकारात्मक, स्थानों पर इसकी कमी से निर्मित। प्रोटोन.
परिणामस्वरूप, पानी का अणु एक विद्युत द्विध्रुव बन जाता है। इस मामले में, एक पानी के अणु का सकारात्मक ध्रुव दूसरे पानी के अणु के नकारात्मक ध्रुव को आकर्षित करता है। परिणाम दो, तीन या अधिक अणुओं का समुच्चय (या अणुओं का संघ) है (चित्र 2.3)।

चित्र 2.3 - जल द्विध्रुवों द्वारा संबद्ध अणुओं का निर्माण:
1 - मोनोहाइड्रोल एच 2 ओ; 2 - डायहाइड्रोल (एच 2 ओ) 2; 3-ट्राइहाइड्रोल (एच 2 ओ) 3
नतीजतन, पानी में सिंगल, डबल और ट्रिपल अणु एक साथ मौजूद होते हैं। उनकी सामग्री तापमान के आधार पर भिन्न होती है। बर्फ में मुख्य रूप से ट्राइहाइड्रोल्स होते हैं, जिनकी मात्रा मोनोहाइड्रोल्स और डायहाइड्रोल्स से अधिक होती है। जैसे-जैसे तापमान बढ़ता है, अणुओं की गति की गति बढ़ती है, अणुओं के बीच आकर्षण बल कमजोर हो जाते हैं और तरल अवस्था में पानी ट्राई-, डी- और मोनोहाइड्रॉल का मिश्रण होता है। तापमान में और वृद्धि के साथ, ट्राइहाइड्रोल और डायहाइड्रॉल अणु विघटित हो जाते हैं; 100 डिग्री सेल्सियस के तापमान पर, पानी में मोनोहाइड्रॉल (भाप) होता है।
अकेले इलेक्ट्रॉन जोड़े का अस्तित्व दो हाइड्रोजन बांड बनाने की संभावना निर्धारित करता है। दो हाइड्रोजन परमाणुओं के कारण दो और बंधन उत्पन्न होते हैं। परिणामस्वरूप, प्रत्येक जल अणु चार हाइड्रोजन बांड बनाने में सक्षम होता है (चित्र 2.4)।

चित्र 2.4 - पानी के अणुओं में हाइड्रोजन बंधन:
– हाइड्रोजन बांड का पदनाम
पानी में हाइड्रोजन बांड की उपस्थिति के कारण, इसके अणुओं की व्यवस्था में उच्च स्तर का क्रम देखा जाता है, जो इसे एक ठोस शरीर के करीब लाता है, और संरचना में कई रिक्तियां दिखाई देती हैं, जिससे यह बहुत ढीला हो जाता है। सबसे कम सघन संरचनाओं में बर्फ की संरचना शामिल है। इसमें रिक्त स्थान होते हैं, जिनका आयाम H2O अणु के आयामों से थोड़ा बड़ा होता है। जब बर्फ पिघलती है, तो इसकी संरचना नष्ट हो जाती है। लेकिन तरल पानी में भी, अणुओं के बीच हाइड्रोजन बंधन संरक्षित रहते हैं: सहयोगी उत्पन्न होते हैं - क्रिस्टलीय संरचनाओं के नाभिक। इस अर्थ में, पानी क्रिस्टलीय और तरल अवस्थाओं के बीच एक मध्यवर्ती स्थिति में है और एक आदर्श तरल की तुलना में ठोस के समान है। हालाँकि, बर्फ के विपरीत, प्रत्येक सहयोगी बहुत कम समय के लिए मौजूद रहता है: कुछ समुच्चय का विनाश और अन्य समुच्चय का निर्माण लगातार होता रहता है। ऐसे "बर्फ" समुच्चय की रिक्तियां एकल पानी के अणुओं को समायोजित कर सकती हैं, और पानी के अणुओं की पैकिंग अधिक सघन हो जाती है। इसीलिए, जब बर्फ पिघलती है, तो पानी का आयतन कम हो जाता है और उसका घनत्व बढ़ जाता है। +4 डिग्री सेल्सियस पर, पानी की सघनतम पैकिंग होती है।
जब पानी को गर्म किया जाता है, तो गर्मी का कुछ हिस्सा हाइड्रोजन बांड को तोड़ने में खर्च हो जाता है। यह पानी की उच्च ताप क्षमता की व्याख्या करता है। जब पानी भाप में बदल जाता है तो पानी के अणुओं के बीच हाइड्रोजन बंधन पूरी तरह नष्ट हो जाते हैं।
पानी की संरचना की जटिलता न केवल इसके अणु के गुणों के कारण है, बल्कि इस तथ्य के कारण भी है कि, ऑक्सीजन और हाइड्रोजन आइसोटोप के अस्तित्व के कारण, पानी में विभिन्न आणविक भार (18 से 22 तक) वाले अणु होते हैं। सबसे आम 18 आणविक भार वाला "नियमित" अणु है। उच्च आणविक भार वाले अणुओं की सामग्री छोटी होती है। इस प्रकार, "भारी पानी" (आणविक भार 20) सभी जल भंडार का 0.02% से भी कम बनाता है। यह वायुमंडल में नहीं पाया जाता है; नदी के पानी के एक टन में 150 ग्राम से अधिक नहीं होता है, समुद्र के पानी में - 160-170 ग्राम। हालांकि, इसकी उपस्थिति "साधारण" पानी को अधिक घनत्व देती है और इसके अन्य गुणों को प्रभावित करती है।
पानी के अद्भुत गुणों ने पृथ्वी पर जीवन को उत्पन्न होने और विकसित होने की अनुमति दी। उनके लिए धन्यवाद, पानी भौगोलिक वातावरण में होने वाली सभी प्रक्रियाओं में एक अपूरणीय भूमिका निभा सकता है।
पेप्टाइड्स, या लघु प्रोटीन, कई खाद्य पदार्थों - मांस, मछली और कुछ पौधों में पाए जाते हैं। जब हम मांस का एक टुकड़ा खाते हैं, तो पाचन के दौरान प्रोटीन छोटे पेप्टाइड्स में टूट जाता है; वे पेट, छोटी आंत में अवशोषित होते हैं, रक्त, कोशिका में प्रवेश करते हैं, फिर डीएनए में जाते हैं और जीन की गतिविधि को नियंत्रित करते हैं।40 वर्ष की आयु के बाद सभी लोगों को प्रोफिलैक्सिस के लिए वर्ष में 1-2 बार, 50 वर्ष की आयु के बाद - वर्ष में 2-3 बार समय-समय पर सूचीबद्ध दवाओं का उपयोग करने की सलाह दी जाती है। अन्य दवाएँ आवश्यकतानुसार हैं।
पेप्टाइड्स कैसे लें
चूंकि कोशिकाओं की कार्यात्मक क्षमता की बहाली धीरे-धीरे होती है और उनकी मौजूदा क्षति के स्तर पर निर्भर करती है, प्रभाव पेप्टाइड्स लेने की शुरुआत के 1-2 सप्ताह बाद या 1-2 महीने के बाद हो सकता है। 1-3 महीने तक कोर्स करने की सलाह दी जाती है। यह विचार करना महत्वपूर्ण है कि प्राकृतिक पेप्टाइड बायोरेगुलेटर के तीन महीने के सेवन का प्रभाव लंबे समय तक रहता है, अर्थात। अगले 2-3 महीनों तक शरीर में काम करता है। परिणामी प्रभाव छह महीने तक रहता है, और प्रशासन के प्रत्येक बाद के कोर्स में एक शक्तिशाली प्रभाव होता है, यानी। प्रवर्धन प्रभाव पहले ही प्राप्त हो चुका है।चूंकि प्रत्येक पेप्टाइड बायोरेगुलेटर एक विशिष्ट अंग को लक्षित करता है और अन्य अंगों और ऊतकों को प्रभावित नहीं करता है, इसलिए विभिन्न प्रभावों वाली दवाओं का एक साथ उपयोग न केवल वर्जित है, बल्कि अक्सर इसकी सिफारिश की जाती है (एक समय में 6-7 दवाओं तक)।
पेप्टाइड्स किसी भी दवा और जैविक योजक के साथ संगत हैं। पेप्टाइड्स लेते समय, साथ में ली जाने वाली दवाओं की खुराक को धीरे-धीरे कम करने की सलाह दी जाती है, जिसका रोगी के शरीर पर सकारात्मक प्रभाव पड़ेगा।

लघु नियामक पेप्टाइड्स गैस्ट्रोइंटेस्टाइनल ट्रैक्ट में परिवर्तन से नहीं गुजरते हैं, इसलिए उन्हें लगभग हर किसी द्वारा सुरक्षित रूप से, आसानी से और सरलता से इनकैप्सुलेटेड रूप में उपयोग किया जा सकता है।
जठरांत्र पथ में पेप्टाइड्स डाइ- और ट्राई-पेप्टाइड्स में विघटित हो जाते हैं। अमीनो एसिड का आगे विघटन आंत में होता है। इसका मतलब है कि पेप्टाइड्स को कैप्सूल के बिना भी लिया जा सकता है। यह बहुत महत्वपूर्ण है जब कोई व्यक्ति किसी कारण से कैप्सूल निगल नहीं सकता है। यही बात गंभीर रूप से कमजोर लोगों या बच्चों पर भी लागू होती है, जब खुराक कम करने की आवश्यकता होती है।
पेप्टाइड बायोरेगुलेटर को निवारक और चिकित्सीय दोनों उद्देश्यों के लिए लिया जा सकता है।

क्षमता प्राकृतिक(पीसी) एनकैप्सुलेटेड से 2-2.5 गुना कम है। इसलिए, औषधीय प्रयोजनों के लिए उनका उपयोग लंबे समय तक (छह महीने तक) होना चाहिए। तरल पेप्टाइड कॉम्प्लेक्स को नसों के प्रक्षेपण में या कलाई पर अग्रबाहु की आंतरिक सतह पर लगाया जाता है और पूरी तरह से अवशोषित होने तक रगड़ा जाता है। 7-15 मिनट के बाद, पेप्टाइड्स डेंड्राइटिक कोशिकाओं से जुड़ जाते हैं, जो लिम्फ नोड्स में अपना आगे परिवहन करते हैं, जहां पेप्टाइड्स एक "प्रत्यारोपण" से गुजरते हैं और रक्तप्रवाह के माध्यम से वांछित अंगों और ऊतकों में भेजे जाते हैं। हालांकि पेप्टाइड्स प्रोटीन होते हैं, उनका आणविक भार प्रोटीन की तुलना में बहुत छोटा होता है, इसलिए वे आसानी से त्वचा में प्रवेश कर जाते हैं। पेप्टाइड दवाओं की पैठ उनके लिपोफिलाइजेशन से और बेहतर हो जाती है, यानी फैटी बेस के साथ उनका संबंध, यही कारण है कि बाहरी उपयोग के लिए लगभग सभी पेप्टाइड कॉम्प्लेक्स में फैटी एसिड होते हैं।
अभी कुछ समय पहले, दुनिया में पेप्टाइड दवाओं की पहली श्रृंखला सामने आई थी अभाषीय उपयोग के लिए—
 आवेदन की एक मौलिक नई विधि और प्रत्येक दवा में कई पेप्टाइड्स की उपस्थिति उन्हें सबसे तेज़ और सबसे प्रभावी कार्रवाई प्रदान करती है। यह दवा, केशिकाओं के घने नेटवर्क के साथ सब्लिंगुअल स्पेस में प्रवेश करके, पाचन तंत्र के श्लेष्म झिल्ली और यकृत के प्राथमिक चयापचय परिशोधन के माध्यम से अवशोषण को दरकिनार करते हुए, सीधे रक्तप्रवाह में प्रवेश करने में सक्षम है। प्रणालीगत रक्तप्रवाह में सीधे प्रवेश को ध्यान में रखते हुए, दवा को मौखिक रूप से लेने पर प्रभाव की शुरुआत की दर दर से कई गुना अधिक होती है।
आवेदन की एक मौलिक नई विधि और प्रत्येक दवा में कई पेप्टाइड्स की उपस्थिति उन्हें सबसे तेज़ और सबसे प्रभावी कार्रवाई प्रदान करती है। यह दवा, केशिकाओं के घने नेटवर्क के साथ सब्लिंगुअल स्पेस में प्रवेश करके, पाचन तंत्र के श्लेष्म झिल्ली और यकृत के प्राथमिक चयापचय परिशोधन के माध्यम से अवशोषण को दरकिनार करते हुए, सीधे रक्तप्रवाह में प्रवेश करने में सक्षम है। प्रणालीगत रक्तप्रवाह में सीधे प्रवेश को ध्यान में रखते हुए, दवा को मौखिक रूप से लेने पर प्रभाव की शुरुआत की दर दर से कई गुना अधिक होती है।
रिवीलैब एसएल लाइन- ये जटिल संश्लेषित दवाएं हैं जिनमें बहुत छोटी श्रृंखलाओं के 3-4 घटक होते हैं (प्रत्येक में 2-3 अमीनो एसिड)। पेप्टाइड्स की सांद्रता एनकैप्सुलेटेड पेप्टाइड्स और घोल में पीसी के बीच का औसत है। कार्रवाई की गति के मामले में, यह अग्रणी स्थान रखता है, क्योंकि अवशोषित हो जाता है और बहुत तेजी से लक्ष्य पर प्रहार करता है।
प्रारंभिक चरण में पेप्टाइड्स की इस पंक्ति को पेश करना और फिर प्राकृतिक पेप्टाइड्स पर स्विच करना समझ में आता है।
एक और अभिनव श्रृंखला बहुघटक पेप्टाइड दवाओं की एक श्रृंखला है। लाइन में 9 दवाएं शामिल हैं, जिनमें से प्रत्येक में कई छोटे पेप्टाइड्स, साथ ही एंटीऑक्सिडेंट और कोशिकाओं के लिए निर्माण सामग्री शामिल है। उन लोगों के लिए एक आदर्श विकल्प जो बहुत सारी दवाएँ लेना पसंद नहीं करते, लेकिन एक कैप्सूल में सब कुछ लेना पसंद करते हैं।
इन नई पीढ़ी के बायोरेगुलेटर्स की कार्रवाई का उद्देश्य उम्र बढ़ने की प्रक्रिया को धीमा करना, चयापचय प्रक्रियाओं के सामान्य स्तर को बनाए रखना, विभिन्न स्थितियों को रोकना और ठीक करना है; गंभीर बीमारियों, चोटों और ऑपरेशन के बाद पुनर्वास।
कॉस्मेटोलॉजी में पेप्टाइड्स
पेप्टाइड्स को न केवल दवाओं में, बल्कि अन्य उत्पादों में भी शामिल किया जा सकता है। उदाहरण के लिए, रूसी वैज्ञानिकों ने प्राकृतिक और संश्लेषित पेप्टाइड्स के साथ उत्कृष्ट सेलुलर सौंदर्य प्रसाधन विकसित किए हैं, जो त्वचा की गहरी परतों पर प्रभाव डालते हैं।बाहरी त्वचा की उम्र बढ़ना कई कारकों पर निर्भर करता है: जीवनशैली, तनाव, सूरज की रोशनी, यांत्रिक परेशानियाँ, जलवायु में उतार-चढ़ाव, सनक आहार, आदि। उम्र के साथ, त्वचा निर्जलित हो जाती है, लोच खो देती है, खुरदरी हो जाती है और उस पर झुर्रियों और गहरी खाइयों का जाल दिखाई देने लगता है। हम सभी जानते हैं कि प्राकृतिक उम्र बढ़ने की प्रक्रिया स्वाभाविक और अपरिवर्तनीय है। इसका विरोध करना असंभव है, लेकिन क्रांतिकारी कॉस्मेटोलॉजी अवयवों - कम आणविक भार पेप्टाइड्स की बदौलत इसे धीमा किया जा सकता है।
पेप्टाइड्स की विशिष्टता यह है कि वे स्ट्रेटम कॉर्नियम के माध्यम से डर्मिस में जीवित कोशिकाओं और केशिकाओं के स्तर तक स्वतंत्र रूप से गुजरते हैं। त्वचा की बहाली अंदर से गहराई से होती है और परिणामस्वरूप, त्वचा लंबे समय तक अपनी ताजगी बरकरार रखती है। पेप्टाइड सौंदर्य प्रसाधनों की कोई लत नहीं है - भले ही आप इसका उपयोग बंद कर दें, त्वचा बस शारीरिक रूप से बूढ़ी हो जाएगी।
कॉस्मेटिक दिग्गज अधिक से अधिक "चमत्कारिक" उत्पाद बना रहे हैं। हम विश्वासपूर्वक खरीदते हैं और उपयोग करते हैं, लेकिन कोई चमत्कार नहीं होता है। हम डिब्बे पर लगे लेबलों पर आँख मूँद कर विश्वास कर लेते हैं, यह नहीं जानते कि यह अक्सर केवल एक विपणन तकनीक है।
उदाहरण के लिए, अधिकांश कॉस्मेटिक कंपनियाँ एंटी-रिंकल क्रीम के उत्पादन और विज्ञापन में व्यस्त हैं कोलेजनमुख्य घटक के रूप में. इस बीच, वैज्ञानिकों ने निष्कर्ष निकाला है कि कोलेजन अणु इतने बड़े हैं कि वे त्वचा में प्रवेश नहीं कर सकते हैं। वे एपिडर्मिस की सतह पर जम जाते हैं और फिर पानी से धो दिए जाते हैं। यानी, कोलेजन युक्त क्रीम खरीदते समय, हम सचमुच पैसा बर्बाद कर रहे हैं।
एंटी-एजिंग सौंदर्य प्रसाधनों में एक और लोकप्रिय सक्रिय घटक है resveratrol.यह वास्तव में एक शक्तिशाली एंटीऑक्सीडेंट और इम्यूनोस्टिमुलेंट है, लेकिन केवल माइक्रोइंजेक्शन के रूप में। यदि आप इसे त्वचा में रगड़ेंगे तो कोई चमत्कार नहीं होगा। यह प्रयोगात्मक रूप से सिद्ध हो चुका है कि रेस्वेराट्रॉल वाली क्रीम का कोलेजन उत्पादन पर वस्तुतः कोई प्रभाव नहीं पड़ता है।
एनपीसीआरआईजेड ने सेंट पीटर्सबर्ग इंस्टीट्यूट ऑफ बायोरेग्यूलेशन एंड जेरोन्टोलॉजी के वैज्ञानिकों के सहयोग से सेलुलर सौंदर्य प्रसाधनों की एक अनूठी पेप्टाइड श्रृंखला (प्राकृतिक पेप्टाइड्स पर आधारित) और एक श्रृंखला (संश्लेषित पेप्टाइड्स पर आधारित) विकसित की है।
वे विभिन्न अनुप्रयोग बिंदुओं वाले पेप्टाइड कॉम्प्लेक्स के एक समूह पर आधारित हैं जिनका त्वचा पर एक शक्तिशाली और दृश्यमान कायाकल्प प्रभाव होता है। आवेदन के परिणामस्वरूप, त्वचा कोशिका पुनर्जनन, रक्त परिसंचरण और माइक्रोसिरिक्युलेशन उत्तेजित होता है, साथ ही त्वचा के कोलेजन-इलास्टिन ढांचे का संश्लेषण भी होता है। यह सब त्वचा को निखारने के साथ-साथ उसकी बनावट, रंग और नमी में भी सुधार लाता है।

वर्तमान में, 16 प्रकार की क्रीम विकसित की गई हैं। बुढ़ापा रोधी और समस्याग्रस्त त्वचा के लिए (थाइमस पेप्टाइड्स के साथ), चेहरे के लिए झुर्रियों के खिलाफ और शरीर के लिए खिंचाव के निशान और निशान के लिए (हड्डी-कार्टिलाजिनस ऊतक के पेप्टाइड्स के साथ), मकड़ी नसों के खिलाफ (संवहनी पेप्टाइड्स के साथ), एंटी-सेल्युलाईट ( लीवर पेप्टाइड्स के साथ), सूजन और काले घेरों से पलकों के लिए (अग्न्याशय, रक्त वाहिकाओं, ऑस्टियोकॉन्ड्रल ऊतक और थाइमस के पेप्टाइड्स के साथ), वैरिकाज़ नसों के खिलाफ (रक्त वाहिकाओं और ऑस्टियोकॉन्ड्रल ऊतक के पेप्टाइड्स के साथ), आदि। सभी क्रीम, इसके अलावा पेप्टाइड कॉम्प्लेक्स में अन्य शक्तिशाली सक्रिय तत्व होते हैं। यह महत्वपूर्ण है कि क्रीम में रासायनिक घटक (संरक्षक, आदि) न हों।

पेप्टाइड्स की प्रभावशीलता कई प्रयोगात्मक और नैदानिक अध्ययनों में साबित हुई है। बेशक, अच्छा दिखने के लिए सिर्फ क्रीम ही काफी नहीं है। आपको समय-समय पर पेप्टाइड बायोरेगुलेटर और सूक्ष्म पोषक तत्वों के विभिन्न परिसरों का उपयोग करके अपने शरीर को अंदर से फिर से जीवंत करने की आवश्यकता है।
पेप्टाइड्स वाले सौंदर्य प्रसाधनों की श्रृंखला में, क्रीम के अलावा, शैम्पू, मास्क और हेयर कंडीशनर, सजावटी सौंदर्य प्रसाधन, टॉनिक, चेहरे, गर्दन और डायकोलेट की त्वचा के लिए सीरम आदि भी शामिल हैं।
यह भी ध्यान में रखा जाना चाहिए कि खपत की गई चीनी उपस्थिति को महत्वपूर्ण रूप से प्रभावित करती है।
ग्लाइकेशन नामक प्रक्रिया के कारण, चीनी त्वचा पर हानिकारक प्रभाव डालती है। अतिरिक्त चीनी कोलेजन क्षरण की दर को बढ़ाती है, जिससे झुर्रियाँ होती हैं।

ग्लाइकेशन - क्रॉस-लिंक के निर्माण के साथ प्रोटीन, मुख्य रूप से कोलेजन के साथ शर्करा की परस्पर क्रिया - हमारे शरीर के लिए एक प्राकृतिक प्रक्रिया है, हमारे शरीर और त्वचा में एक निरंतर अपरिवर्तनीय प्रक्रिया है, जिससे संयोजी ऊतक सख्त हो जाते हैं।
ग्लाइकेशन उत्पाद - ए.जी.ई. कण। (उन्नत ग्लाइकेशन एंडप्रोडक्ट्स) - कोशिकाओं में जमा होते हैं, हमारे शरीर में जमा होते हैं और कई नकारात्मक प्रभावों को जन्म देते हैं।
ग्लाइकेशन के परिणामस्वरूप, त्वचा अपना रंग खो देती है और सुस्त हो जाती है, ढीली हो जाती है और बूढ़ी दिखने लगती है। इसका सीधा संबंध जीवनशैली से है: चीनी और आटे का सेवन कम करें (जो सामान्य वजन के लिए भी अच्छा है) और हर दिन अपनी त्वचा की देखभाल करें!
ग्लाइकेशन से निपटने, प्रोटीन क्षरण और उम्र से संबंधित त्वचा परिवर्तनों को रोकने के लिए, कंपनी ने एक शक्तिशाली डिग्लाइकेटिंग और एंटीऑक्सीडेंट प्रभाव वाली एक एंटी-एजिंग दवा विकसित की है। इस उत्पाद की क्रिया डीग्लाइकेशन प्रक्रिया को उत्तेजित करने पर आधारित है, जो त्वचा की उम्र बढ़ने की गहरी प्रक्रियाओं को प्रभावित करती है और झुर्रियों को दूर करने और इसकी लोच बढ़ाने में मदद करती है। दवा में एक शक्तिशाली एंटी-ग्लाइकेशन कॉम्प्लेक्स शामिल है - रोज़मेरी अर्क, कार्नोसिन, टॉरिन, एस्टैक्सैन्थिन और अल्फा-लिपोइक एसिड।
क्या पेप्टाइड्स बुढ़ापे के लिए रामबाण है?
पेप्टाइड दवाओं के निर्माता, वी. खविंसन के अनुसार, उम्र बढ़ना काफी हद तक जीवनशैली पर निर्भर करता है: "यदि किसी व्यक्ति के पास ज्ञान और सही व्यवहार नहीं है तो कोई भी दवा आपको नहीं बचा सकती है - इसका मतलब है बायोरिदम का पालन करना, उचित पोषण, व्यायाम और कुछ बायोरेगुलेटर लेना।" ” जहां तक उम्र बढ़ने की आनुवांशिक प्रवृत्ति का सवाल है तो उनके मुताबिक, हम केवल 25 फीसदी जीन पर निर्भर रहते हैं।वैज्ञानिक का दावा है कि पेप्टाइड कॉम्प्लेक्स में जबरदस्त पुनर्स्थापनात्मक क्षमता होती है। लेकिन उन्हें रामबाण के दर्जे तक ऊपर उठाना और गैर-मौजूद गुणों को पेप्टाइड्स के लिए जिम्मेदार ठहराना (संभवतः व्यावसायिक कारणों से) स्पष्ट रूप से गलत है!

आज अपने स्वास्थ्य का ख्याल रखने का मतलब है खुद को कल जीने का मौका देना। हमें स्वयं अपनी जीवनशैली में सुधार करना चाहिए - व्यायाम करें, बुरी आदतें छोड़ें, बेहतर भोजन करें। और हां, जब भी संभव हो, पेप्टाइड बायोरेगुलेटर का उपयोग करें जो स्वास्थ्य बनाए रखने और जीवन प्रत्याशा बढ़ाने में मदद करते हैं।
कई दशक पहले रूसी वैज्ञानिकों द्वारा विकसित पेप्टाइड बायोरेगुलेटर 2010 में ही आम उपभोक्ता के लिए उपलब्ध हो गए थे। धीरे-धीरे दुनिया भर में अधिक से अधिक लोग उनके बारे में जान रहे हैं। कई प्रसिद्ध राजनेताओं, कलाकारों और वैज्ञानिकों के स्वास्थ्य और युवावस्था को बनाए रखने का रहस्य पेप्टाइड्स के उपयोग में छिपा है। यहां उनमें से कुछ दिए गए हैं:
संयुक्त अरब अमीरात के ऊर्जा मंत्री शेख सईद,
बेलारूस के राष्ट्रपति लुकाशेंको,
कजाकिस्तान के राष्ट्रपति नज़रबायेव,
थाईलैंड के राजा
शिक्षाविद Zh.I. अल्फेरोव, पायलट-अंतरिक्ष यात्री जी.एम. ग्रेचको और उनकी पत्नी एल.के. ग्रेचको,
कलाकार: वी. लियोन्टीव, ई. स्टेपानेंको और ई. पेट्रोस्यान, एल. इस्माइलोव, टी. पोवली, आई. कोर्नेल्युक, आई. वीनर (लयबद्ध जिमनास्टिक कोच) और कई, कई अन्य...
पेप्टाइड बायोरेगुलेटर का उपयोग 2 रूसी ओलंपिक टीमों के एथलीटों द्वारा - लयबद्ध जिमनास्टिक और रोइंग में किया जाता है। दवाओं के उपयोग से हम अपने जिमनास्टों की तनाव प्रतिरोधक क्षमता को बढ़ा सकते हैं और अंतरराष्ट्रीय चैंपियनशिप में टीम की सफलता में योगदान कर सकते हैं।
यदि अपनी युवावस्था में हम समय-समय पर, जब चाहें तब स्वास्थ्य संबंधी रोकथाम कर सकते हैं, तो दुर्भाग्यवश, उम्र बढ़ने के साथ हमारे पास ऐसी विलासिता नहीं रह जाती है। और यदि तुम कल ऐसी स्थिति में नहीं होना चाहते कि तुम्हारे प्रियजन तुमसे थक जायेंगे और तुम्हारी मृत्यु का बेसब्री से इंतजार करेंगे, यदि तुम अजनबियों के बीच मरना नहीं चाहते, क्योंकि तुम्हें कुछ भी याद नहीं रहता और आपके आस-पास हर कोई वास्तव में आपको अजनबी लगता है, आपको आज से ही कार्रवाई करनी चाहिए और न केवल अपना, बल्कि अपने प्रियजनों का भी ख्याल रखना चाहिए।
बाइबल कहती है, "खोजो और तुम पाओगे।" शायद आपको उपचार और कायाकल्प का अपना तरीका मिल गया है।
सब कुछ हमारे हाथ में है और केवल हम ही अपना ख्याल रख सकते हैं। कोई भी हमारे लिए ऐसा नहीं करेगा!
 |
 |
 |

|

|
 |
 |
 |
|
परिचय……………………………………………………………………………….. 1. जल के गुण…………………………………………………………………… 2. जल का वितरण एवं स्थिति…………………………. 3. प्रकृति में जल की भूमिका………………………………………………. 4. प्रकृति में जल चक्र……………………………………. 5. जल प्रदूषण के मुख्य कारण और उनसे निपटने के सिद्धांत…………………………………….. 6. ताजे पानी की कमी की समस्या…………………………. 7. जल गुणवत्ता का मानकीकरण……………………………………. 8. जल शुद्धिकरण की विधियाँ…………………………………………………… 9. एक औद्योगिक स्थल से अपशिष्ट जल की गणना……………….. ग्रंथ सूची…………………………………………………… |
परिचय
चार ज्ञात आवास हैं: भूमि-वायु (वायुमंडल), जल (जलमंडल), मिट्टी (एडैफिक) और जीवित जीव। ये दिशानिर्देश जलमंडल प्रदूषण से संबंधित हैं।
ये दिशानिर्देश सभी विशिष्टताओं के तकनीकी विश्वविद्यालयों के छात्रों के लिए हैं। राज्य शैक्षिक मानक सभी विशिष्टताओं के छात्रों द्वारा "पारिस्थितिकी" पाठ्यक्रम और पर्यावरण संरक्षण से संबंधित मुद्दों के अध्ययन के लिए प्रदान करते हैं। अनुशासन में महारत हासिल करने में एक सेमेस्टर लगता है - एक व्याख्यान और 34 कक्षा घंटों का व्यावहारिक पाठ्यक्रम। दिशानिर्देश छात्रों को जलमंडल प्रदूषण से संबंधित मुद्दों के साथ-साथ जल निकायों की सुरक्षा के मुद्दों का सबसे प्रभावी ढंग से अध्ययन करने की अनुमति देंगे।
पर्यावरण शिक्षा और पर्यावरणीय मुद्दों का समाधान किसी भी प्रोफ़ाइल के विशेषज्ञ को विकसित करने की प्रक्रिया में शामिल होना चाहिए। मुख्य बात यह है कि उच्च शिक्षा से स्नातक होने वाले सभी विशेषज्ञ, संपूर्ण कानूनी और व्यावहारिक ज्ञान के साथ, एक उच्च नैतिक प्रभार और अपने पेशेवर क्षेत्र के संबंध में पर्यावरणीय समस्याओं को हल करने की क्षमता प्राप्त करते हैं।
उद्योग, परिवहन के गहन विकास और ग्रह के कई क्षेत्रों की अधिक जनसंख्या के कारण जलमंडल में महत्वपूर्ण प्रदूषण हुआ है। डब्ल्यूएचओ (विश्व स्वास्थ्य संगठन) के अनुसार, दुनिया में सभी संक्रामक रोगों में से लगभग 80% पीने के पानी की असंतोषजनक गुणवत्ता और स्वच्छता और स्वच्छ जल आपूर्ति मानकों के उल्लंघन से जुड़े हैं। तेल, वसा और चिकनाई की फिल्मों के साथ जलाशयों की सतह का प्रदूषण पानी और वायुमंडल के बीच गैस विनिमय में हस्तक्षेप करता है, जिससे पानी की ऑक्सीजन संतृप्ति कम हो जाती है और फाइटोप्लांकटन की स्थिति पर नकारात्मक प्रभाव पड़ता है और बड़े पैमाने पर मृत्यु का कारण बनता है। मछली और पक्षी.
संयुक्त राष्ट्र के अनुसार, दुनिया में 1 मिलियन प्रकार के उत्पादों का उत्पादन किया जाता है, जिनमें से 100 हजार रासायनिक यौगिक हैं, जिनमें 15 हजार संभावित विषाक्त पदार्थ शामिल हैं। विशेषज्ञों के अनुमान के अनुसार, बाहरी वातावरण में प्रवेश करने वाले सभी रासायनिक यौगिकों में से 80% तक देर-सबेर जल स्रोतों में समा जाते हैं।
अनुमान है कि विश्व में प्रतिवर्ष 420 किमी 3 से अधिक अपशिष्ट जल छोड़ा जाता है, जो लगभग 7 हजार किमी 3 स्वच्छ जल को उपभोग के लिए अनुपयुक्त बना सकता है।
1. जल के गुण
पृथ्वी पर जल का भंडार विशाल है; वे जलमंडल का निर्माण करते हैं - जो हमारे ग्रह के शक्तिशाली क्षेत्रों में से एक है। जलमंडल, स्थलमंडल, वायुमंडल और जीवमंडल आपस में जुड़े हुए हैं, एक दूसरे में प्रवेश करते हैं और निरंतर, निकट संपर्क में हैं। सभी क्षेत्रों में पानी है। जल संसाधन स्थिर (धर्मनिरपेक्ष) भंडार और नवीकरणीय संसाधनों से बने होते हैं। जलमंडल विश्व महासागर, समुद्र, नदियों और झीलों, दलदलों, तालाबों, जलाशयों, ध्रुवीय और पर्वतीय ग्लेशियरों, भूजल, मिट्टी की नमी और वायुमंडलीय वाष्प को एकजुट करता है।
पानी हाइड्रोजन और ऑक्सीजन (एच 2 ओ) का एक रासायनिक यौगिक है - एक गंधहीन, स्वादहीन, रंगहीन तरल (मोटी परतों में नीला); 3.98 डिग्री सेल्सियस के तापमान पर घनत्व 1 ग्राम/सेमी 3। 0°C पर पानी बर्फ में बदल जाता है, 100°C पर भाप में बदल जाता है। जल का आणविक भार 18.0153 है। वी.आई. वर्नाडस्की के अनुसार, पानी की रासायनिक संरचना को 1-6 के बराबर n मान के साथ सूत्र H 2 n O n द्वारा दर्शाया जा सकता है। पानी के सभी अणु एक जैसे नहीं होते हैं: 18 के द्रव्यमान वाले सामान्य अणुओं के साथ, 19, 20, 21 और यहां तक कि 22 के आणविक द्रव्यमान वाले अणु भी होते हैं। पानी अपने भौतिक और रासायनिक गुणों में एक अद्वितीय पदार्थ है। पानी के अणुओं की ध्रुवीयता और उनके बीच "हाइड्रोजन" बांड की उपस्थिति इसके अद्वितीय गुणों को निर्धारित करती है। पानी का घनत्व 3.98 डिग्री सेल्सियस के तापमान पर सबसे अधिक होता है; आगे ठंडा होने से यह बर्फ में परिवर्तित हो जाता है और घनत्व में कमी आती है। जब बर्फ पिघलती है तो आयतन में विस्तार के बजाय कमी होती है। पानी की अस्थिरता कम है. पानी में असामान्य रूप से उच्च संलयन ताप और विशिष्ट ऊष्मा होती है; जब बर्फ पिघलती है, तो ताप क्षमता दोगुनी से अधिक हो जाती है। तापमान 27 डिग्री सेल्सियस तक बढ़ने पर पानी की ताप क्षमता कम हो जाती है और फिर बढ़ने लगती है। बढ़ते दबाव के साथ पानी की चिपचिपाहट (0 से 30 डिग्री सेल्सियस के तापमान पर) कम हो जाती है।
2. जल का वितरण एवं स्थिति
जल पृथ्वी पर सबसे प्रचुर मात्रा में पाया जाने वाला पदार्थ है। यह तीन चरणों में होता है: गैसीय (जलवाष्प), तरल और ठोस। वायुमंडलीय, सतही और भूमिगत जल हैं।
वायुमंडल में पानी पृथ्वी के चारों ओर वायु आवरण में वाष्प अवस्था में, बूंद-तरल अवस्था में - बादलों, कोहरे और बारिश के रूप में, और ठोस - बर्फ, ओले और बर्फ के क्रिस्टल के रूप में पाया जाता है। ऊंचे बादलों का.
तरल रूप में, पानी जलमंडल में पाया जाता है: महासागरों, समुद्रों, झीलों, नदियों, दलदलों, तालाबों और जलाशयों में पानी। ठोस अवस्था में, बर्फ और बर्फ के रूप में पानी ग्रह के ध्रुवों पर, पर्वत चोटियों पर पाया जाता है और सर्दियों में यह जलाशयों के बड़े क्षेत्रों को कवर करता है। इसमें केशिका, गुरुत्वाकर्षण और क्रिस्टलीकरण जल है।
महासागरों और समुद्रों का कुल क्षेत्रफल भूमि क्षेत्र से 2.5 गुना बड़ा है, और पृथ्वी पर पानी की मात्रा 1.5-109 किमी 3 है। 95% से अधिक पानी खारा है। जल भंडार और उनका अनुपात तालिका 1 में दिखाया गया है। विश्व महासागर 361 मिलियन किमी 2 के क्षेत्र को कवर करता है, जो पृथ्वी की सतह का 70.8% है। समुद्र की औसत गहराई 3800 मीटर के साथ, पानी की कुल मात्रा 1370 मिलियन किमी 3 तक पहुँच जाती है। भूजल संसाधनों की गणना करते समय, यह माना जाता है कि पृथ्वी के आवरण में 0.5% पानी है, जिसकी कुल मात्रा लगभग 13-15 बिलियन किमी 3 पानी है। पृथ्वी की पपड़ी और ग्रह की सतह पर गहरे पानी का संभावित प्रवाह प्रति वर्ष औसतन 1 किमी 3 है। पृथ्वी की औसत पूर्ण आयु 3.5 अरब वर्ष के साथ, सतही जल की मात्रा लगभग 3.3 अरब किमी 3 (मकारेंको, 1966) होनी चाहिए। पृथ्वी की पपड़ी में मुक्त जल की मात्रा (भूजल) वी.आई. वर्नाडस्की का अनुमान 60 मिलियन किमी 3 है।
तालिका 1 - विश्व का कुल जल भंडार
|
जलमंडल के भाग |
एम.आई. लवोविच के अनुसार |
आर.के. के अनुसार क्लिगे |
||
|
मात्रा का % |
मात्रा का % |
|||
|
विश्व महासागर | ||||
|
भूजल | ||||
|
झीलें, दलदल | ||||
|
मिट्टी की नमी | ||||
|
वायुमंडलीय नमी | ||||
|
नदी का पानी | ||||
|
संपूर्ण जलमंडल | ||||
रूस तीन महासागरों से संबंधित 12 समुद्रों के पानी से धोया जाता है। रूस के क्षेत्र में 2.5 मिलियन से अधिक बड़ी और छोटी नदियाँ, 2 मिलियन से अधिक झीलें हैं। रूस के जल संसाधन स्थिर (धर्मनिरपेक्ष) और नवीकरणीय से बने हैं। पूर्व को लंबी अवधि में अपेक्षाकृत स्थिर माना जाता है; नवीकरणीय जल संसाधनों का अनुमान वार्षिक नदी प्रवाह की मात्रा से लगाया जाता है। नदी का प्रवाह बर्फ पिघलने और वर्षा से बनता है; दलदल और भूजल नदी के पोषण के स्रोत के रूप में काम करते हैं। रूस के कुल जल संसाधन तालिका 2 में दिखाए गए हैं।
देश के सामाजिक-आर्थिक विकास में सतही मीठे जल से नदी प्रवाह का प्राथमिक महत्व है। नदी प्रवाह की मात्रा के मामले में रूस ब्राजील के बाद दूसरे स्थान पर है। नदियोंजल निधि का आधार हैं। रूस के लगभग 65% बड़े शहर (मास्को, सेंट पीटर्सबर्ग, निज़नी नोवगोरोड, येकातेरिनबर्ग, पर्म और अन्य) पीने और तकनीकी जरूरतों के लिए सतही जल, मुख्य रूप से नदी के पानी का उपयोग करते हैं।
तालिका 2 - रूस के कुल जल संसाधन
|
संसाधनों के प्रकार |
नवीकरणीय, |
कुल संसाधनों का % |
स्थैतिक, किमी 3 |
% साझा संसाधनों से |
|
नदी का बहाव | ||||
|
भूजल | ||||
|
मिट्टी की नमी | ||||
|
97000 से भी ज्यादा |
10 किमी से अधिक लंबाई और 2.3 मिलियन किमी से अधिक की कुल लंबाई वाली 120 हजार से अधिक नदियाँ रूस के क्षेत्र से होकर बहती हैं। रूस के वार्षिक नदी प्रवाह का लगभग 90% आर्कटिक और प्रशांत महासागरों के घाटियों पर पड़ता है, और केवल 8% कैस्पियन और अज़ोव समुद्र के घाटियों पर पड़ता है। हालाँकि, यह इन समुद्रों के घाटियों में है कि 80% से अधिक रूसी आबादी रहती है, और आर्थिक बुनियादी ढांचे का बड़ा हिस्सा केंद्रित है।
रूस में इनकी संख्या 2 मिलियन से अधिक है। ताजी और नमकीन झीलें।इनमें सबसे गहरी मीठे पानी की झील, बैकाल झील और सबसे बड़ा बंद खारे पानी का भंडार, कैस्पियन सागर है। झील के ताजे जल संसाधनों का मुख्य भाग झीलों में केंद्रित है: बैकाल (23 हजार किमी 3, या दुनिया का 20% और राष्ट्रीय भंडार का 90%), लाडोगा (903 किमी 3), वनगा (285 किमी 3), चुडस्को- पस्कोवस्कॉय (35.2 किमी 3)। रूस के सबसे बड़े जलाशयों में लगभग 450 किमी 3 ताज़ा पानी है।
ग्लेशियरोंपानी का एक महत्वपूर्ण संचयकर्ता हैं, वे मुख्य रूप से ध्रुवीय क्षेत्रों में केंद्रित हैं: अंटार्कटिका में, आर्कटिक द्वीपों पर, आर्कटिक के रूसी क्षेत्र सहित, और पहाड़ी क्षेत्रों में।
भूजलनदियों, झीलों और तालाबों के सतही जल के साथ मिलकर, वे रूस के जल कोष का आधार बनते हैं और पीने के प्रयोजनों के लिए काम करते हैं। प्राकृतिक ताज़ा भूजल संसाधनों की मात्रा 787.5 किमी 3/वर्ष है, उपयोग के लिए उपयुक्त अनुमानित - 300 किमी 3/वर्ष से अधिक। खनिज और औषधीय भूमिगत जल का उपयोग 450 निक्षेपों में सेनेटोरियम-रिसॉर्ट और स्वास्थ्य-सुधार संस्थानों के साथ-साथ औषधीय खनिज जल के लिए बोतलबंद पौधों द्वारा किया जाता है। संभावित खनिज जल संसाधनों का अनुमान 800 हजार घन मीटर प्रति दिन है। थर्मल पावर (40 से 200 के तापमान के साथ थर्मल, भाप-पानी का मिश्रण ° साथ ) भूजल का उपयोग ताप आपूर्ति और विद्युत ऊर्जा उत्पादन के लिए किया जाता है। उनके महत्वपूर्ण संसाधन (7081.5 मिलियन मी3/दिन से अधिक) उत्तरी काकेशस और सुदूर पूर्व में केंद्रित हैं। औद्योगिक भूजल संसाधनों की मात्रा 4 मिलियन घन मीटर 3/दिन (हाइड्रोमिनरल कच्चे माल) से अधिक है। वे आयोडीन, ब्रोमीन और कई अन्य दुर्लभ तत्वों और धातुओं का स्रोत हैं। औद्योगिक भूजल के बड़े भंडार क्रास्नोडार क्षेत्र, उराल और पश्चिमी साइबेरिया में स्थित हैं।
पानी एक पारदर्शी तरल, रंगहीन (छोटी मात्रा में) और गंधहीन है। पृथ्वी पर जीवन के निर्माण और रखरखाव में, जीवित जीवों की रासायनिक संरचना में, जलवायु और मौसम के निर्माण में पानी का महत्वपूर्ण महत्व है। ठोस अवस्था में इसे बर्फ या हिम कहते हैं तथा गैसीय अवस्था में इसे जलवाष्प कहते हैं। पृथ्वी की सतह का लगभग 71% हिस्सा पानी (महासागर, समुद्र, झीलें, नदियाँ, ध्रुवों पर बर्फ) से ढका हुआ है।
पानी के गुण पानी के भौतिक, रासायनिक, जैव रासायनिक, ऑर्गेनोलेप्टिक, भौतिक रासायनिक और अन्य गुणों का एक समूह हैं।
पानी - हाइड्रोजन ऑक्साइड - सबसे आम और महत्वपूर्ण पदार्थों में से एक है। पानी से घिरी पृथ्वी की सतह भूमि की सतह से 2.5 गुना बड़ी है। प्रकृति में कोई शुद्ध पानी नहीं है, इसमें हमेशा अशुद्धियाँ होती हैं। शुद्ध जल आसवन द्वारा प्राप्त किया जाता है। आसुत जल को आसुत जल कहा जाता है। पानी की संरचना (द्रव्यमान द्वारा): 11.19% हाइड्रोजन और 88.81% ऑक्सीजन।
शुद्ध पानी पारदर्शी, गंधहीन और स्वादहीन होता है। इसका घनत्व 0°C (1 g/cm3) पर सबसे अधिक होता है। बर्फ का घनत्व तरल पानी के घनत्व से कम होता है, इसलिए बर्फ सतह पर तैरती रहती है। पानी 0°C पर जम जाता है और 100°C पर 101,325 Pa के दबाव पर उबलता है। यह गर्मी का संचालन बहुत खराब तरीके से करता है और बिजली का संचालन भी बहुत खराब तरीके से करता है। जल एक अच्छा विलायक है. पानी के अणु का आकार कोणीय होता है; हाइड्रोजन परमाणु ऑक्सीजन के संबंध में 104.5° का कोण बनाते हैं। इसलिए, पानी का अणु एक द्विध्रुव है: अणु का वह भाग जहाँ हाइड्रोजन स्थित है, धनात्मक रूप से आवेशित है, और वह भाग जहाँ ऑक्सीजन स्थित है, ऋणात्मक रूप से आवेशित है। पानी के अणुओं की ध्रुवीयता के कारण, इसमें मौजूद इलेक्ट्रोलाइट्स आयनों में विघटित हो जाते हैं।
तरल पानी में सामान्य H20 अणुओं के साथ, संबंधित अणु होते हैं, यानी, हाइड्रोजन बांड के गठन के कारण अधिक जटिल समुच्चय (H2O)x में जुड़े होते हैं। पानी के अणुओं के बीच हाइड्रोजन बांड की उपस्थिति इसके भौतिक गुणों की विसंगतियों को बताती है: 4 डिग्री सेल्सियस पर अधिकतम घनत्व, उच्च क्वथनांक (श्रृंखला H20-H2S - H2Se में) और असामान्य रूप से उच्च ताप क्षमता। जैसे-जैसे तापमान बढ़ता है, हाइड्रोजन बंधन टूट जाते हैं, और जब पानी भाप में बदल जाता है तो पूरी तरह टूट जाता है।
जल एक अत्यधिक क्रियाशील पदार्थ है। सामान्य परिस्थितियों में, यह कई मूल और अम्लीय ऑक्साइड के साथ-साथ क्षार और क्षारीय पृथ्वी धातुओं के साथ प्रतिक्रिया करता है। पानी अनेक यौगिक बनाता है - क्रिस्टलीय हाइड्रेट्स।
जाहिर है, पानी को बांधने वाले यौगिक सुखाने वाले एजेंट के रूप में काम कर सकते हैं। अन्य सुखाने वाले पदार्थों में P2O5, CaO, BaO, धातु Ma (वे पानी के साथ रासायनिक रूप से प्रतिक्रिया भी करते हैं), साथ ही सिलिका जेल शामिल हैं। पानी के महत्वपूर्ण रासायनिक गुणों में हाइड्रोलाइटिक अपघटन प्रतिक्रियाओं में प्रवेश करने की इसकी क्षमता शामिल है।
जल के रासायनिक गुण उसकी संरचना से निर्धारित होते हैं। पानी में 88.81% ऑक्सीजन और केवल 11.19% हाइड्रोजन होता है। जैसा कि हमने ऊपर बताया, पानी शून्य डिग्री सेल्सियस पर जम जाता है, लेकिन सौ डिग्री सेल्सियस पर उबल जाता है। आसुत जल में धनावेशित हाइड्रोनियम आयन HO और H3O+ की सांद्रता बहुत कम होती है (केवल 0.1 μmol/l), इसलिए इसे एक उत्कृष्ट इन्सुलेटर कहा जा सकता है। हालाँकि, यदि यह एक अच्छा विलायक नहीं होता तो प्रकृति में पानी के गुणों का सही ढंग से एहसास नहीं होता। जल का अणु आकार में बहुत छोटा होता है। जब कोई अन्य पदार्थ पानी में प्रवेश करता है, तो उसके सकारात्मक आयन पानी के अणु बनाने वाले ऑक्सीजन परमाणुओं द्वारा आकर्षित होते हैं, और नकारात्मक आयन हाइड्रोजन परमाणुओं द्वारा आकर्षित होते हैं। पानी अपने अंदर घुले रासायनिक तत्वों को चारों ओर से घेरता नजर आता है। इसलिए, पानी में लगभग हमेशा विभिन्न पदार्थ होते हैं, विशेष रूप से धातु लवण, जो विद्युत प्रवाह के संचालन को सुनिश्चित करते हैं।
पानी के भौतिक गुणों ने हमें ग्रीनहाउस प्रभाव और माइक्रोवेव ओवन जैसी घटनाएं "दी" हैं। लगभग 60% ग्रीनहाउस प्रभाव जल वाष्प द्वारा निर्मित होता है, जो अवरक्त किरणों को पूरी तरह से अवशोषित करता है। इस स्थिति में, पानी का ऑप्टिकल अपवर्तनांक n=1.33 है। इसके अलावा, पानी अपने अणुओं के उच्च द्विध्रुवीय क्षण के कारण माइक्रोवेव को भी अवशोषित करता है। प्रकृति में पानी के इन गुणों ने वैज्ञानिकों को माइक्रोवेव ओवन के आविष्कार के बारे में सोचने के लिए प्रेरित किया।
प्रकृति और मानव जीवन में जल की भूमिका अत्यंत महान है। हम कह सकते हैं कि सभी जीवित चीजों में पानी और कार्बनिक पदार्थ शामिल हैं। वह भौतिक और रासायनिक पर्यावरण, जलवायु और मौसम के निर्माण में सक्रिय भागीदार है। साथ ही इसका असर अर्थव्यवस्था, उद्योग, कृषि, परिवहन और ऊर्जा पर भी पड़ता है।
हम भोजन के बिना कई हफ्तों तक जीवित रह सकते हैं, लेकिन पानी के बिना - केवल 2-3 दिन। सामान्य अस्तित्व सुनिश्चित करने के लिए, एक व्यक्ति को शरीर में पोषक तत्वों की तुलना में वजन के हिसाब से लगभग 2 गुना अधिक पानी डालना चाहिए। मानव शरीर में 10% से अधिक पानी की कमी से मृत्यु हो सकती है। औसतन, पौधों और जानवरों के शरीर में 50% से अधिक पानी होता है, जेलिफ़िश के शरीर में यह 96% तक, शैवाल में 95-99%, बीजाणु और बीजों में 7 से 15% तक होता है। मिट्टी में कम से कम 20% पानी होता है, जबकि मानव शरीर में पानी लगभग 65% होता है। मानव शरीर के विभिन्न हिस्सों में पानी की असमान मात्रा होती है: आंख के कांच के शरीर में 99% पानी होता है, रक्त में 83%, वसा ऊतक में 29%, कंकाल में 22% और यहां तक कि दांतों के इनेमल में 0.2% पानी होता है। अपने पूरे जीवन में, एक व्यक्ति शरीर से पानी खो देता है, और उसकी बायोएनर्जेटिक क्षमता कम हो जाती है। छह सप्ताह के मानव भ्रूण में, पानी की मात्रा 97% तक होती है, नवजात शिशु में - 80%, एक वयस्क में - 60-70%, और एक बुजुर्ग व्यक्ति के शरीर में - केवल 50-60%।
पानी सभी प्रमुख मानव जीवन समर्थन प्रणालियों के लिए नितांत आवश्यक है। पानी और उसमें मौजूद पदार्थ एक पोषण माध्यम बन जाते हैं और जीवित जीवों को जीवन के लिए आवश्यक सूक्ष्म तत्व प्रदान करते हैं। यह रक्त (79%) में निहित है और हजारों आवश्यक पदार्थों और तत्वों की विघटित अवस्था में संचार प्रणाली के माध्यम से परिवहन की सुविधा प्रदान करता है (पानी की भू-रासायनिक संरचना जानवरों और मनुष्यों के रक्त की संरचना के करीब है।)।
लसीका में, जो जीवित जीव के रक्त और ऊतकों के बीच पदार्थों का आदान-प्रदान करता है, पानी 98% होता है।
पानी अन्य तरल पदार्थों की तुलना में सार्वभौमिक विलायक के गुणों को अधिक दृढ़ता से प्रदर्शित करता है। एक निश्चित समय के बाद यह लगभग किसी भी ठोस पदार्थ को घोल सकता है।
जल की यह व्यापक भूमिका उसके अद्वितीय गुणों के कारण है।
हाल ही में, शोधकर्ताओं के प्रयासों को इंटरफ़ेस पर होने वाली प्रक्रियाओं के त्वरित अध्ययन पर ध्यान केंद्रित किया गया है। यह पता चला कि सीमा परतों में पानी में कई दिलचस्प गुण हैं जो थोक चरण में प्रकट नहीं होते हैं। यह जानकारी कई महत्वपूर्ण व्यावहारिक समस्याओं के समाधान के लिए अत्यंत आवश्यक है। एक उदाहरण माइक्रोइलेक्ट्रॉनिक्स के लिए मौलिक रूप से नए तत्व आधार का निर्माण होगा, जहां सर्किट का आगे का लघुकरण पानी की सतह पर मैक्रोमोलेक्यूल्स के स्व-संगठन के सिद्धांत पर आधारित होगा। एक विकसित सतह भी जैविक प्रणालियों की विशेषता है, उनके कामकाज के लिए सतह की घटनाओं के महत्व के कारण। लगभग हमेशा, पानी की उपस्थिति निकट-सतह क्षेत्र में होने वाली प्रक्रियाओं की प्रकृति पर महत्वपूर्ण प्रभाव डालती है। बदले में, सतह के प्रभाव में, पानी के गुण स्वयं मौलिक रूप से बदल जाते हैं, और सीमा के पास के पानी को अध्ययन की एक मौलिक नई भौतिक वस्तु माना जाना चाहिए। यह बहुत संभावना है कि सतह के पास पानी के आणविक सांख्यिकीय गुणों का अध्ययन, जो अनिवार्य रूप से अभी शुरुआत है, कई भौतिक और रासायनिक प्रक्रियाओं को प्रभावी ढंग से नियंत्रित करना संभव बना देगा।
हाल ही में सूक्ष्म स्तर पर पानी के गुणों का अध्ययन करने में रुचि बढ़ी है। इस प्रकार, सतह की घटनाओं के भौतिकी में कई मुद्दों को समझने के लिए, इंटरफ़ेस पर पानी के गुणों को जानना आवश्यक है। पानी की संरचना और आणविक स्तर पर पानी के संगठन के बारे में सख्त विचारों की कमी इस तथ्य की ओर ले जाती है कि थोक चरण और केशिका प्रणालियों दोनों में जलीय घोल के गुणों का अध्ययन करते समय, पानी को अक्सर एक संरचनाहीन माध्यम माना जाता है। हालाँकि, यह ज्ञात है कि सीमा परतों में पानी के गुण थोक में पानी के गुणों से स्पष्ट रूप से भिन्न हो सकते हैं। इसलिए, पानी को एक संरचनाहीन तरल मानते हुए, हम सीमा परतों के गुणों के बारे में अनूठी जानकारी खो देते हैं, जो, जैसा कि यह पता चला है, मोटे तौर पर पतले छिद्रों में होने वाली प्रक्रियाओं की प्रकृति को निर्धारित करता है। उदाहरण के लिए, सेलूलोज़ एसीटेट झिल्ली की आयन चयनात्मकता को छिद्रों में पानी के विशेष आणविक संगठन द्वारा समझाया गया है, जो विशेष रूप से, "गैर-विलायक मात्रा" की अवधारणा में परिलक्षित होता है। सिद्धांत का आगे का विकास, जो चयनात्मक झिल्ली परिवहन के अंतर्निहित अंतर-आणविक इंटरैक्शन की विशिष्टताओं को ध्यान में रखता है, समाधानों की झिल्ली अलवणीकरण की अधिक संपूर्ण समझ में योगदान देगा। इससे जल अलवणीकरण प्रक्रियाओं की दक्षता में सुधार के लिए सूचित सिफारिशें देना संभव हो जाएगा। इसका तात्पर्य सीमा परतों में तरल पदार्थों के गुणों का अध्ययन करने के महत्व और आवश्यकता से है, विशेष रूप से ठोस शरीर की सतह के पास।
 मेलिसा और डौग बीड सेट 2 साल पुराने बोर्ड गेम
मेलिसा और डौग बीड सेट 2 साल पुराने बोर्ड गेम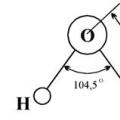 जल के भौतिक गुण
जल के भौतिक गुण कैसे आशावाद आपको अपने लक्ष्य हासिल करने में मदद करता है
कैसे आशावाद आपको अपने लक्ष्य हासिल करने में मदद करता है