Геометричната изомерия е характерна за. Основи на стереохимията
По време на урока ще получите обща представа за видовете изомерия, ще научите какво е изомер. Научете за видовете изомерия в органичната химия: структурна и пространствена (стереоизомерия). Използвайки структурните формули на веществата, разгледайте подвидовете на структурната изомерия (скелет и изомерия на позициите), научете за разновидностите на пространствената изомерия: геометрична и оптична.
Тема: Въведение в органичната химия
Урок: Изомеризъм. Видове изомерия. Структурна изомерия, геометрична, оптична
1. Какво е изомерия
По-рано разглежданите видове формули, описващи органични вещества, показват, че няколко различни структурни формули могат да съответстват на една молекулярна.
Например молекулната формула С2Н6О кореспондират две вещества с различни структурни формули - етилов алкохол и диметилов етер. Фигура: 1.
Етиловият алкохол е течност, която реагира с метален натрий с отделянето на водород, кипи при + 78,50С. При същите условия диметилов етер, газ, който не реагира с натрий, кипи при -230 ° С.
Тези вещества се различават по своята структура - една и съща молекулна формула съответства на различни вещества.
Фигура: 1. Междукласова изомерия
Феноменът на съществуването на вещества с еднакъв състав, но различна структура и следователно различни свойства се наричат \u200b\u200bизомерия (от гръцките думи „isos“ - „равен“ и „meros“ - „част“, \u200b\u200b„дял“).
Видове изомеризъм
Съществуват различни видове изомерия.
2. Междукласова изомерия
Структурната изомерия е свързана с различния ред на свързване на атомите в молекулата.
Етанолът и диметиловият етер са структурни изомери. Тъй като те принадлежат към различни класове органични съединения, този тип структурна изомерия се нарича също междуклас... Фигура: 1.
3. Изомеризъм на въглеродния скелет
Структурните изомери могат да бъдат в един и същ клас съединения, например три различни въглеводорода съответстват на формулата C5H12. то изомерия на въглеродния скелет... Фигура: 2.

Фигура: 2 Примери за вещества - структурни изомери
4. Позиционна изомерия
Има структурни изомери с един и същ въглероден скелет, които се различават по положението на множество връзки (двойни и тройни) или атоми, заместващи водорода. Този тип структурна изомерия се нарича изомерия на позицията.
Фигура: 3. Изомерия на структурна позиция
5. Пространствена изомерия
В молекули, съдържащи само единични връзки, при стайна температура е възможно почти свободно въртене на молекулни фрагменти около връзките и, например, всички изображения на формулите на 1,2-дихлороетан са еквивалентни. Фигура: 4

Фигура: 4. Разположение на хлорните атоми около единична връзка
Ако въртенето е затруднено, например, в циклична молекула или с двойна връзка, тогава геометрична или цис-транс изомерия.В цис-изомерите заместителите са от едната страна на равнината на пръстена или двойната връзка, в транс-изомерите - от противоположните страни.
Цис-транс изомери съществуват, когато въглеродният атом е свързан две различни депутат. Фигура: пет.



Фигура: 5. Цис - и транс - изомери
6. Оптична изомерия
Друг вид изомерия възниква поради факта, че въглеродният атом с четири единични връзки образува със заместителите си пространствена структура - тетраедър. Ако молекулата има поне един въглероден атом, свързан с четири различни заместители, оптична изомерия... Такива молекули не съвпадат с огледалния си образ. Това свойство се нарича хиралност - от гръцки chier - „ръка“. Фигура: 6. Оптичната изомерия е характерна за много молекули, които изграждат живите организми.
|
|
|
Фигура: 6. Примери за оптични изомери
Оптичната изомерия също се нарича енантиомеризъм (от гръцки enantios - "противоположно" и meros - "част"), и оптични изомери - енантиомери... Енантиомерите са оптически активни, те завъртат равнината на поляризация на светлината под същия ъгъл, но в противоположни посоки: д-, или (+) - изомер, - вдясно, l-, или (-) - изомер, - вляво. Смес от равни количества енантиомери, наречена рацемат, е оптически неактивна и е обозначена със символа d, l- или (±).
Обобщение на урока
По време на урока получихте обща представа за видовете изомерия, какво е изомер. Научихме за видовете изомерия в органичната химия: структурна и пространствена (стереоизомерия). С помощта на структурните формули на веществата разгледахме подвида на структурната изомерия (скелет и изомерия на позициите), запознахме се с разновидностите на пространствената изомерия: геометрична и оптична.
Списък на литературата
1. Руджитис Г. Е. Химия. Основи на общата химия. Клас 10: учебник за образователни институции: основно ниво / Г. Е. Руджитис, Ф. Г. Фелдман. - 14-то издание. - М.: Образование, 2012.
2. Химия. Клас 10. Профилно ниво: учебник. за общо образование. институции / В. В. Еремин, Н. Е. Кузменко, В. В. Лунин и др. - М.: Дрофа, 2008. - 463 с.
3. Химия. Клас 11. Профилно ниво: учебник. за общо образование. институции / В. В. Еремин, Н. Е. Кузменко, В. В. Лунин и др. - М.: Дрофа, 2010. - 462 с.
4. Хомченко Г. П., Хомченко И. Г. Колекция от задачи по химия за постъпващите в университети. - 4-то изд. - М.: АПИ „Нова вълна“: Издател Умеренков, 2012. - 278 с.
1. Интернетурок. ru.
2. Органична химия.
Домашна работа
1. № 1,2 (стр. 39) Руджитис Г. Й. Химия. Основи на общата химия. Клас 10: учебник за образователни институции: основно ниво / Г. Е. Руджитис, Ф. Г. Фелдман. - 14-то издание. - М.: Образование, 2012.
2. Защо броят на изомерите във въглеводородите от етиленовата серия е по-голям от наситените въглеводороди?
3. Какви въглеводороди имат пространствени изомери?
Закрепете материала с помощта на симулатори
Треньор 1 Треньор 2 Треньор 3

 I. Изомеризъм (от гръцки isos - равен) Berzelius, 1830 Изомерите са вещества, които имат еднаква молекулна формула (еднакъв качествен и количествен състав), но се различават в последователността на свързване на атомите и (или) тяхното разположение в пространството и имат различни Имоти.
I. Изомеризъм (от гръцки isos - равен) Berzelius, 1830 Изомерите са вещества, които имат еднаква молекулна формула (еднакъв качествен и количествен състав), но се различават в последователността на свързване на атомите и (или) тяхното разположение в пространството и имат различни Имоти.
 БЕРЦЕЛИЙ (Берцелиус), Йенс Якоб 1779 - 1848 Известен шведски химик. От 1807 г. професор по медицина и фармация в Стокхолм.
БЕРЦЕЛИЙ (Берцелиус), Йенс Якоб 1779 - 1848 Известен шведски химик. От 1807 г. професор по медицина и фармация в Стокхолм.
 C 2 H 6 O диметилов етер Bp \u003d -24 C етилов алкохол Bp \u003d 78 C n-бутан Bp \u003d -0.5 C C 4 H 10 изобутан Bp \u003d -11.7 C
C 2 H 6 O диметилов етер Bp \u003d -24 C етилов алкохол Bp \u003d 78 C n-бутан Bp \u003d -0.5 C C 4 H 10 изобутан Bp \u003d -11.7 C
 Брой изомери в серията алкани Име Формула Номер Формула на изомери Име Брой изомери CH 4 метан 1 C 11 H 24 ундекан 159 C 2 H 6 етан 1 C 12 H 26 додекан 355 C 3 H 8 пропан 1 C 13 H 28 тридекан 802 C 4 H 10 бутан 2 C 14 H 30 тетрадекан 1 858 C 5 H 12 пентан 3 C 15 H 32 пентадекан 4 347 C 6 H 14 хексан 5 C 20 H 42 ейкозан C 7 H 16 хептан 9 C 25 H 52 пентакозан 36 797 588 C 8 H 18 октан 18 C 30 H 62 триаконтан 4 111 846 763 C 9 H 20 нонан 35 C 40 H 82 тетраконтан 62 491 178 805 831 C 10 H 22 декан 75 366 319
Брой изомери в серията алкани Име Формула Номер Формула на изомери Име Брой изомери CH 4 метан 1 C 11 H 24 ундекан 159 C 2 H 6 етан 1 C 12 H 26 додекан 355 C 3 H 8 пропан 1 C 13 H 28 тридекан 802 C 4 H 10 бутан 2 C 14 H 30 тетрадекан 1 858 C 5 H 12 пентан 3 C 15 H 32 пентадекан 4 347 C 6 H 14 хексан 5 C 20 H 42 ейкозан C 7 H 16 хептан 9 C 25 H 52 пентакозан 36 797 588 C 8 H 18 октан 18 C 30 H 62 триаконтан 4 111 846 763 C 9 H 20 нонан 35 C 40 H 82 тетраконтан 62 491 178 805 831 C 10 H 22 декан 75 366 319
 II. Хомологични групи от органични съединения с една и съща структура с едни и същи функционални групи, различаващи се една от друга по броя на -СН2 - групи във въглеродната верига, образуват хомоложна серия. Хомоложни серии от метан
II. Хомологични групи от органични съединения с една и съща структура с едни и същи функционални групи, различаващи се една от друга по броя на -СН2 - групи във въглеродната верига, образуват хомоложна серия. Хомоложни серии от метан
 III. Изологични редове. Това са поредица от вещества, изградени от същия брой въглеродни атоми, но се различават по количествения състав на Н атомите, т.е. всеки следващ член от поредицата съдържа 2 Н атоми по-малко от предишния: C 2 H 6 етан C 2 H 4 етилен C 2 Н2 ацетилен
III. Изологични редове. Това са поредица от вещества, изградени от същия брой въглеродни атоми, но се различават по количествения състав на Н атомите, т.е. всеки следващ член от поредицата съдържа 2 Н атоми по-малко от предишния: C 2 H 6 етан C 2 H 4 етилен C 2 Н2 ацетилен






 Структурна изомерия 3. Тавтомерия (прототропна или динамична изомерия) Тавтомеризмът (от гръцки ταύτίς - същото и μέρος - мярка) е феноменът на съвместното съществуване на две изомерни форми, които са в подвижно равновесие и са способни спонтанно да се трансформират една в друга.
Структурна изомерия 3. Тавтомерия (прототропна или динамична изомерия) Тавтомеризмът (от гръцки ταύτίς - същото и μέρος - мярка) е феноменът на съвместното съществуване на две изомерни форми, които са в подвижно равновесие и са способни спонтанно да се трансформират една в друга.







Src \u003d "https://present5.com/presentation/73124296_273676330/image-22.jpg" alt \u003d "(! LANG: Конформация\u003e C ------- C Конформация\u003e C ------- C
 Геометрична изомерия Геометричните изомери - имат един и същ ред (последователност) от връзки в молекула, но се различават по разположението на атомите (групите) в пространството спрямо равнината на двойна връзка или малък цикъл.
Геометрична изомерия Геометричните изомери - имат един и същ ред (последователност) от връзки в молекула, но се различават по разположението на атомите (групите) в пространството спрямо равнината на двойна връзка или малък цикъл.
Src \u003d "https://present5.com/presentation/73124296_273676330/image-24.jpg" alt \u003d "(! LANG: Cis и транс изомери на бутен-2 Всеки атом\u003e C \u003d C Cis и транс изомери бутен-2 Всеки атом\u003e C \u003d C
 „От тази и от другата страна“ на река Leita Cisleitania - името на земите от австрийската корона; показано в червено; 1867 -1918 Translatedia - името на земите на унгарската корона; показано в зелено
„От тази и от другата страна“ на река Leita Cisleitania - името на земите от австрийската корона; показано в червено; 1867 -1918 Translatedia - името на земите на унгарската корона; показано в зелено




 E, Z-номенклатура 2 1 E-1-нитро-1-бромо-2-хлоропентен 1 2 Z-1-нитро-1-бромо-2-хлоропентен 1. Използвайки правилата на Cahn-Ingold-Prelog, определете относителния приоритет на заместителите, свързани с двойна връзка и им дайте приоритетни числа 1 или 2.
E, Z-номенклатура 2 1 E-1-нитро-1-бромо-2-хлоропентен 1 2 Z-1-нитро-1-бромо-2-хлоропентен 1. Използвайки правилата на Cahn-Ingold-Prelog, определете относителния приоритет на заместителите, свързани с двойна връзка и им дайте приоритетни числа 1 или 2.
 а) Атомът с по-висок атомен номер е най-високият спрямо атома с по-ниския номер. б) Ако два атома са изотопи, тогава атомът с голямо масово число има предимството. 2. Ако двете най-старши групи са разположени от една и съща страна на равнината на π-връзката, тогава конфигурацията на заместителите се обозначава със символа Z. (от немски zusammen заедно) Ако тези групи са на противоположни страни на равнината на π-връзката, тогава конфигурацията се обозначава със символа E от немски entgegen отсреща)
а) Атомът с по-висок атомен номер е най-високият спрямо атома с по-ниския номер. б) Ако два атома са изотопи, тогава атомът с голямо масово число има предимството. 2. Ако двете най-старши групи са разположени от една и съща страна на равнината на π-връзката, тогава конфигурацията на заместителите се обозначава със символа Z. (от немски zusammen заедно) Ако тези групи са на противоположни страни на равнината на π-връзката, тогава конфигурацията се обозначава със символа E от немски entgegen отсреща)



 Луи Пастьор (27.12.1822-28.09.1895) Френски химик, най-големият изследовател на XIX век "Асиметрията е това, което отличава органичното от неорганичното" (този закон поставя основите на стереохимията). Асиметричните кристали имат способността да въртят поляризирана светлина.
Луи Пастьор (27.12.1822-28.09.1895) Френски химик, най-големият изследовател на XIX век "Асиметрията е това, което отличава органичното от неорганичното" (този закон поставя основите на стереохимията). Асиметричните кристали имат способността да въртят поляризирана светлина.
 Енантиомерите са пространствени изомери, молекулите на които са свързани помежду си като обект и несъвместимо огледално изображение. (от гръцки enantios - обратното).
Енантиомерите са пространствени изомери, молекулите на които са свързани помежду си като обект и несъвместимо огледално изображение. (от гръцки enantios - обратното).
 Хиралността (от гръцки chéir - ръка) е понятие в химията, което характеризира свойството на обекта да бъде несъвместимо с отражението му в идеално плоско огледало.
Хиралността (от гръцки chéir - ръка) е понятие в химията, което характеризира свойството на обекта да бъде несъвместимо с отражението му в идеално плоско огледало.






 Фишер Емил Херман (9.10.1852, Айскирхен, - 15.7.1919, Берлин), немски биохимик и биохимик.
Фишер Емил Херман (9.10.1852, Айскирхен, - 15.7.1919, Берлин), немски биохимик и биохимик.


 Прогнозите на Фишер могат да бъдат трансформирани: l l 1. четен брой пермутации на заместители не променя формулата; 2. нечетен брой пермутации на заместители води до формулата на антипод (енантиомер); 3. забранено е да се завърта формулата на 90 или 270, както и да се извежда формулата от тази равнина (тези действия водят до антиподната формула); 4. допуска се завъртане на цялата формула в равнината на чертежа на 180;
Прогнозите на Фишер могат да бъдат трансформирани: l l 1. четен брой пермутации на заместители не променя формулата; 2. нечетен брой пермутации на заместители води до формулата на антипод (енантиомер); 3. забранено е да се завърта формулата на 90 или 270, както и да се извежда формулата от тази равнина (тези действия водят до антиподната формула); 4. допуска се завъртане на цялата формула в равнината на чертежа на 180;
 Относителна конфигурация през 1906 г., по предложение на М. А. Розанов L- и D-изомери (от латинските думи laevus - ляво и dexter - дясно).
Относителна конфигурация през 1906 г., по предложение на М. А. Розанов L- и D-изомери (от латинските думи laevus - ляво и dexter - дясно).



 Системата Cahn - Ingold - Prelog? Робърт Сидни Кан Инголд Кристофър Прелог Владимир (09.06.1899-15.09.1981) (28.10.1893-8.10.1970) (23.07.1906-07.01.1998) (Великобритания) ( Швейцария)
Системата Cahn - Ingold - Prelog? Робърт Сидни Кан Инголд Кристофър Прелог Владимир (09.06.1899-15.09.1981) (28.10.1893-8.10.1970) (23.07.1906-07.01.1998) (Великобритания) ( Швейцария)



 Общият брой на оптичните изомери се определя по формулата N \u003d 2 n, n е броят на хиралните центрове. I III IV 2 -амино-3-хидроксибутанова киселина
Общият брой на оптичните изомери се определя по формулата N \u003d 2 n, n е броят на хиралните центрове. I III IV 2 -амино-3-хидроксибутанова киселина
 Винена киселина I III IV еритро трео Епимерите са диастереомери, различаващи се по конфигурация само на един асиметричен център
Винена киселина I III IV еритро трео Епимерите са диастереомери, различаващи се по конфигурация само на един асиметричен център

 Рацемат (от латински racemus - грозде). При смесване на еквимоларни количества D - и L - стереизомери се образуват оптически неактивни смеси, наречени рацемични S (от лат. Sinister - ляво) и R (лат. Rectus - дясно); рацематът е обозначен със символа RS. Разлагане на рацемични смеси: 1. Механичен метод (метод на Пастьор). 2. Микробиологичен метод 3. Ензимен метод. 4. Химичен метод. Афинитетна хроматография
Рацемат (от латински racemus - грозде). При смесване на еквимоларни количества D - и L - стереизомери се образуват оптически неактивни смеси, наречени рацемични S (от лат. Sinister - ляво) и R (лат. Rectus - дясно); рацематът е обозначен със символа RS. Разлагане на рацемични смеси: 1. Механичен метод (метод на Пастьор). 2. Микробиологичен метод 3. Ензимен метод. 4. Химичен метод. Афинитетна хроматография
 ВЗАИМООТНОШЕНИЕ НА СТЕРЕОХИМИЧНАТА СТРУКТУРА С ПРОЯВЯВАНЕТО НА БИОЛОГИЧНАТА ДЕЙНОСТ. Адреналин, епинефрин IUPAC: 1 - (3,4-дихидроксифенил) -2 метиламиноетанол е хормон на надбъбречната медула на животни и хора. Посредник на хладнокръвната нервна система. От двата енантиомера на адреналина, R (-) адреналинът проявява най-голяма фармакологична активност.
ВЗАИМООТНОШЕНИЕ НА СТЕРЕОХИМИЧНАТА СТРУКТУРА С ПРОЯВЯВАНЕТО НА БИОЛОГИЧНАТА ДЕЙНОСТ. Адреналин, епинефрин IUPAC: 1 - (3,4-дихидроксифенил) -2 метиламиноетанол е хормон на надбъбречната медула на животни и хора. Посредник на хладнокръвната нервна система. От двата енантиомера на адреналина, R (-) адреналинът проявява най-голяма фармакологична активност.

 ВЗАИМООТНОШЕНИЕ НА СТЕРЕОХИМИЧНАТА СТРУКТУРА С ПРОЯВЯВАНЕТО НА БИОЛОГИЧНАТА ДЕЙНОСТ. правовъртящият изопропиладреналин (изодрин) проявява 800 пъти по-мощен бронходилататорен ефект от неговия левовъртящ се енантиомер.
ВЗАИМООТНОШЕНИЕ НА СТЕРЕОХИМИЧНАТА СТРУКТУРА С ПРОЯВЯВАНЕТО НА БИОЛОГИЧНАТА ДЕЙНОСТ. правовъртящият изопропиладреналин (изодрин) проявява 800 пъти по-мощен бронходилататорен ефект от неговия левовъртящ се енантиомер.

 Диастереомерите са пространствени изомери, молекулите на които НЕ се отнасят помежду си като обект и несъвместимо огледално изображение.
Диастереомерите са пространствени изомери, молекулите на които НЕ се отнасят помежду си като обект и несъвместимо огледално изображение.

 Конформационна изомерия Конформационната изомерия възниква в резултат на различно подреждане на части от една и съща молекула една спрямо друга, постигнато чрез завъртане на тези части около обикновена С-С връзка, свързваща два атома.
Конформационна изомерия Конформационната изомерия възниква в резултат на различно подреждане на части от една и съща молекула една спрямо друга, постигнато чрез завъртане на тези части около обикновена С-С връзка, свързваща два атома.
 (от лат. conformatio - форма, местоположение), различни пространствени форми, взети от молекулите в резултат на свободно въртене на отделни фрагменти около прости С-С връзки.
(от лат. conformatio - форма, местоположение), различни пространствени форми, взети от молекулите в резултат на свободно въртене на отделни фрагменти около прости С-С връзки.







 69% 31% Стресът на Ван дер Ваалс се дължи на силите на отблъскване между валентните заместители с голям обем.
69% 31% Стресът на Ван дер Ваалс се дължи на силите на отблъскване между валентните заместители с голям обем.
Изомеризъм на лигандите
Изомеризъм на лигандитесе подразделя на връзка (която се определя от различни видове координация на един и същ лиганд) и действителната изомерия на лиганда.
Примери за изомеризъм на връзките са съществуването на нитро- и нитритни комплекси на кобалт (III) със състав K 3 и K 3, при които координацията на NO 2 - лиганда се осъществява, съответно, чрез азотен атом или кислороден атом. Друг пример е координацията на тиоцианатния йон NCS - чрез азотен атом или чрез серен атом, с образуването на тиоцианато-N- или тиоцианато-S-комплекси.
Освен това лигандите със сложна структура (например аминокиселини) могат сами да образуват изомери, чиято координация води до образуването на комплекси от един и същ състав с различни свойства.
Геометрична изомерия причинени от неравномерното разпределение на лигандите във вътрешната сфера един спрямо друг. Необходимо условие за геометричната изомерия е наличието на поне два различни лиганда във вътрешната координационна сфера. Геометричната изомерия се проявява главно в сложни съединения с октаедрична структура, плоска квадратна или квадратна пирамидална структура.
Сложните съединения с тетраедрични, триъгълни и линейни структури нямат геометрични изомери, тъй като местоположението на лигандите от два различни типа около централния атом са еквивалентни.
Комплексите с плоска квадратна структура, в присъствието на два различни лиганда L 'и L', вече могат да имат два изомера (cis- и trans-):
Пример за комплексно съединение с цис и транс изомери е дихлордиаминплатина (II):
Обърнете внимание, че сложно съединение от състава с плоска квадратна структура не може да има изомери: положението на лиганда L '' е еднакво вероятно във всеки ъгъл на квадрата. Когато се появят два различни лиганда, тогава вече е възможно съществуването на два изомера (cis и trans), различни по свойства. По този начин, цис-дихлордиаминплатина (II) е оранжево-жълти кристали, лесно разтворими във вода, а транс-дихлордиаминплатина (II) е бледожълти кристали, чиято разтворимост във вода е малко по-ниска от тази на цис изомера.
С увеличаването на броя на различните лиганди във вътрешната сфера, броят на геометричните изомери се увеличава. За нитро (хидроксиламин) амин (пиридин) платина (II) Cl хлорид бяха получени и трите изомера:
Октаедричните комплекси могат да имат много изомери. Ако в сложно съединение от този вид всичките шест лиганда са еднакви () или само един се различава от всички останали (), тогава няма възможност за различно подреждане на лигандите по отношение един на друг. Например, в октаедричните съединения, всяко положение на L '' лиганда по отношение на останалите пет L 'лиганди ще бъде еквивалентно и следователно не трябва да има изомери:
Поява две лиганди L ′ ′ в октаедриченсложни съединения ще доведат до възможността за съществуване два геометрични изомера... В този случай има два различни начина за подреждане на лигандите L '' един спрямо друг. Например, катионът на дихидроксотетрааминокобалт (III) + има два изомера:
Когато се опитваме да намерим някакво друго взаимно подреждане на лигандите H 3 N и OH -, което би се различавало от посочените по-горе, винаги ще стигаме до структурата на един от вече дадените.
С увеличаване на броя на лигандите с различен химичен състав в комплекса, броят на геометричните изомери се увеличава бързо. Съединенията от типа ще имат четири изомера, а за съединения от типа, съдържащи шест различни лиганда, броят на геометричните изомери достига 15. Такива сложни съединения все още са слабо разбрани.
Геометричните изомери се различават значително по своите физикохимични свойства, като цвят, разтворимост, плътност, кристална структура и др.
1. Структурна изомерия.
2. Конформационна изомерия.
3. Геометрична изомерия.
4. Оптична изомерия.
Изомери Представляват вещества, които имат еднакъв състав и молекулно тегло, но различни физични и химични свойства. Различията в свойствата на изомерите се дължат на разликите в тяхната химическа или пространствена структура. В тази връзка се разграничават два вида изомерия.
изомерия
структурна
пространствена
Въглероден скелет
Конфигурация
Конформационен
Функционална позиция
Оптични
Интерклас
Геометрични
1. Структурна изомерия
Структурните изомери се различават по химична структура, т.е. естеството и последователността на връзките между атомите в молекулата. Структурните изомери са изолирани в чист вид. Те съществуват като отделни, стабилни вещества, за тяхната взаимна трансформация е необходима висока енергия - около 350 - 400 kJ / mol. Само структурни изомери - тавтомери - са в динамично равновесие. Тавтомерията е често срещано явление в органичната химия. Възможно е с прехвърляне на подвижен водороден атом в молекула (карбонилни съединения, амини, хетероцикли и др.), Вътремолекулни взаимодействия (въглехидрати).
Всички структурни изомери са представени под формата на структурни формули и са наименувани от номенклатурата на IUPAC. Например съставът С 4 Н 8 О съответства на структурните изомери:
и) с различен карбонов скелет
неразклонена С-верига - CH 3 -CH 2 -CH 2 -CH \u003d O (бутанал, алдехид) и
разклонена С-верига -
 (2-метилпропанал, алдехид) или
(2-метилпропанал, алдехид) или
цикъл -  (циклобутанол, цикличен алкохол);
(циклобутанол, цикличен алкохол);
б) с различна позиция на функционалната група
 бутанон-2, кетон;
бутанон-2, кетон;
в) с различен състав на функционалната група
 3-бутенол-2, ненаситен алкохол;
3-бутенол-2, ненаситен алкохол;
д) метамеризъм
Хетероатом от функционална група може да бъде включен във въглероден скелет (пръстен или верига). Един от възможните изомери на този тип изомеризъм е СНЗ-О-СН2-СН \u003d СН2 (3-метоксипропен-1, етер);
д) тавтомерия (кето-енол)
енолна форма  кето форма
кето форма
Тавтомерите са в динамично равновесие, докато по-стабилната форма, кето формата, преобладава в сместа.
За ароматните съединения структурната изомерия се разглежда само за страничната верига.
2. Пространствена изомерия (стереоизомерия)
Пространствените изомери имат еднаква химическа структура, различават се по пространственото разположение на атомите в молекулата. Тази разлика създава разликата във физичните и химичните свойства. Пространствените изомери са изобразени като различни проекции или стереохимични формули. Разделът на химията, който изучава пространствената структура и нейното влияние върху физичните и химичните свойства на съединенията, върху посоката и скоростта на техните реакции, се нарича стереохимия.
и)Конформационна (ротационна) изомерия
Без промяна на ъглите на връзката или дължината на връзката, може да си представим множество геометрични форми (конформации) на молекула, които се различават една от друга чрез взаимното въртене на въглеродните тетраедри около свързващата ги връзка σ-C-C. Това въртене поражда ротационни изомери (конформери). Енергиите на различните конформери не са еднакви, но енергийната бариера, разделяща различни конформационни изомери, е малка за повечето органични съединения. Следователно, при нормални условия, като правило, е невъзможно да се фиксират молекули в една строго определена конформация. Обикновено в равновесие съжителстват няколко конформационни изомера, лесно преминаващи един в друг.
Методите за изобразяване и номенклатурата на изомерите могат да бъдат разгледани на примера на молекулата на етана. За него може да се предвиди съществуването на две конформации, които са максимално различни по енергия, които могат да бъдат изобразени във формата перспективни прогнози (1) ("дъскорезница") или издатини Нов мъж(2):

забавена конформация запушена конформация
В перспективната проекция (1) връзката С-С трябва да бъде представена да се отдалечава; въглеродният атом отляво е по-близо до наблюдателя, а този отдясно е отдалечен от него.
В проекцията на Нюман (2) молекулата се разглежда по протежение на С-С връзката. Три линии, разминаващи се под ъгъл от 120 ° от центъра на кръга, показват връзките на въглеродния атом, най-близо до наблюдателя; линиите, „изпъкнали“ от кръга, са връзките на отдалечения въглероден атом.
Извиква се конформацията, показана вдясно затъмнено ... Това име ни напомня, че водородните атоми и на двете СН3 групи са противоположни един на друг. Препятстваната конформация е увеличила вътрешната енергия и следователно е в неблагоприятно положение. Извиква се конформацията, показана вляво инхибиран , което означава, че свободното въртене около връзката C-C е "инхибирано" в това положение, т.е. молекулата съществува предимно в тази конформация.
Минималната енергия, необходима за пълно завъртане на молекула около определена връзка, се нарича бариера на въртене за тази връзка. Въртящата се бариера в молекула като етан може да се изрази чрез промяната в потенциалната енергия на молекулата като функция от промяната в двугранния (торсион - τ) ъгъл на системата. Енергийният профил на въртене около връзката C - C в етан е показан на фигура 1. Въртящата се бариера, разделяща двете форми на етан, е около 3 kcal / mol (12.6 kJ / mol). Минимумите на кривата на потенциалната енергия съответстват на инхибираните конформации, а максимумите - на затъмнените. Тъй като при стайна температура енергията на някои сблъсъци на молекули може да достигне 20 kcal / mol (около 80 kJ / mol), тази бариера от 12,6 kJ / mol лесно се преодолява и въртенето в етана се счита за свободно. В смес от всички възможни конформации преобладават инхибираните конформации.

Фиг. 1. Диаграма на потенциалната енергия на конформациите на етан.
За по-сложни молекули броят на възможните конформации се увеличава. Така че, за н-бутан, вече могат да бъдат изобразени шест конформации, които възникват при завъртане около централната връзка C2 - C3 и се различават по взаимното разположение на CH3 групите. Различните запушени и забавени конформации на бутан се различават по енергия. Забавените конформации са енергийно по-благоприятни.

Енергийният профил на въртене около C 2 -C 3 връзката в бутан е показан на фигура 2.

Фиг. 2. Диаграма на потенциалната енергия на n-бутановите конформации.
За молекула с дълга въглеродна верига броят на конформационните форми се увеличава.
Молекулата на алицикличните съединения се характеризира с различни конформационни форми на пръстена (например за циклохексан фотьойл, баня, обрат-форми).
И така, конформациите са различни пространствени форми на молекула с определена конфигурация. Конформерите са стереоизомерни структури, които съответстват на енергийните минимуми на диаграмата на потенциалната енергия, са в мобилно равновесие и са способни на взаимно преобразуване чрез въртене около прости σ-връзки.
Ако бариерата за такива трансформации стане достатъчно висока, тогава стереоизомерните форми могат да бъдат разделени (например оптично активни бифенили). В такива случаи вече не се говори за конформери, а за действително съществуващи стереоизомери.
б) Геометрична изомерия
Геометричните изомери са резултат от липсата на:
1. въртене на въглеродните атоми един спрямо друг - следствие от твърдостта на двойната връзка C \u003d C или циклична структура;
2. две еднакви групи при един въглероден атом с двойна връзка или цикъл.
Геометричните изомери, за разлика от конформерите, могат да бъдат изолирани в чист вид и да съществуват като отделни, стабилни вещества. За тяхната взаимна трансформация е необходима по-висока енергия - около 125-170 kJ / mol (30-40 kcal / mol).
Има цис-транс (Z, E) изомери; цис- формите са геометрични изомери, в които едни и същи заместители лежат от едната страна на равнината на π-връзката или пръстена, транс- формите са геометрични изомери, в които едни и същи заместители лежат от противоположните страни на равнината на π-връзката или пръстена.
Най-простият пример е изомерите на бутен-2, който съществува под формата на цис-, транс-геометрични изомери:


цис-бутен-2 транс-бутен-2
температура на топене
138,9 ° С - 105,6 0 ° С
температура на кипене
3,72 0 ° С 1,00 0 ° С
плътност
1,2 - дихлороциклопропан съществува под формата на цис-, транс-изомери:


цис-1,2-дихлороциклопропан транс-1,2-дихлороциклопропан
В по-сложни случаи кандидатствайте Z., Е-номенклатура (номенклатура на Kann, Ingold, Prelog - KIP, номенклатура на старшинството на депутатите). Във връзка
1-бромо -2-метил-1-хлорбутен-1 (Br) (CI) C \u003d C (CH3) - CH2-CH3 всички заместители на въглеродните атоми с двойна връзка са различни; следователно, това съединение съществува под формата на Z-, E- геометрични изомери:


Е-1-бромо-2-метил-1-хлорбутен-1 Z-1-бромо-2-метил-1-хлорбутен-1.
За да посочите конфигурацията на изомера, посочете местоположението на старшите заместители при двойната връзка (или цикъл) - Z- (от немския Zusammen - заедно) или E- (от немския Entgegen - отсреща).
В Z, E-системата заместителите с голям атомен номер се считат за старши. Ако атомите, свързани директно с ненаситени въглеродни атоми, са еднакви, те преминават към „втория слой“, ако е необходимо, към „третия слой“ и т.н.
В първата проекция по-старите групи са една срещу друга спрямо двойната връзка, така че това е Е-изомерът. Във втората проекция по-старите групи са разположени от едната страна на двойната връзка (заедно), така че това е Z изомерът.
Геометричните изомери са широко разпространени в природата. Например, естествените полимери са каучук (цис изомер) и гутаперча (транс изомер), естествена фумарова (транс-бутениева киселина) и синтетична малеинова (цис-бутениева киселина) киселини, в състава на мазнините има цис-олеинова, линолова, линоленова киселини.
в) Оптична изомерия
Молекулите на органичните съединения могат да бъдат хирални и ахирални. Хиралността (от гръцки. Сheir - ръка) е несъвместимостта на молекулата с нейния огледален образ.
Хиралните вещества са способни да въртят равнината на поляризация на светлината. Това явление се нарича оптична активност и съответните вещества - оптично активен... Оптично активните вещества се срещат като двойки оптични антиподи - изомери, чиито физични и химични свойства са еднакви при нормални условия, с изключение на един - знакът на въртене на равнината на поляризация: един от оптичните антиподи отклонява равнината на поляризация надясно (+, правовъртящ изомер), а другият наляво (-, левогират). Конфигурацията на оптичните антиподи може да се определи експериментално с помощта на инструмент - поляриметър.
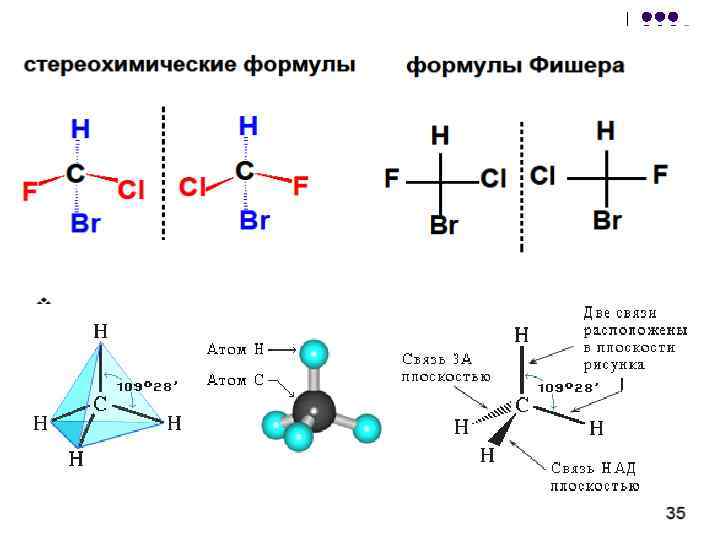
Оптичната изомерия се появява, когато молекулата съдържа асиметричен въглероден атом(има и други причини за хиралността на молекулата)... Това е името на въглеродния атом в sp 3 - хибридизация и свързано с четири различни заместители. Има две възможни тетраедрични разположения на заместители около асиметричния атом. В този случай двете пространствени форми не могат да се комбинират с никакво въртене; единият от тях е огледален образ на другия:

И двете огледални форми съставят чифт оптични антиподи или енантиомери .
Оптичните изомери са изобразени под формата на проекционните формули на E. Fischer. Те се получават чрез проектиране на молекула с асиметричен въглероден атом. В този случай самият асиметричен въглероден атом на равнината е обозначен с точка, на хоризонталната линия са посочени символите на заместителите, изпъкнали пред равнината на чертежа. Вертикалната линия (пунктирана или плътна) показва заместители, които се отстраняват извън равнината на фигурата. Следват различни начини за писане на прожекционната формула, съответстваща на левия модел на предишната фигура:

В проекция основната въглеродна верига е показана вертикално; основната функция, ако е в края на веригата, е посочена в горната част на проекцията. Например, стереохимичните и проекционните формули на (+) и (-) аланин - CH 3 - * CH (NH 2) -COOH са представени, както следва:

Смес със същото енантиомерно съдържание се нарича рацемат. Рацематът няма оптична активност и се характеризира с физични свойства, различни от енантиомерите.
Правила за преобразуване за проекционни формули.
1. Формулите могат да се завъртат в равнината на чертежа на 180 °, без да се променя тяхното стереохимично значение:

2. Две (или произволен четен брой) пермутации на заместители при един асиметричен атом не променят стереохимичното значение на формулата:

3. Една (или произволен нечетен брой) пермутация на заместители в асиметричния център води до формулата за оптичния антипод:

4. Завъртане в равнината на чертежа на 90 градуса превръща формулата в антипод.
5. Въртенето на произволни три заместителя по посока на часовниковата стрелка или обратно на часовниковата стрелка не променя стереохимичното значение на формулата:
 6. Проекционни формули не могат да бъдат извлечени от равнината на чертежа.
6. Проекционни формули не могат да бъдат извлечени от равнината на чертежа.
Органичните съединения имат оптична активност, в молекулите на които други атоми са хирални центрове, например силиций, фосфор, азот, сяра.
Във формата съществуват съединения с няколко асиметрични въглеродни атома диастереомери , т.е. пространствени изомери, които не образуват оптични антиподи помежду си.
Диастереомерите се различават един от друг не само по оптично въртене, но и по всички други физически константи: те имат различни точки на топене и кипене, различна разтворимост и т.н.
Броят на пространствените изомери се определя от формулата на Фишер N \u003d 2 n, където n е броят на асиметричните въглеродни атоми. Броят на стереоизомерите може да намалее поради появата на частична симетрия в някои структури. Извикват се оптично неактивни диастереомери мезо-форми.
Номенклатура на оптичните изомери:
а) D-, L- номенклатура
За да се определи D- или L-серията на изомера, конфигурацията (положението на OH групата при асиметричния въглероден атом) се сравнява с конфигурациите на енантиомерите на глицералдехид (глицеролов ключ):

L-глицералдехид D-глицеринов алдехид
Понастоящем използването на D-, L-номенклатурата е ограничено до три класа оптично активни вещества: въглехидрати, аминокиселини и хидрокси киселини.
б) R -, S-номенклатура (номенклатура Kahn, Ingold и Prelog)
За да се определи R (вдясно) или S (вляво) конфигурация на оптичен изомер, е необходимо да се подредят заместителите в тетраедъра (стереохимична формула) около асиметричния въглероден атом по такъв начин, че най-ниският заместител (обикновено водород) да има посоката „от наблюдателя“. Ако преходът на останалите три заместители от старши към среден и младши по старшинство се случи по посока на часовниковата стрелка, това е R-изомерът (спадът в старшинството съвпада с движението на ръката при писане на горната част на буквата R). Ако преходът се случи обратно на часовниковата стрелка, това е S - изомер (спадът в предимството съвпада с движението на ръката при писане на горната част на буквата S).
За да се определи R- или S-конфигурацията на оптичния изомер с помощта на проекционната формула, е необходимо заместителите да бъдат подредени с четен брой пермутации, така че най-ниската от тях да е в дъното на проекцията. Спадът в предимството на останалите три заместителя по посока на часовниковата стрелка съответства на R-конфигурацията, а обратно на S-конфигурацията.
Оптичните изомери се получават по следните методи:
а) изолиране от естествени материали, съдържащи оптически активни съединения, например протеини и аминокиселини, въглехидрати, много хидрокси киселини (винена, ябълчена, бадемова), терпенови въглеводороди, терпенови алкохоли и кетони, стероиди, алкалоиди и др.
б) разцепване на рацемати;
в) асиметричен синтез;
г) биохимично производство на оптично активни вещества.
ЗНАЕШ ЛИ ТОВА
Феноменът на изомеризма (от гръцки - isos - различни и мерос - акция, част) отворена през 1823 г. J. Liebig и F. Wöhler, използвайки примера на соли на две неорганични киселини: цианова H-O-C≡N и експлозивна H-O-N \u003d C.
През 1830 г. J. Dumas разширява концепцията за изомерия до органични съединения.
През 1831г. терминът "изомер" за органични съединения е предложен от J. Berzelius.
Стереоизомерите на природните съединения се характеризират с различна биологична активност (аминокиселини, въглехидрати, алкалоиди, хормони, феромони, лекарствени вещества от естествен произход и др.).
Геометричните изомери са цис-транс изомеризъм или EZ изомерия. Техните действия се основават на ограничено въртене на въглеродни двойни или единични връзки в циклични съединения.В циклично съединение въртенето между въглеродната единична връзка е ограничено и две различни групи са прикрепени към всеки въглероден изомер по подобен начин. Такива геометрични изомери често се различават по своите физични свойства. Това се дължи на формата на изомерите и общия диполен момент. Ако двата атома с най-висок приоритет останат от една и съща страна на изомера, тогава те са обозначени като Z, а ако са от противоположната страна, E.
Кратка история на изомеризма
Концепцията за конституционна изомерия е значителна стъпка напред в историята на съвременната химия и особено в развитието на органичната химия. До края на 1700-те години няколко чисти вещества са изолирани чрез изучаване на "животинска" и "растителна" химия. Много от тях са получени от Карл Вилхелм Шееле (1742-1786). Поради голямото разнообразие от органични съединения, всяко ново вещество представя различен елементен състав, който съответства на обобщеното наблюдение от "минералната" химия. Броят на изолираните органични съединения се увеличава в началото на 1800 г. чрез идентифициране на различни вещества.
В книгата си за историята на химията Томас Томсън пише през 1830 г., че:
Берцелий прилага теорията за атома и към растителното царство, като анализира няколко растителни киселини и показва атомната си конституция, но тук възниква трудност, която в сегашното състояние на нашето познание не можем да преодолеем. Има две киселини, които са съставени от абсолютно еднакви атоми. Сега, как трябва да отчетем тази поразителна разлика в свойствата? Несъмнено по различни начини, по които атомите са разположени във всеки от тях.
Тогава Томсън използва различни схеми от атомни символи, използвани по това време, за да обясни защо две киселини с един и същ елементарен състав, наричани геометрични изомери, имат различни физични и химични свойства.
До началото на 19 век се смяташе, че тези химикали, намиращи се в живите организми, имат особена жизненост, свързана с живите същества, и че те са необходими в живите системи за размножаване. През 1828 г. Wöhler синтезира проба от карбамид, (NH2) 2CO (също CH4N2O), която не може да се различи от карбамид, отделен от биологичната урина.
Той е приготвил това „животинско“ вещество от ясно неорганичен (минералогичен) изходен материал амониев цианат, (NH4) NCO (също CH4N2O), което е резултат от комбинацията на амониев хлорид и сребърен цианат. Така бариерата между „живата“ и „неживата“ изомерия се срина.
В цис изомера две подобни групи остават от едната страна на двойната връзка, докато в транс изомера те остават в противоположната страна. Например, 2-бутенът има два изомера, цис и транс.
В цис изомера две метилови групи и две водородни групи остават от същата страна на двойната връзка, докато в транс изомера те остават от противоположната страна.
Когато една или повече групи, свързани с двойна връзка, не са еднакви, изомерите се наричат \u200b\u200bE или Z. За да уведоми този тип, потребителят ще трябва да посочи формулите на въглеводороди с геометрични изомери и да определи атома с най-висок приоритет (най-голям атомен номер). прикрепена към всяка двойна връзка В. Ако двата атома с най-висок приоритет останат от една и съща страна на изомера, който е означен Z, а ако са на противоположната страна, означен като Е

Например, 1 - бром - 1 - флуоропропан има два изомера. В Z-1 - бром - 1 - флуоропропан може да се види, че бромът има по-висок приоритет или по-голям атомен номер (35) от флуора (9), които са прикрепени към C-1. Въглеродът има по-високо атомно число (6) от водорода (1), който е прикрепен към С-2 на това съединение. Тъй като въглеродните атоми с най-висок приоритет (от групата -CH3) и брома, прикрепени към тези два въглеродни атома, са от едната страна, това съединение се определя като Z. От друга страна, в E-1 - бром - 1 - флуоропропан, атомите с най-висок приоритетът на С и брома са от противоположната страна, поради което се нарича Е-изомер.
Двойна връзка въглерод-въглерод
Изомерите са две молекули, които имат еднакъв атомен състав, но не са идентични. Атомите в двата изомера могат да бъдат свързани в различен ред (структурна изомерия), или те могат да бъдат свързани по същия начин, но имат различна ориентация - пространствена стереоизомерия.
Структурният и геометричен изомер в специални случаи - стереоизомер, трябва да отговаря на две изисквания:
- В молекулата има ограничено въртене.
- И двата атома, участващи в рестриктивната връзка, имат две различни функционални групи за тях.
Често срещан пример за ограничено въртене е двойната връзка въглерод-въглерод. Тези облигации включват връзката pi; в повечето условия разбиването им не е изгодно.

Геометричните изомери имат структура, която засяга физическите свойства на съединението.
Cis / Trans система
Cis / Trans именуването е най-простата система за свързване. Първо се идентифицира най-дългата въглеродна верига в молекулата и след това се идентифицират функционалните групи от интерес. В цис изомера въпросните две групи са от една и съща страна на двойната връзка (cis означава "от една и съща страна" на латински). В транс изомера двете разглеждани групи са от противоположните страни на двойната връзка (транс означава на латински език). Например два различни геометрични изомера на бутен-2.

И двата атома с двойна връзка имат същите две групи като тези две групи, но те са различни един от друг в един от двойните въглероди. Предизвикателството става по-сложно, тъй като страничните вериги и функционалните групи стават по-сложни.
Официалната система за именуване на IUPAC използва обозначението E / Z. Няма конкретна връзка между cis / trans и E / Z и двете системи не са взаимозаменяеми. Обозначението E / Z използва правилата за приоритет на Cahn-Ingold-Prelog и се счита за по-надеждно. Името на IUPAC за фумарова киселина е транс-изомерът с формула HO2CCH \u003d CHCO2H, а малеиновата киселина е цис-бутениева киселина.

IUPAC е Международният съюз за чиста и приложна химия, който определя международни правила и стандарти за именуване на химикали на всички езици.
При циклична връзка въртенето между въглеродната единична връзка е ограничено. По този начин изомеризмът е възможен и за този вид съединение, ако към всеки въглерод са прикрепени две различни групи. Има два изомера на 1,2-диметилциклопропан.

Единият е цис изомерът, където две метилови групи са от едната страна, а другият е транс изомерът, където две метилови групи са от другата страна.
Геометричните изомери се различават по своите физични свойства. Това се дължи на формата на изомерите и общия диполен момент. Например, те се различават по точката на кипене. Точките на кипене на цис и транс изомерите на 1,2-дихлороетилен са съответно 60,3 ° С и 47,5 ° С.
В цис изомера присъствието на две диполни връзки (C-Cl) дава общ молекулен дипол. Това води до междумолекулни дипол-диполни сили. За тази якост цис изомерът има по-висока точка на кипене от транс изомера, където две диполни връзки (C-Cl) се анулират поради тяхното положение в обратна посока.
Причината двойната връзка въглерод-въглерод да не може да се завърти е, че има две връзки, свързващи въглеродните атоми заедно и връзката pi трябва да се прекъсне. Връзките pi се образуват чрез странично припокриване между p-орбитали. Ако човек се опита да завърти двойната връзка въглерод-въглерод, р-орбиталите вече няма да се подредят и следователно връзката pi ще бъде прекъсната. Това отнема енергия и това се случва само ако връзката е много гореща.
Много е лесно да се пренебрегнат важни елементи на геометрични изомери при конструиране на структурни формули по време на свиване. Например, много е изкушаващо да нарисувате but-2-ene; ако потребителят го напише погрешно, съединението вече няма да бъде изомер. Ако има дори и най-малък намек, че може да се използва изомер, винаги е необходимо да се използват съединения, съдържащи двойни връзки въглерод-въглерод, показващи правилни ъгли (120 °) около въглеродните атоми в краищата на връзката. С други думи, трябва да използвате формата, показан на фигурата.

Съединенията, съдържащи двойна връзка въглерод-въглерод имат ограничено въртене. За да се получат изомери, трябва да бъдат изпълнени следните предпоставки:
- ограничено въртене, обикновено включващо двойна връзка въглерод-въглерод;
- две различни групи в левия край на връзката и две различни групи в десния край.
Няма значение дали левите групи са същите като десните или не.
Геометричните изомери на алкени включват редица съединения, които са съставени от атоми С и Н във въглеродната верига. Тази група включва хомоложни серии с формулата CnH2n. Най-простият алкен е етенът, той има два С атома и формулата C2H4.

Структурната формула за етен е показана на фигурата по-горе. В по-дългите алкенови вериги допълнителни въглеродни атоми са прикрепени един към друг само чрез ковалентни връзки. Всеки въглероден атом също е прикрепен към достатъчно водородни атоми, за да образува общо четири единични ковалентни връзки.
Във веригите с четири или повече С атома двойната връзка може да бъде разположена в различни позиции, което води до образуването на структурни изомери. В допълнение към структурните изомери, алкените образуват и стереоизомери. Тъй като въртенето около множествената връзка е ограничено, групите, прикрепени към атомите с двойна връзка, винаги остават в едни и същи относителни позиции.
Тези "заключени" позиции позволяват на химиците да идентифицират различни изомери от заместители, за да определят кое вещество има геометрични изомери. Например, един структурен изомер на C5H10 има следните стереоизомери.

Изомерът отляво, в който два заместителя (метилова и етилова групи) са от едната страна на двойната връзка, се нарича цис изомер, докато изомерът вдясно с два неводородни заместителя от противоположните страни е транс изомерът.
Например хлорът има предимство, защото е по-тежък. От дясната страна брома превъзхожда въглерода. Трето, определят се позициите на два по-високо класирани атома. Ако два атома са в позиция cis, подредбата е Z (от немското zusammen, което означава "заедно"). Ако атомите или групите са в транс позицията, подреждането е E (от немския entgegen, което означава „противоположно“).
Геометричните изомери бутен е твърд алкен с двойна връзка. Това означава, че всъщност има четири изомера, а не три, в позицията на двойна връзка. Има пети и шести въглеводород със същия състав, но те не са алкени, въпреки същата формула.

Образуването на пръстени на циклобутан или метилциклопропан заема пространството на два водородни атома като двойна връзка, което води до факта, че те имат формули, идентични с различните бутени.
Примери за геометрични изомери:
- 1-бутилен (1-бутен);
- изо-бутилен (2-метил-пропен);
- цис-2-бутилен (цис-2-бутен);
- транс-2-бутилен (транс-2-бутен).
И бонусите: циклобутан и метилциклопропан - и двата имат същата емпирична формула като бутеновите изомери, но не са алкени. Първото име е „често срещано“ или „тривиално“ име, а името в скоби е името на IUPAC.
Бутенът има много приложения, от гориво в кола до чанти за хранителни стоки, които се носят всеки ден от стотици милиони хора по целия свят. Химичната формула за бутен е C4H8, което означава, че той има четири С атома и осем Н атома, съединението се отнася до алкен.
Има няколко различни изомери или молекулни структури, които това съединение може да образува (имената на IUPAC са показани в скоби):
- алфа-бутилен (но-1-ен);
- цис-бета-бутилен - ((2Z) -бут-2-ен);
- транс-бета-бутилен - ((2Е) -бут-2-ен);
- изобутилен (2-метилпроп-1-ен).

Въпреки че всички те имат една и съща формула, структурите им са различни. Връзките между всеки от тези геометрични изомери са предимно конституционни, което означава, че имат еднаква молекулна формула, но различни връзки. Изключение правят цис-бета-бутилен и транс-бета-бутилен.
Много хора знаят, че трансмазнините са вредни за хората, а ненаситените мазнини са полезни за тях. Единствената разлика между тези две мазнини е, че едната има транс-връзка, а другата има цис-връзка, но тази лека диференциация може значително да повлияе на функцията на молекулата.
При цис-бета-бутилен и транс-бета-бутилен атомите са в същия ред, но полярностите са различни. Цис изомерът е полярен с двете СН3 групи от една и съща страна. Това го прави наистина обемист и сложен.Транс изомерът е неполярен, обемни СН3 групи се редуват, което дава повече пространство в молекулата. Това съотношение се нарича цис-транс изомеризъм. Цис изомерите са полярни, докато транс изомерите не са.
Въпреки че всеки от тези изомери на бутен се състои от едни и същи материали, всеки от тях има различни физични свойства. Например точка на кипене:
- Цис-бета-бутилен: 3,7 ° C.
- Транс-бета-бутилен: 0.8 ° C.
- Изобутилен: -6,9 ° C.
- Алфа бутилен: -6,3 ° C.
Материал за производство на пластмаси
Бутените са алкени с четири въглеродни атома, C4H8. Има няколко различни структурни или конфигурационни изомери на бутен, включително геометрични и оптични изомери. И четирите бутена имат сходни физични свойства, като са безцветни газове, тежки във вода, лесно разтворими в етер и алкани. Разликите във физичните свойства се обясняват със структурата на молекулите. Например, cis-But-2-en има по-висока точка на кипене от trans-But-2-en, защото е по-силен дипол.

Двете алкилови групи на цис изомера работят с техния + I ефект в една и съща посока и по този начин се усилват, докато двете алкилови групи на транс изомерите действат в противоположни посоки и по този начин се отслабват. Формулите за въглеводороди с геометрични изомери са посочени съгласно стандартите на IUPAC. But-1-en има толкова ниска точка на топене, тъй като CC е единична връзка между втория и третия въглеродни атоми без въртене и етиловата група може да се върти около опората във всички посоки.
Това затруднява класифицирането на молекулата в твърда кристална структура. Останалите три бутена с двойна връзка между 2-ри и 3-ти атоми C са много твърди и могат лесно да бъдат класифицирани в кристални структури. Следователно те имат относително високи точки на топене. Тези аргументи не винаги са валидни, тъй като примерът показва 2-метил-но-2-ен (или изобутен). Двете метилови групи с техните + I-ефекти действат в същата посока като cis-But-2-en и всъщност трябва да бъдат подобрени. Въпреки това, изобутенът има много ниска точка на кипене от само -7 ° C.
But-1-en и But-2-ene се използват за получаване на бутадиен и бутан-2-ол. Освен това алкените се използват като алкилиращи агенти. По този начин важното гориво 2,2,4-триметил-пентан, по-известно като изооктан, се получава от изобутен и изобутан. И накрая, бутените са изходният материал за някои пластмаси, тъй като те лесно се полимеризират. Добре известната пластмаса на основата на But-1-en е полибутен-1, от който се правят тръби.
Пентан, н-пентан, изопентан
Пентанът или п-пентанът е един от наситените въглеводороди на алканите. Почти без мирис, н-пентанът е течен при околни условия и е 3-изомерен изомер на херакатехит. Разклонените течни изоалкани C5 - C16 все повече се използват като гориво (Otto, Diesel). Освен това тези алкани присъстват в отоплителните масла и смазочните масла. Те осигуряват пълно изгаряне. Преди да знаете характеристиките на такива съединения, е необходимо да посочите формулите на въглеводородите с геометрични изомери:
- Агрегатното състояние е течно.
- Цветът е безцветен.
- Мирис - почти никакъв.
- Лесно запалим.
- Парите могат да образуват експлозивни смеси, когато са изложени на въздух.
- Разтворимостта във вода е много ниска (практически неразтворима).
- Много нестабилна връзка.
Най-важните източници на пентан са петролните масла, които се различават значително по състав в зависимост от техния произход. Разделянето става чрез фракционна дестилация. Тук се получават следните фракции:
- Парафиново масло (точка на кипене\u003e 320 ° C).
- Масло (точка на кипене 180 до 250 ° C).
- Отопление / дизел (точка на кипене 250 до 320 ° C).
- Суров бензин (точка на кипене до около 180 ° C).
- Разклонените въглеводороди (алкани) от С5 до С10 присъстват в нафтата.
- Изгаряне на пентан с кислород (стехиометрично).
- Крайните продукти са въглероден диоксид и вода. Формули на геометрични изомери: C5H12 + 8O2 ⟹ 5CO2 + 6H2O.
| Калорична стойност HU | Калорична стойност HU [kWh / kg] |
||
Геометричният изомер на пентен-2 е универсален разтворител. Използва се за разпенване на фенолна смола и полистирол. Също така се изисква като еталонно вещество в газовата хроматография и като гориво в спрейове.


 Преобразуване на енергия при хармонични вибрации - Хипермаркет на знанието
Преобразуване на енергия при хармонични вибрации - Хипермаркет на знанието Жизнен път на Чичиков (по стихотворението на Гогол "Мъртви души")
Жизнен път на Чичиков (по стихотворението на Гогол "Мъртви души") Морални проблеми на разказа П
Морални проблеми на разказа П