1 от основните свойства на водата. Физични свойства на водата
Водата (водороден оксид) е прозрачна течност, която няма цвят (в малък обем), мирис и вкус. Химична формула: H2O. В твърдо състояние се нарича лед или сняг, а в газообразно състояние се нарича водна пара. Около 71% от повърхността на Земята е покрита с вода (океани, морета, езера, реки, лед на полюсите).
Той е добър силно полярен разтворител. В естествени условия винаги съдържа разтворени вещества (соли, газове). Водата е от ключово значение за създаването и поддържането на живота на Земята, за химическия строеж на живите организми, за формирането на климата и времето.
Почти 70% от повърхността на нашата планета е заета от океани и морета. Твърда вода - сняг и лед - покрива 20% от сушата. От общото количество вода на Земята, равно на 1 милиард 386 милиона кубически километра, 1 милиард 338 милиона кубически километра се падат на солените води на Световния океан и само 35 милиона кубически километра се падат на дела на пресните води. Общото количество океанска вода би било достатъчно, за да покрие земното кълбо със слой от повече от 2,5 километра. На всеки жител на Земята има приблизително 0,33 кубически километра морска вода и 0,008 кубически километра прясна вода. Но трудността е, че по-голямата част от прясната вода на Земята е в състояние, което затруднява достъпа на хората. Почти 70% от прясната вода се съдържа в ледените покривки на полярните страни и в планинските ледници, 30% е в подземни водоносни хоризонти и само 0,006% от прясната вода се съдържа едновременно в каналите на всички реки. В междузвездното пространство са открити водни молекули. Водата е част от кометите, повечето планети от Слънчевата система и техните спътници.
Съставът на водата (по маса): 11,19% водород и 88,81% кислород. Чистата вода е бистра, без мирис и вкус. Има най-висока плътност при 0°C (1 g/cm3). Плътността на леда е по-малка от плътността на течната вода, така че ледът изплува на повърхността. Водата замръзва при 0°C и кипи при 100°C при налягане 101 325 Pa. Той е лош проводник на топлина и много лош проводник на електричество. Водата е добър разтворител. Молекулата на водата има ъглова форма, водородните атоми образуват ъгъл от 104,5° спрямо кислорода. Следователно водната молекула е дипол: тази част от молекулата, където се намира водородът, е положително заредена, а частта, където се намира кислородът, е отрицателно заредена. Поради полярността на водните молекули, електролитите в нея се дисоциират на йони.
В течната вода, заедно с обикновените молекули H20, има свързани молекули, т.е. комбинирани в по-сложни агрегати (H2O)x поради образуването на водородни връзки. Наличието на водородни връзки между водните молекули обяснява аномалиите на неговите физични свойства: максимална плътност при 4 ° C, висока точка на кипене (в серията H20-H2S - H2Se) аномално висок топлинен капацитет. С повишаването на температурата водородните връзки се разкъсват и пълното разкъсване настъпва, когато водата се превърне в пара.
Водата е силно реактивоспособно вещество. При нормални условия той взаимодейства с много основни и киселинни оксиди, както и с алкални и алкалоземни метали. Водата образува множество съединения - кристални хидрати.
Очевидно съединенията, свързващи водата, могат да служат като десиканти. Други изсушаващи агенти включват P205, CaO, BaO, метален Ma (те също химически взаимодействат с вода) и силикагел. Важно химично свойство на водата е нейната способност да влиза в реакции на хидролитично разлагане.
Физични свойства на водата.
Водата има редица необичайни свойства:
1. Когато ледът се топи, неговата плътност се увеличава (от 0,9 до 1 g/cm³). За почти всички други вещества плътността намалява при стопяване.
2. При нагряване от 0 °C до 4 °C (по-точно 3,98 °C) водата се свива. Съответно, докато се охлажда, плътността намалява. Благодарение на това рибите могат да живеят в замръзващи водоеми: когато температурата падне под 4 ° C, по-студената вода, като по-малко плътна, остава на повърхността и замръзва, а под леда остава положителна температура.
3. Висока температура и специфична топлина на топене (0 °C и 333,55 kJ/kg), точка на кипене (100 °C) и специфична топлина на изпарение (2250 kJ/kg), в сравнение с водородни съединения с подобно молекулно тегло.
4. Висока топлинна мощност на течната вода.
5. Висок вискозитет.
6. Високо повърхностно напрежение.
7. Отрицателен електрически потенциал на водната повърхност.
Всички тези характеристики са свързани с наличието на водородни връзки. Поради голямата разлика в електроотрицателността на водородните и кислородните атоми, електронните облаци са силно изместени към кислорода. Поради това, както и поради факта, че водородният йон (протон) няма вътрешни електронни слоеве и има малки размери, той може да проникне в електронната обвивка на отрицателно поляризиран атом на съседна молекула. Поради това всеки кислороден атом се привлича към водородните атоми на други молекули и обратно. Определена роля играе протонообменното взаимодействие между и вътре във водните молекули. Всяка водна молекула може да участва в максимум четири водородни връзки: 2 водородни атома - всеки в една, и кислороден атом - в две; в това състояние молекулите са в леден кристал. Когато ледът се топи, някои от връзките се разкъсват, което позволява на водните молекули да бъдат опаковани по-плътно; когато водата се нагрява, връзките продължават да се разрушават и нейната плътност се увеличава, но при температури над 4 ° C този ефект става по-слаб от топлинното разширение. Изпарението разрушава всички останали връзки. Разкъсването на връзките изисква много енергия, оттук и високата температура и специфичната топлина на топене и кипене и високият топлинен капацитет. Вискозитетът на водата се дължи на факта, че водородните връзки пречат на водните молекули да се движат с различни скорости.
По подобни причини водата е добър разтворител за полярни вещества. Всяка молекула на разтвореното вещество е заобиколена от водни молекули и положително заредените части на молекулата на разтвореното вещество привличат кислородни атоми, а отрицателно заредените части привличат водородни атоми. Тъй като водната молекула е малка, много водни молекули могат да обграждат всяка молекула на разтвореното вещество.
Това свойство на водата се използва от живите същества. В живата клетка и в междуклетъчното пространство разтворите на различни вещества във вода взаимодействат. Водата е необходима за живота на всички без изключение едноклетъчни и многоклетъчни живи същества на Земята.
Чистата (без примеси) вода е добър изолатор. При нормални условия водата е слабо дисоциирана и концентрацията на протони (по-точно хидрониеви йони H3O+) и хидроксидни йони HO− е 0,1 µmol/l. Но тъй като водата е добър разтворител, някои соли почти винаги са разтворени в нея, тоест във водата присъстват положителни и отрицателни йони. В резултат на това водата провежда електричество. Електрическата проводимост на водата може да се използва за определяне на нейната чистота.
Водата има коефициент на пречупване n=1,33 в оптичния диапазон. Въпреки това, той силно абсорбира инфрачервеното лъчение и следователно водната пара е основният естествен парников газ, отговорен за повече от 60% от парниковия ефект. Поради големия диполен момент на молекулите, водата поглъща и микровълнова радиация, на която се основава принципът на микровълновата фурна.
агрегатни състояния.
1. Според състоянието те разграничават:
2. Твърдо - лед
3. Течност - вода
4. Газообразни - водни пари
Фиг.1 "Видове снежинки"
При атмосферно налягане водата замръзва (превръща се в лед) при 0°C и кипи (превръща се във водна пара) при 100°C. Когато налягането намалява, точката на топене на водата бавно се повишава и точката на кипене пада. При налягане от 611,73 Pa (около 0,006 atm) точките на кипене и топене съвпадат и стават равни на 0,01 ° C. Това налягане и температура се наричат тройна точка на водата. При по-ниско налягане водата не може да бъде в течно състояние и ледът се превръща директно в пара. Температурата на сублимация на леда намалява с намаляване на налягането.
С увеличаване на налягането температурата на кипене на водата се увеличава, плътността на водните пари при точката на кипене също се увеличава и течната вода намалява. При температура от 374 °C (647 K) и налягане от 22,064 MPa (218 atm), водата преминава критичната точка. В този момент плътността и другите свойства на течната и газообразната вода са еднакви. При по-високо налягане няма разлика между течна вода и водна пара, следователно няма кипене или изпарение.
Възможни са и метастабилни състояния - пренаситена пара, прегрята течност, преохладена течност. Тези състояния могат да съществуват дълго време, но са нестабилни и при контакт с по-стабилна фаза настъпва преход. Например, не е трудно да се получи свръхохладена течност чрез охлаждане на чиста вода в чист съд под 0 ° C, но когато се появи център на кристализация, течната вода бързо се превръща в лед.
Изотопни модификации на водата.
Както кислородът, така и водородът имат естествени и изкуствени изотопи. В зависимост от вида на изотопите, включени в молекулата, се разграничават следните видове вода:
1. Лека вода (само вода).
2. Тежка вода (деутерий).
3. Свръхтежка вода (тритий).
Химични свойства на водата.
Водата е най-често срещаният разтворител на Земята, определящ до голяма степен природата на земната химия като наука. По-голямата част от химията, в началото си като наука, започва именно като химия на водни разтвори на вещества. Понякога се разглежда като амфолит - едновременно киселина и основа (катион Н + анион ОН-). При липса на чужди вещества във водата, концентрацията на хидроксидни йони и водородни йони (или хидрониеви йони) е една и съща, pKa ≈ прибл. 16.
Водата - едно от най-удивителните съединения на Земята - отдавна учудва изследователите с необичайността на много от нейните физически свойства:
1) Неизчерпаемост като вещество и природен ресурс; ако всички други ресурси на земята бъдат унищожени или разсеяни, тогава водата, така да се каже, излиза от това, приемайки различни форми или състояния: в допълнение към течни, твърди и газообразни. Това е единственото вещество и ресурс от този тип. Това свойство осигурява вездесъщността на водата, тя прониква в цялата географска обвивка на Земята и извършва разнообразна работа в нея.
2) Разширението, присъщо само на него по време на втвърдяване (замръзване) и намаляване на обема по време на топене (преход към течно състояние).
3) Максималната плътност при температура от +4 ° C и свързаните с това много важни свойства за естествени и биологични процеси, например, изключването на дълбоко замръзване на водни тела. По правило максималната плътност на физическите тела се наблюдава при температурата на втвърдяване. Максималната плътност на дестилираната вода се наблюдава при необичайни условия - при температура 3,98-4 ° C (или закръглено +4 ° C), т.е. при температура над точката на втвърдяване (замръзване). Когато температурата на водата се отклони от 4 °C в двете посоки, плътността на водата намалява.
4) При топене (топене) ледът плува на повърхността на водата (за разлика от други течности).
5) Аномална промяна в плътността на водата води до същата аномална промяна в обема на водата при нагряване: с повишаване на температурата от 0 до 4 ° C обемът на нагрятата вода намалява и само с по-нататъшно увеличение започва увеличавам. Ако с понижаване на температурата и по време на прехода от течно към твърдо състояние плътността и обемът на водата се променят по същия начин, както се случва с по-голямата част от веществата, тогава, когато наближи зимата, повърхностните слоеве на естествените водата ще се охлади до 0°C и ще потъне на дъното, освобождавайки място.по-топли слоеве, и така ще продължи, докато цялата маса на резервоара не придобие температура от 0°C. Освен това водата ще започне да замръзва, получените ледени късове ще потънат на дъното и резервоарът ще замръзне до цялата си дълбочина. В същото време много форми на живот във водата биха били невъзможни. Но тъй като водата достига най-високата си плътност при 4 °C, движението на нейните слоеве, причинено от охлаждането, завършва, когато се достигне тази температура. При по-нататъшно понижаване на температурата охладеният слой, който има по-ниска плътност, остава на повърхността, замръзва и по този начин предпазва долните слоеве от по-нататъшно охлаждане и замръзване.
6) Преходът на водата от едно състояние в друго е придружен от разходи (изпаряване, топене) или освобождаване (кондензация, замръзване) на съответното количество топлина. Необходими са 677 cal, за да се стопи 1 g лед, и 80 cal по-малко, за да се изпари 1 g вода. Високата латентна топлина на топенето на леда осигурява бавно топене на снега и леда.
7) Способността за относително лесно преминаване в газообразно състояние (изпаряване) не само при положителни, но и при отрицателни температури. В последния случай се получава изпарение, заобикаляйки течната фаза - от твърдото вещество (лед, сняг) веднага в парната фаза. Това явление се нарича сублимация.
8) Ако сравним точките на кипене и замръзване на хидриди, образувани от елементи от шестата група на периодичната таблица (селен H 2 Se, телур H 2 Te) и вода (H 2 O), тогава по аналогия с тях, кипенето точката на водата трябва да бъде около 60 ° C, а точката на замръзване е под 100 ° C. Но дори и тук се проявяват аномалните свойства на водата - при нормално налягане от 1 атм. Водата кипи при +100°C и замръзва при 0°C.
9) От голямо значение за живота на природата е фактът, че водата има аномално висок топлинен капацитет, 3000 пъти по-голям от въздуха. Това означава, че когато 1 m 3 вода се охлади с 1 0 C, 3000 m 3 въздух се загряват със същото количество. Следователно, като натрупва топлина, океанът има омекотяващ ефект върху климата на крайбрежните райони.
10) Водата абсорбира топлина по време на изпаряване и топене, освобождавайки я по време на кондензация от пара и замръзване.
11) Способността на водата в диспергирани среди, например във фино порести почви или биологични структури, да премине в свързано или диспергирано състояние. В тези случаи свойствата на водата (нейната подвижност, плътност, точка на замръзване, повърхностно напрежение и други параметри), които са изключително важни за процесите в природните и биологични системи, се променят много.
12) Водата е универсален разтворител, следователно не само в природата, но и в лабораторни условия няма идеално чиста вода поради причината, че тя е в състояние да разтвори всеки съд, в който е затворена. Има предположение, че повърхностното напрежение на идеално чистата вода би било такова, че да може да се пързаля по нея. Способността на водата да се разтваря осигурява преноса на вещества в географска обвивка, стои в основата на обмена на вещества между организмите и околната среда и е в основата на храненето.
13) От всички течности (с изключение на живака) водата има най-високо повърхностно налягане и повърхностно напрежение: \u003d 75 10 -7 J / cm 2 (глицерин - 65, амоняк - 42, а всички останали - под 30 10 -7 J / cm 2). Поради това капка вода има тенденция да приеме формата на топка и когато влезе в контакт с твърди частици, тя намокря повърхността на повечето от тях. Ето защо той може да се издигне нагоре по капилярите на скалите и растенията, осигурявайки образуването на почвата и храненето на растенията.
14) Водата има висока термична стабилност. Водната пара започва да се разлага на водород и кислород едва при температури над 1000 °C.
15) Химически чистата вода е много лош проводник на електричество. Поради ниската свиваемост звуковите и ултразвуковите вълни се разпространяват добре във водата.
16) Свойствата на водата се променят значително под въздействието на налягане и температура. Така че, с увеличаване на налягането, точката на кипене на водата се повишава, а точката на замръзване, напротив, намалява. С повишаването на температурата повърхностното напрежение, плътността и вискозитетът на водата намаляват, а електрическата проводимост и скоростта на звука във водата се увеличават.
Аномалните свойства на водата взети заедно, показващи нейната изключително висока устойчивост на външни фактори, се дължат на наличието на допълнителни сили между молекулите, наречени водородни връзки. Същността на водородната връзка е, че водороден йон, свързан с някакъв йон на друг елемент, е в състояние да привлече електростатично йон на същия елемент от друга молекула. Молекулата на водата има ъглова структура: ядрата, включени в нейния състав, образуват равнобедрен триъгълник, в основата на който има два протона, а на върха е ядрото на кислородния атом (Фигура 2.2).

Фигура 2.2 - Структурата на водната молекула
От 10-те електрони (5 двойки), присъстващи в молекулата, една двойка (вътрешни електрони) се намира близо до кислородното ядро, а от останалите 4 двойки електрони (външни) една двойка е социализирана между всеки от протоните и кислорода ядро, докато 2 двойки остават неопределени и са насочени към противоположните върхове на тетраедъра от протоните. По този начин в една водна молекула има 4 зарядови полюса, разположени във върховете на тетраедъра: 2 отрицателни, създадени от излишък на електронна плътност в местата на несподелени двойки електрони, и 2 положителни, създадени от дефицита му в местоположението на протоните.
В резултат водната молекула се оказва електрически дипол. Положителният полюс на една водна молекула привлича отрицателния полюс на друга водна молекула. Резултатът е агрегати (или асоциации на молекули) от две, три или повече молекули (Фигура 2.3).

Фигура 2.3 - Образуване на свързани молекули от водни диполи:
1 - монохидрол Н 2 О; 2 - дихидрол (H 2 O) 2; 3 - трихидрол (H 2 O) 3
Следователно във водата присъстват едновременно единични, двойни и тройни молекули. Съдържанието им варира в зависимост от температурата. Ледът съдържа главно трихидроли, чийто обем е по-голям от монохидролите и дихидролите. С повишаване на температурата скоростта на движение на молекулите се увеличава, силите на привличане между молекулите отслабват и в течно състояние водата е смес от три-, ди- и монохидроли. При по-нататъшно повишаване на температурата трихидролните и дихидролните молекули се разлагат; при температура 100 ° C водата се състои от монохидроли (пара).
Съществуването на несподелени електронни двойки определя възможността за образуване на две водородни връзки. Още две връзки възникват поради два водородни атома. В резултат на това всяка водна молекула е в състояние да образува четири водородни връзки (Фигура 2.4).

Фигура 2.4 - Водородни връзки във водни молекули:
– обозначение на водородна връзка
Поради наличието на водородни връзки във водата се отбелязва висока степен на ред в подреждането на нейните молекули, което я доближава до твърдо тяло, а в структурата се появяват множество кухини, което я прави много рохкава. Структурата на леда принадлежи към най-малко плътните структури. В него има кухини, чиито размери донякъде надвишават размерите на молекулата H 2 O. Когато ледът се топи, структурата му се разрушава. Но дори и в течна вода водородните връзки между молекулите се запазват: появяват се сътрудници - ембрионите на кристални образувания. В този смисъл водата е, така да се каже, в междинна позиция между кристалното и течното състояние и е по-подобна на твърдо вещество, отколкото на идеална течност. Въпреки това, за разлика от леда, всеки асоцииран съществува за много кратко време: унищожаването на едни и образуването на други агрегати непрекъснато се извършва. В кухините на такива "ледени" агрегати могат да се поставят единични водни молекули, докато опаковката на водните молекули става по-плътна. Ето защо, когато ледът се топи, обемът, зает от водата, намалява, нейната плътност се увеличава. При + 4 °C водата има най-плътна опаковка.
Когато водата се нагрява, част от топлината се изразходва за разкъсване на водородни връзки. Това обяснява високия топлинен капацитет на водата. Водородните връзки между водните молекули се разрушават напълно, когато водата преминава в пара.
Сложността на структурата на водата се дължи не само на свойствата на нейната молекула, но и на факта, че поради наличието на изотопи на кислорода и водорода, водата съдържа молекули с различни молекулни тегла (от 18 до 22). Най-често срещаната е "обикновената" молекула с молекулно тегло 18. Съдържанието на молекули с голямо молекулно тегло е малко. Така "тежката вода" (молекулно тегло 20) е по-малко от 0,02% от всички водни запаси. Не се среща в атмосферата, в тон речна вода е не повече от 150 г, морска вода - 160-170 г. Наличието му обаче придава на "обикновената" вода по-голяма плътност, влияе върху другите й свойства.
Удивителните свойства на водата позволиха появата и развитието на живота на Земята. Благодарение на тях водата може да играе незаменима роля във всички процеси, протичащи в географската обвивка.
Пептидите или късите протеини се намират в много храни - месо, риба и някои растения. Когато ядем парче месо, протеинът се разгражда по време на храносмилането на къси пептиди; те се абсорбират в стомаха, тънките черва, влизат в кръвта, клетките, след това в ДНК и регулират дейността на гените.Препоръчително е периодично да се използват изброените лекарства за всички хора след 40 години за профилактика 1-2 пъти годишно, след 50 години - 2-3 пъти годишно. Други лекарства - според нуждите.
Как да приемате пептиди
Тъй като възстановяването на функционалната способност на клетките става постепенно и зависи от нивото на тяхното съществуващо увреждане, ефектът може да настъпи както 1-2 седмици след началото на приема на пептиди, така и 1-2 месеца по-късно. Препоръчително е да се проведе курс в рамките на 1-3 месеца. Важно е да се има предвид, че тримесечният прием на естествени пептидни биорегулатори има удължен ефект, т.е. работи в тялото още 2-3 месеца. Полученият ефект продължава шест месеца, като всеки следващ курс на приложение има потенциращ ефект, т.е. вече получен ефект на усилване.Тъй като всеки пептиден биорегулатор е насочен към определен орган и не засяга по никакъв начин други органи и тъкани, едновременното приложение на лекарства с различен ефект не само не е противопоказано, но често се препоръчва (до 6-7 лекарства наведнъж). същото време).
Пептидите са съвместими с всякакви лекарства и биологични добавки. На фона на приема на пептиди е препоръчително постепенно да се намаляват дозите на едновременно приеманите лекарства, което ще повлияе положително на тялото на пациента.

Късите регулаторни пептиди не претърпяват трансформация в стомашно-чревния тракт, така че могат да се използват безопасно, лесно и просто в капсулирана форма от почти всеки.
Пептидите в стомашно-чревния тракт се разлагат до ди- и три-пептиди. По-нататъшното разграждане до аминокиселини става в червата. Това означава, че пептидите могат да се приемат дори без капсула. Това е много важно, когато човек по някаква причина не може да поглъща капсули. Същото важи и за силно отслабени хора или деца, когато трябва да се намали дозата.
Пептидните биорегулатори могат да се приемат както профилактично, така и терапевтично.

Ефективност естествено(PC) 2-2,5 пъти по-ниска от капсулованата. Затова приемът им с лечебна цел трябва да бъде по-продължителен (до шест месеца). Течните пептидни комплекси се нанасят върху вътрешната повърхност на предмишницата в проекцията на хода на вените или върху китката и се втриват до пълно абсорбиране. След 7-15 минути пептидите се свързват с дендритни клетки, които осъществяват по-нататъшния си транспорт до лимфните възли, където пептидите правят „трансплантация“ и се изпращат с кръвния поток до желаните органи и тъкани. Въпреки че пептидите са протеинови вещества, тяхното молекулно тегло е много по-малко от това на протеините, така че те лесно проникват в кожата. Проникването на пептидните препарати се подобрява допълнително чрез тяхната липофилизация, т.е. свързването им с мастна основа, поради което почти всички пептидни комплекси за външна употреба съдържат мастни киселини.
Не толкова отдавна се появи първата в света серия от пептидни лекарства за сублингвална употреба—
 Принципно нов метод на приложение и наличието на редица пептиди във всеки от препаратите им осигуряват най-бързото и ефективно действие. Това лекарство, попадайки в сублингвалното пространство с гъста мрежа от капиляри, е в състояние да проникне директно в кръвния поток, заобикаляйки абсорбцията през лигавицата на храносмилателния тракт и метаболитното първично дезактивиране на черния дроб. Като се има предвид директното навлизане в системното кръвообращение, скоростта на настъпване на ефекта е няколко пъти по-висока от скоростта, когато лекарството се приема перорално.
Принципно нов метод на приложение и наличието на редица пептиди във всеки от препаратите им осигуряват най-бързото и ефективно действие. Това лекарство, попадайки в сублингвалното пространство с гъста мрежа от капиляри, е в състояние да проникне директно в кръвния поток, заобикаляйки абсорбцията през лигавицата на храносмилателния тракт и метаболитното първично дезактивиране на черния дроб. Като се има предвид директното навлизане в системното кръвообращение, скоростта на настъпване на ефекта е няколко пъти по-висока от скоростта, когато лекарството се приема перорално.
Revilab SL линия- това са сложни синтезирани препарати, съдържащи 3-4 компонента с много къси вериги (по 2-3 аминокиселини). По отношение на концентрацията на пептид, това е средната стойност между капсулираните пептиди и PC в разтвор. По отношение на скоростта на действие той заема водеща позиция, т.к. абсорбира се и уцелва целта много бързо.
Има смисъл да се въведе тази линия пептиди в курса в началния етап и след това да се премине към естествени пептиди.
Друга иновативна серия е линия от многокомпонентни пептидни препарати. Линията включва 9 препарата, всеки от които съдържа набор от къси пептиди, както и антиоксиданти и строителни материали за клетките. Идеален вариант за тези, които не обичат да приемат много лекарства, а предпочитат да получат всичко в една капсула.
Действието на тези биорегулатори от ново поколение е насочено към забавяне на процесите на стареене, поддържане на нормално ниво на метаболитните процеси, предотвратяване и коригиране на различни състояния; рехабилитация след тежки заболявания, наранявания и операции.
Пептиди в козметологията
Пептидите могат да бъдат включени не само в лекарства, но и в други продукти. Например руски учени са разработили отлична клетъчна козметика с естествени и синтезирани пептиди, които въздействат върху дълбоките слоеве на кожата.Външното стареене на кожата зависи от много фактори: начин на живот, стрес, слънчева светлина, механични стимули, климатични колебания, диетични хобита и др. С възрастта кожата се дехидратира, губи своята еластичност, загрубява, по нея се появява мрежа от бръчки и дълбоки бразди. Всички знаем, че процесът на естествено стареене е естествен и необратим. Невъзможно е да му се устои, но може да се забави благодарение на революционните съставки на козметологията - нискомолекулни пептиди.
Уникалността на пептидите се състои в това, че те свободно преминават през роговия слой в дермата до нивото на живите клетки и капилярите. Възстановяването на кожата става дълбоко отвътре и в резултат на това кожата запазва свежестта си за дълго време. Няма пристрастяване към пептидната козметика - дори и да спрете да я използвате, кожата просто ще остарее физиологично.
Козметичните гиганти създават все повече и повече "чудодейни" средства. Купуваме с доверие, използваме, но чудо не се случва. Ние сляпо вярваме на надписите на банките, без да подозираме, че това често е просто маркетингов трик.
Например повечето козметични компании са в пълно производство и рекламират кремове против бръчки с колагенкато основна съставка. Междувременно учените стигнаха до извода, че молекулите на колагена са толкова големи, че просто не могат да проникнат през кожата. Те се установяват на повърхността на епидермиса и след това се измиват с вода. Тоест, купувайки кремове с колаген, ние буквално хвърляме пари на вятъра.
Като друга популярна активна съставка в козметиката против стареене се използва ресвератрол.Наистина е мощен антиоксидант и имуностимулант, но само под формата на микроинжекции. Ако го втриете в кожата, чудо няма да стане. Експериментално е доказано, че кремовете с ресвератрол практически не влияят на производството на колаген.
NPCRIZ, в сътрудничество с учени от Института по биорегулация и геронтология в Санкт Петербург, разработи уникална пептидна серия клетъчна козметика (на базата на естествени пептиди) и серия (на базата на синтезирани пептиди).
Те се основават на група пептидни комплекси с различни точки на приложение, които имат мощен и видим подмладяващ ефект върху кожата. В резултат на приложение се стимулира регенерацията на кожните клетки, кръвообращението и микроциркулацията, както и синтеза на колаген-еластиновия кожен скелет. Всичко това се проявява в повдигане, както и подобряване на текстурата, цвета и влажността на кожата.

В момента са разработени 16 вида кремове, вкл. подмладяваща и за проблемна кожа (с тимусни пептиди), за лице срещу бръчки и за тяло срещу стрии и белези (с пептиди от костна и хрущялна тъкан), срещу паяжини (с съдови пептиди), антицелулитна (с чернодробни пептиди) ), за клепачи от отоци и тъмни кръгове (с пептиди на панкреаса, кръвоносните съдове, костно-хрущялната тъкан и тимуса), против разширени вени (с пептиди на кръвоносните съдове и костно-хрущялната тъкан) и др. Всички кремове, доп. до пептидни комплекси, съдържат други мощни активни съставки. Важно е кремовете да не съдържат химически компоненти (консерванти и др.).

Ефективността на пептидите е доказана в множество експериментални и клинични изследвания. Разбира се, за да изглеждате красиви, някои кремове не са достатъчни. Трябва да подмладите тялото си отвътре, като използвате от време на време различни комплекси от пептидни биорегулатори и микроелементи.
Линията от козметични продукти с пептиди, освен кремове, включва още шампоан, маска и балсам за коса, декоративна козметика, тоници, серуми за кожата на лицето, шията и деколтето и др.
Трябва също така да се има предвид, че външният вид се влияе значително от консумираната захар.
Чрез процес, наречен гликация, захарта е разрушителна за кожата. Излишната захар увеличава скоростта на разграждане на колагена, което води до бръчки.

Гликирането - взаимодействието на захарите с протеини, предимно колаген, с образуването на кръстосани връзки - е естествен за нашия организъм, постоянен необратим процес в нашето тяло и кожа, водещ до втвърдяване на съединителната тъкан.
Продукти за гликиране - A.G.E частици. (Advanced Glycation Endproducts) – установяват се в клетките, натрупват се в тялото ни и водят до много негативни ефекти.
В резултат на гликирането кожата губи тонуса си и става матова, увисва и изглежда стара. Това е пряко свързано с начина на живот: намалете приема на захар и брашно (което е полезно за нормално тегло) и се грижете за кожата си всеки ден!
За да противодейства на гликацията, да инхибира разграждането на протеините и свързаните с възрастта кожни промени, компанията е разработила лекарство против стареене с мощен деглициращ и антиоксидантен ефект. Действието на този продукт се основава на стимулиране на процеса на дегликация, което засяга дълбоките процеси на стареене на кожата и спомага за изглаждане на бръчките и повишаване на нейната еластичност. Лекарството включва мощен комплекс за борба с гликирането - екстракт от розмарин, карнозин, таурин, астаксантин и алфа-липоева киселина.
Пептидите - панацея за старостта?
Според създателя на пептидните препарати В. Хавинсон, стареенето до голяма степен зависи от начина на живот: „Никакви лекарства няма да спасят, ако човек няма набор от знания и правилно поведение - това е спазването на биоритмите, правилното хранене, физическото възпитание и приемът на определени биорегулатори.” Що се отнася до генетичната предразположеност към стареене, според него ние зависим от гените само с 25 процента.Ученият твърди, че пептидните комплекси имат огромен редукционен потенциал. Но издигането им в ранг на панацея, приписването на несъществуващи свойства на пептидите (най-вероятно по търговски причини) е категорично погрешно!

Да се грижиш за здравето си днес означава да си дадеш шанс да живееш утре. Ние самите трябва да подобрим начина си на живот - да спортуваме, да се откажем от лошите навици, да се храним по-добре. И разбира се, доколкото е възможно, използвайте пептидни биорегулатори, които помагат за поддържане на здравето и увеличаване на продължителността на живота.
Пептидните биорегулатори, разработени от руски учени преди няколко десетилетия, станаха достъпни за широката публика едва през 2010 г. Постепенно все повече хора по света научават за тях. Тайната за поддържане на здравето и младостта на много известни политици, артисти, учени се крие в използването на пептиди. Ето само няколко от тях:
Министърът на енергетиката на ОАЕ Шейх Саид,
Президентът на Беларус Лукашенко,
Президентът на Казахстан Назарбаев,
Крал на Тайланд
Академик Ж.И. Алферов, пилот-космонавт Г.М. Гречко и съпругата му Л.К. Гречко,
артисти: В. Леонтиев, Е. Степаненко и Е. Петросян, Л. Измайлов, Т. Повалий, И. Корнелюк, И. Винер (треньор по художествена гимнастика) и много, много други...
Пептидните биорегулатори се използват от спортисти на 2 руски олимпийски отбора - по художествена гимнастика и гребане. Използването на лекарства ни позволява да повишим устойчивостта на стрес на нашите гимнастички и допринася за успеха на националния отбор на международни първенства.
Ако на младини можем да си позволим да правим профилактика на здравето периодично, когато си поискаме, то с възрастта, за съжаление, нямаме такъв лукс. И ако не искате утре да бъдете в такова състояние, че близките ви да изнемогват с вас и да чакат с нетърпение смъртта ви, ако не искате да умрете сред непознати, защото не помните нищо и всичко около вас изглежда непознато всъщност, трябва да вземете мерки от днес и да се погрижите не толкова за себе си, колкото за своите близки.
Библията казва: „Търсете и ще намерите“. Може би сте намерили свой собствен начин за лечение и подмладяване.
Всичко е в нашите ръце и само ние можем да се грижим за себе си. Никой няма да направи това вместо нас!
 |
 |
 |

|

|
 |
 |
 |
|
Въведение……………………………………………………………………….. 1. СВОЙСТВА НА ВОДАТА…………………………………………………………… 2. РАЗПРОСТРАНЕНИЕ И СЪСТОЯНИЕ НА ВОДАТА……………………………. 3. РОЛЯТА НА ВОДАТА В ПРИРОДАТА………………………………………………………. 4. КРЪГОВРЪТ НА ВОДАТА В ПРИРОДАТА…………………………………………. 5. Основни причини за замърсяване на водите и принципи за справяне с тях………………………………………….. 6. ПРОБЛЕМ С ЛИПСАТА НА ПРЯСНА ВОДА……………………………. 7. Регулиране на качеството на водата………………………………………. 8. Методи за пречистване на вода……………………………………………………… 9. Изчисляване на отпадъчните води от промишлена площадка………………….. Библиографски списък………………………………………....... |
Въведение
Известни са четири местообитания: земя-въздух (атмосфера), вода (хидросфера), почва (едафични) и живи организми. Тези насоки се отнасят до замърсяването на хидросферата.
Тези насоки са предназначени за студенти от технически университети от всички специалности. Държавните образователни стандарти предвиждат изучаването на курса "Екология" и въпроси, свързани с опазването на околната среда, от студенти от всички специалности. Усвояването на дисциплината е с продължителност един семестър – лекция и практически курс от 34 аудиторни часа. Методическите указания ще позволят на студентите най-ефективно да изучават проблемите, свързани със замърсяването на хидросферата, както и въпросите за опазването на водните тела.
Екологичното образование и решаването на екологични проблеми трябва да проникнат в процеса на формиране на специалист от всякакъв профил. Основното в същото време е, че всички специалисти, завършващи висше образование, заедно със солидни юридически и практически познания, получават висок морален заряд и способност да решават проблемите на опазването на природата във връзка с професионалната си област.
Интензивното развитие на промишлеността, транспорта, пренаселеността в редица региони на планетата доведоха до значително замърсяване на хидросферата. Според СЗО (Световната здравна организация) около 80% от всички инфекциозни заболявания в света са свързани с лошото качество на питейната вода и нарушенията на санитарно-хигиенните стандарти на водоснабдяването. Замърсяването на повърхността на водните тела с филми от масло, мазнини, смазочни материали предотвратява обмена на газ между водата и атмосферата, което намалява насищането на водата с кислород и има отрицателно въздействие върху състоянието на фитопланктона и е причина за масовата смърт на риби и птици.
Според ООН в света се произвеждат до 1 милион артикула, от които 100 хиляди са химически съединения, включително 15 хиляди - потенциални токсиканти. Според експертни оценки до 80% от всички химични съединения, влизащи във външната среда, рано или късно попадат във водоизточници.
Смята се, че повече от 420 km 3 отпадъчни води се изхвърлят годишно в света, което е в състояние да направи около 7 хиляди km 3 чиста вода неизползваема.
1. Свойства на водата
Водните запаси на Земята са огромни, те образуват хидросферата - една от най-мощните сфери на нашата планета. Хидросферата, литосферата, атмосферата и биосферата са взаимосвързани, проникват една в друга и са в постоянно, тясно взаимодействие. Всички сфери съдържат вода. Водните ресурси се състоят от статични (вековни) резерви и възобновяеми ресурси. Хидросферата обединява Световния океан, морета, реки и езера, блата, езера, резервоари, полярни и планински ледници, подземни води, почвена влага и атмосферни пари.
Вода - химично съединение на водород и кислород (H 2 O) - течност без мирис, вкус и цвят (синкава в дебели слоеве); с плътност 1 g / cm 3 при температура 3,98 ° C. При 0°C водата се превръща в лед, при 100°C се превръща в пара. Молекулното тегло на водата е 18,0153. Според В. И. Вернадски химичният състав на водата може да бъде представен с формулата H 2 n O n със стойност на n, равна на 1-6. Не всички водни молекули са еднакви: наред с обичайните молекули с маса 18, има молекули с молекулно тегло 19, 20, 21 и дори 22. Водата е уникално вещество по своите физични и химични свойства. Полярността на водните молекули и наличието на "водородни" връзки между тях определят нейните уникални свойства. Плътността на водата е най-висока при температура 3,98 ° C, по-нататъшното охлаждане води до преминаването й в лед и е придружено от намаляване на плътността. Намаляване на обема вместо разширяване възниква по време на топенето (топенето) на леда. Летливостта на водата е ниска. Водата има аномално висока топлина на топене и специфичен топлинен капацитет; когато ледът се топи, топлинният капацитет се увеличава повече от два пъти. Топлинният капацитет на водата намалява с повишаване на температурата до 27 ° C и след това отново започва да се увеличава. Вискозитетът на водата (при температури от 0 до 30 °C) намалява с увеличаване на налягането.
2. Разпределение и състояние на водата
Водата е най-разпространеното вещество на земята. Тя е в три фази: газообразна (водна пара), течна и твърда. Разграничаване на атмосферни, повърхностни и подземни води.
В атмосферата водата се намира в парообразно състояние във въздушната обвивка около Земята, в капково-течно състояние - в облаци, мъгли и под формата на дъжд, твърдо - под формата на сняг, градушка и ледени кристали. високи облаци.
В течно състояние водата се намира в хидросферата: водата на океаните, моретата, езерата, реките, блатата, езерата и резервоарите. В твърдо състояние водата под формата на лед и сняг се намира на полюсите на планетата, по планинските върхове, а през зимата покрива големи площи от водни тела. Има капилярна, гравитационна, кристализационна вода.
Общата площ на океаните и моретата е 2,5 пъти площта на сушата, а обемът на водата на Земята е 1,5-109 km3. Повече от 95% от водата е солена. Водните запаси и тяхното съотношение са показани в таблица 1. Световният океан обхваща площ от 361 милиона km 2, което е 70,8% от повърхността на Земята. При средна дълбочина на океана от 3800 m общият обем на водата достига 1370 милиона km 3. При изчисляване на ресурсите на подземните води се приема, че мантията на Земята съдържа 0,5% вода, чийто общ обем е приблизително 13-15 милиарда км 3 вода. Възможният приток на дълбоки води в земната кора и на повърхността на планетата е средно 1 km 3 годишно. При средна абсолютна възраст на Земята от 3,5 милиарда години, обемът на повърхностните води трябва да бъде около 3,3 милиарда км 3 (Макаренко, 1966). Обемът на свободната вода в земната кора (подземни води) V.I. Вернадски оценява на 60 милиона km3.
Таблица 1 - Общи световни водни запаси
|
Части от хидросферата |
Според M.I.Lvovich |
Според Р.К. Клиге |
||
|
% по обем |
% по обем |
|||
|
Световен океан | ||||
|
Подпочвените води | ||||
|
Езера, блата | ||||
|
влажност на почвата | ||||
|
Атмосферна влага | ||||
|
речни води | ||||
|
Цялата хидросфера | ||||
Русия се измива от водите на 12 морета, принадлежащи към три океана. На територията на Русия има над 2,5 милиона големи и малки реки, повече от 2 милиона езера. Водните ресурси на Русия се състоят от статични (вековни) и възобновяеми ресурси. Първите се считат за относително постоянни за дълго време, възобновяемите водни ресурси се оценяват по обема на годишния речен отток. Речният отток се формира от топене на сняг и валежи; реките се захранват от блата и подземни води. Общите водни ресурси на Русия са показани в таблица 2.
В социално-икономическото развитие на страната приоритетно значение има речният отток от повърхностни пресни води. По отношение на речния отток Русия е на второ място след Бразилия. рекиса в основата на водния фонд. Почти 65% от големите градове в Русия (Москва, Санкт Петербург, Нижни Новгород, Екатеринбург, Перм и други) използват повърхностни води, предимно речни, за питейни и технически нужди.
Таблица 2 - Общи водни ресурси на Русия
|
Видове ресурси |
възобновяем, |
% от общите ресурси |
Статично, км 3 |
% от общи ресурси |
|
речен отток | ||||
|
Подпочвените води | ||||
|
влажност на почвата | ||||
|
Над 97 000 |
През територията на Русия протичат повече от 120 хиляди реки с дължина над 10 км и обща дължина над 2,3 млн. км. Около 90% от годишния речен отток на Русия пада в басейните на Северния ледовит и Тихия океан и само 8% - в басейните на Каспийско и Азовско море. Въпреки това, в басейните на тези морета живеят повече от 80% от населението на Русия и е концентрирана основната част от икономическата инфраструктура.
В Русия има над 2 милиона. сладки и солени езера.Сред тях са най-дълбокото сладководно езеро Байкал и най-голямото затворено солено водно тяло, Каспийско море. Основната част от ресурсите на прясна вода на езерото е съсредоточена в езерата: Байкал (23 хил. км 3, или 20% от световните и 90% от националните резерви), Ладожко (903 км 3), Онежко (285 км 3), Чудско. -Псковское (35,2 км 3). Най-големите резервоари в Русия съдържат около 450 km 3 прясна вода.
Леднициса значителен акумулатор на вода, те са концентрирани главно в полярните райони: в Антарктика, на арктическите острови, включително руския сектор на Арктика, и в планинските райони.
Подпочвените водиЗаедно с повърхностните води на реки, езера и езера те са основата на водния фонд на Русия и служат за питейни цели. Естествените ресурси на пресни подземни води са 787,5 km 3 /година, прогнозно годни за ползване - над 300 km 3 /година. Минерални и лечебни подземни води се използват в 450 находища от санаториално-курортни и лечебни заведения, както и от заводи за бутилиране на минерални лечебни води. Потенциалните запаси от минерална вода се оценяват на 800 хил. m 3 /ден. Топлоенергия (термична, пароводна смес с температура от 40 до 200 ° СЪС ) подземните води се използват за топлоснабдяване и производство на електроенергия. Техните значителни ресурси (повече от 7081,5 милиона m 3 / ден) са съсредоточени в Северен Кавказ и Далечния изток. Ресурсите на промишлени подземни води са повече от 4 милиона m 3 / ден (хидроминерални суровини). Те са източник на йод, бром и редица други редки елементи и метали. Големи находища на промишлени подземни води се намират в Краснодарския край, в Урал и в Западен Сибир.
Водата е прозрачна течност, безцветна (в малък обем) и без мирис. Водата е от ключово значение за създаването и поддържането на живота на Земята, за химическия строеж на живите организми, за формирането на климата и времето. В твърдо състояние се нарича лед или сняг, а в газообразно състояние се нарича водна пара. Около 71% от повърхността на Земята е покрита с вода (океани, морета, езера, реки, лед на полюсите).
Свойствата на водата са комбинация от физични, химични, биохимични, органолептични, физикохимични и други свойства на водата.
Водата - водородният оксид - е едно от най-често срещаните и важни вещества. Повърхността на Земята, заета от вода, е 2,5 пъти по-голяма от повърхността на сушата. В природата няма чиста вода - тя винаги съдържа примеси. Чистата вода се получава чрез дестилация. Дестилираната вода се нарича дестилирана. Съставът на водата (по маса): 11,19% водород и 88,81% кислород.
Чистата вода е бистра, без мирис и вкус. Има най-висока плътност при 0 ° C (1 g / cm 3). Плътността на леда е по-малка от плътността на течната вода, така че ледът изплува на повърхността. Водата замръзва при 0°C и кипи при 100°C при налягане 101 325 Pa. Той е лош проводник на топлина и много лош проводник на електричество. Водата е добър разтворител. Молекулата на водата има ъглова форма, водородните атоми образуват ъгъл от 104,5° спрямо кислорода. Следователно водната молекула е дипол: тази част от молекулата, където се намира водородът, е положително заредена, а частта, където се намира кислородът, е отрицателно заредена. Поради полярността на водните молекули, електролитите в нея се дисоциират на йони.
В течната вода, заедно с обикновените молекули H20, има свързани молекули, т.е. комбинирани в по-сложни агрегати (H2O)x поради образуването на водородни връзки. Наличието на водородни връзки между водните молекули обяснява аномалиите на неговите физични свойства: максимална плътност при 4 ° C, висока точка на кипене (в серията H20-H2S - H2Se) аномално висок топлинен капацитет. С повишаването на температурата водородните връзки се разкъсват и пълното разкъсване настъпва, когато водата се превърне в пара.
Водата е силно реактивоспособно вещество. При нормални условия той взаимодейства с много основни и киселинни оксиди, както и с алкални и алкалоземни метали. Водата образува множество съединения - кристални хидрати.
Очевидно съединенията, свързващи водата, могат да служат като десиканти. Други изсушаващи агенти включват P205, CaO, BaO, метален Ma (те също химически взаимодействат с вода) и силикагел. Важно химично свойство на водата е нейната способност да влиза в реакции на хидролитично разлагане.
Химичните свойства на водата се определят от нейния състав. Водата е 88,81% кислород и само 11,19% водород. Както споменахме по-горе, водата замръзва при нула градуса по Целзий, но кипи при сто. Дестилираната вода има много ниска концентрация на положително заредени хидрониеви йони HO и H3O+ (само 0,1 µmol/l), така че може да се нарече отличен изолатор. Свойствата на водата в природата обаче не биха се реализирали правилно, ако тя не беше добър разтворител. Водната молекула е много малка по размер. Когато друго вещество навлезе във водата, неговите положителни йони се привличат от кислородните атоми, които изграждат водната молекула, а отрицателните йони се привличат от водородните атоми. Водата, така да се каже, заобикаля от всички страни разтворените в нея химически елементи. Следователно водата почти винаги съдържа различни вещества, по-специално метални соли, които осигуряват провеждането на електрически ток.
Физическите свойства на водата ни "дадоха" такива явления като парниковия ефект и микровълновата печка. Около 60% от парниковия ефект се създава от водни пари, които перфектно абсорбират инфрачервените лъчи. В този случай оптичният индекс на пречупване на водата n=1,33. Освен това водата абсорбира и микровълните поради високия диполен момент на нейните молекули. Тези свойства на водата в природата накараха учените да се замислят за изобретяването на микровълновата печка.
Ролята на водата в природата и човешкия живот е неизмеримо голяма. Можем да кажем, че всички живи същества се състоят от вода и органични вещества. Тя е активен участник във формирането на физико-химическата среда, климата и времето. В същото време това засяга и икономиката, индустрията, селското стопанство, транспорта и енергетиката.
Без храна можем да живеем няколко седмици, но без вода - само 2-3 дни. За да осигури нормално съществуване, човек трябва да въведе в тялото около 2 пъти повече вода от теглото си, отколкото хранителни вещества. Загубата на повече от 10% вода от човешкото тяло може да доведе до смърт. Средно тялото на растенията и животните съдържа повече от 50% вода, в тялото на медуза до 96%, във водораслите 95-99%, в спорите и семената от 7 до 15%. Почвата съдържа поне 20% вода, докато човешкото тяло съдържа около 65% вода. Различните части на човешкото тяло съдържат различно количество вода: стъкловидното тяло на окото се състои от 99% вода, 83% от нея се съдържа в кръвта, 29% в мастната тъкан, 22% в скелета и дори 0,2% % в зъбния емайл. През целия си живот човек губи вода от тялото, биоенергийният му потенциал намалява. В шестседмичния човешки ембрион съдържанието на вода е до 97%, при новороденото - 80%, при възрастен - 60-70%, а в тялото на възрастен човек - само 50-60%.
Водата е абсолютно необходима за всички ключови човешки животоподдържащи системи. Водата и съдържащите се в нея вещества се превръщат в хранителна среда и доставят на живите организми необходимите за живота микроелементи. Съдържа се в кръвта (79%) и подпомага преноса на хиляди основни вещества и елементи през кръвоносната система в разтворено състояние (геохимичният състав на водата е близък до състава на кръвта на животните и хората.).
В лимфата, която извършва обмяната на вещества между кръвта и тъканите на живия организъм, водата е 98%.
Водата, повече от другите течности, проявява свойствата на универсален разтворител. След определено време той може да разтвори почти всяко твърдо вещество.
Такава всеобхватна роля на водата се дължи на нейните уникални свойства.
Напоследък усилията на изследователите са насочени към ускорено изследване на процесите, протичащи на фазовата граница. Оказа се, че водата в граничните слоеве има много интересни свойства, които не се проявяват в насипната фаза. Тази информация е от съществено значение за решаването на редица важни практически проблеми. Пример за това е създаването на принципно нова елементна база на микроелектрониката, при която по-нататъшната миниатюризация на схемите ще се основава на принципа на самоорганизацията на макромолекулите върху водната повърхност. Развитата повърхност също е характерна за биологичните системи, поради значението на повърхностните явления за тяхното функциониране. Почти винаги наличието на вода оказва значително влияние върху естеството на процесите, протичащи в приповърхностната област. От своя страна, под въздействието на повърхността, свойствата на самата вода се променят радикално и водата в близост до границата трябва да се разглежда като принципно нов физически обект на изследване. Много е вероятно изследването на молекулярно-статистическите свойства на водата в близост до повърхността, което по същество едва започва, ще позволи ефективно да се контролират много физични и химични процеси.
Напоследък има повишен интерес към изучаването на свойствата на водата на микроскопично ниво. Следователно, за да се разберат много аспекти на физиката на повърхностните явления, е необходимо да се познават свойствата на водата на фазовата граница. Липсата на строги представи за структурата на водата, за организацията на водата на молекулярно ниво води до факта, че когато се изучават свойствата на водните разтвори както в обемната фаза, така и в капилярните системи, водата често се разглежда като безструктурна среда . Известно е обаче, че свойствата на водата в граничните слоеве могат значително да се различават от тези в обема. Следователно, разглеждайки водата като безструктурна течност, ние губим уникална информация за свойствата на граничните слоеве, които, както се оказва, до голяма степен определят характера на процесите, протичащи в тънките пори. Например, йонната селективност на мембраните от целулозен ацетат се обяснява със специалната молекулярна организация на водата в порите, което по-специално се отразява в концепцията за "неразтварящ се обем". По-нататъшното развитие на теорията, която отчита спецификата на междумолекулните взаимодействия, лежащи в основата на селективния мембранен транспорт, ще допринесе за по-пълното разбиране на мембранното обезсоляване на разтвори. Това ще даде възможност да се дадат разумни препоръки за подобряване на ефективността на процесите на обезсоляване на водата. Това предполага значението и необходимостта от изучаване на свойствата на течностите в граничните слоеве, по-специално в близост до повърхността на твърдо тяло.
 Комплект мъниста от Melissa & Doug Настолни игри на 2 години
Комплект мъниста от Melissa & Doug Настолни игри на 2 години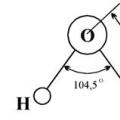 Физични свойства на водата
Физични свойства на водата Как оптимизмът ви помага да постигнете целите си
Как оптимизмът ви помага да постигнете целите си