التماثل الهندسي نموذجي ل. أساسيات الكيمياء الفراغية
خلال الدرس ، سوف تحصل على فكرة عامة عن أنواع التماثل ، وتعلم ما هو الايزومر. تعرف على أنواع التماثل في الكيمياء العضوية: البنيوية والمكانية (الأيزومرية الفراغية). باستخدام الصيغ التركيبية للمواد ، ضع في اعتبارك الأنواع الفرعية من التماثل البنيوي (الهيكل العظمي والتشابه للمواقف) ، تعرف على أنواع التماثل المكاني: الهندسي والبصري.
الموضوع: مقدمة في الكيمياء العضوية
الدرس: الايزومرية. أنواع التماثل. تماثل بنيوي ، هندسي ، بصري
1. ما هو التماثل
تُظهر أنواع الصيغ التي تم النظر فيها سابقًا والتي تصف المواد العضوية أن عدة صيغ هيكلية مختلفة يمكن أن تتوافق مع صيغة جزيئية واحدة.
على سبيل المثال ، الصيغة الجزيئية C2H6ا تطابق مادتين مع صيغ هيكلية مختلفة - كحول الإيثيل وثنائي ميثيل الأثير. الشكل: 1.
كحول الإيثيل عبارة عن سائل يتفاعل مع الصوديوم المعدني مع إطلاق الهيدروجين ، ويغلي عند + 78.50 درجة مئوية. في ظل نفس الظروف ، يغلي ثنائي ميثيل الأثير ، وهو غاز لا يتفاعل مع الصوديوم ، عند درجة حرارة -230 درجة مئوية.
تختلف هذه المواد في بنيتها - نفس الصيغة الجزيئية تتوافق مع مواد مختلفة.
الشكل: 1. Interclass isomerism
تسمى ظاهرة وجود مواد لها نفس التركيب ، ولكن بنية مختلفة وبالتالي خصائص مختلفة isomerism (من الكلمات اليونانية "isos" - "يساوي" و "meros" - "جزء" ، "مشاركة").
أنواع التماكب
هناك أنواع مختلفة من التماكب.
2. Interclass isomerism
يرتبط التماثل البنيوي بالترتيب المختلف للانضمام للذرات في الجزيء.
يعتبر الإيثانول وثنائي ميثيل الأثير أيزومرات هيكلية. نظرًا لأنهم ينتمون إلى فئات مختلفة من المركبات العضوية ، فإن هذا النوع من التماثل البنيوي يسمى أيضا interlass... الشكل: 1.
3. تماثل هيكل عظمي الكربون
يمكن أن تكون الأيزومرات الهيكلية ضمن نفس فئة المركبات ، على سبيل المثال ، ثلاثة هيدروكربونات مختلفة تتوافق مع الصيغة C5H12. عليه تماثل هيكل عظمي الكربون... الشكل: 2.

الشكل: 2 أمثلة على المواد - الايزومرات الهيكلية
4. موقف isomerism
هناك أيزومرات هيكلية لها نفس الهيكل الكربوني ، والتي تختلف في موضع الروابط المتعددة (المزدوجة والثلاثية) أو الذرات التي تحل محل الهيدروجين. يسمى هذا النوع من التماكب البنيوي تماثل الموضع.
الشكل: 3. التماكب الهيكلي
5. التماثل المكاني
في الجزيئات التي تحتوي على روابط مفردة فقط ، في درجة حرارة الغرفة ، يكون الدوران الحر تقريبًا للشظايا الجزيئية حول الروابط ممكنًا ، وعلى سبيل المثال ، تكون جميع صور صيغ 1،2-ثنائي كلورو إيثان متكافئة. الشكل: 4

الشكل: 4. موقف ذرات الكلور حول رابطة واحدة
إذا تم إعاقة الدوران ، على سبيل المثال ، في جزيء دوري أو رابطة مزدوجة ، إذن هندسية أو متشابهة.في أيزومرات رابطة الدول المستقلة ، توجد البدائل على جانب واحد من مستوى الحلقة أو الرابطة المزدوجة ، في الأيزومرات العابرة ، على الجانبين المتقابلين.
توجد أيزومرات رابطة الدول المستقلة عندما ترتبط ذرة كربون مختلفين النائب. الشكل: خمسة.



الشكل: 5. رابطة الدول المستقلة - والأيزومرات العابرة
6. التماثل البصري
يحدث نوع آخر من التماثل بسبب حقيقة أن ذرة كربون ذات أربع روابط مفردة تشكل بنية مكانية مع بدائلها - رباعي الوجوه. إذا كان الجزيء يحتوي على ذرة كربون واحدة على الأقل مرتبطة بأربعة بدائل مختلفة ، إذن التماثل البصري... هذه الجزيئات لا تتطابق مع صورتها المرآة. هذه الخاصية تسمى chirality - من chier اليوناني - "اليد". الشكل: 6. التزاوج البصري هو سمة من سمات العديد من الجزيئات التي تشكل الكائنات الحية.
|
|
|
الشكل: 6. أمثلة على الايزومرات الضوئية
كما يسمى التماثل البصري التماثل (من اليوناني enantios - "المقابل" و meros - "الجزء") ، والأيزومرات الضوئية - المتشاهدين... تنشط Enantiomers بصريًا ، فهي تقوم بتدوير مستوى استقطاب الضوء بنفس الزاوية ، ولكن في اتجاهين متعاكسين: د-، أو (+) - أيزومر ، - إلى اليمين ، ل-، أو (-) - أيزومر ، - إلى اليسار. خليط من مقادير متساوية من المتغيرات ، يسمى رفيق السباق ، غير نشط بصريًا ويشار إليه بالرمز د ، ل- أو (±).
ملخص الدرس
في سياق الدرس ، حصلت على فكرة عامة عن أنواع التماثل ، ما هو الايزومر. تعلمنا عن أنواع التماثل في الكيمياء العضوية: البنيوية والمكانية (الفراغية). بمساعدة الصيغ الهيكلية للمواد ، اعتبرنا الأنواع الفرعية من التماكب البنيوي (الهيكل العظمي والتشابه للمواقف) ، تعرفنا على أنواع التماكب المكاني: الهندسي والبصري.
قائمة المراجع
1. Rudzitis G. E. الكيمياء. أساسيات الكيمياء العامة. الصف العاشر: كتاب مدرسي للمؤسسات التعليمية: المستوى الأساسي / G.E Rudzitis، F.G Feldman. - الطبعة الرابعة عشر. - م: التعليم ، 2012.
2. الكيمياء. الصف 10. مستوى الملف الشخصي: كتاب مدرسي. للتعليم العام. المؤسسات / V.V. Eremin ، N.E. Kuzmenko ، V.V. Lunin et al. - M.: Bustard ، 2008. - 463 p.
3. الكيمياء. الصف 11. مستوى الملف الشخصي: كتاب مدرسي. للتعليم العام. المؤسسات / V.V. Eremin ، N.E. Kuzmenko ، V.V. Lunin et al. - M.: Bustard ، 2010. - 462 p.
4. Khomchenko GP ، Khomchenko IG مجموعة من المشاكل في الكيمياء للالتحاق بالجامعات. - الطبعة الرابعة. - م: ريا "الموجة الجديدة": الناشر أومرينكوف ، 2012. - 278 ص.
1. Interneturok. ru.
2. الكيمياء العضوية.
واجب منزلي
1. رقم 1 ، 2 (ص 39) كيمياء Rudzitis G. أساسيات الكيمياء العامة. الصف العاشر: كتاب مدرسي للمؤسسات التعليمية: المستوى الأساسي / G. E. Rudzitis، F.G. Feldman. - الطبعة الرابعة عشر. - م: التعليم ، 2012.
2. لماذا يكون عدد الأيزومرات في سلسلة الهيدروكربونات من الإيثيلين أكبر من عدد الهيدروكربونات المشبعة؟
3. ما الهيدروكربونات التي لها أيزومرات مكانية؟
تأمين المواد باستخدام المحاكاة
المدرب 1 المدرب 2 المدرب 3

 1. isomerism (من اليوناني isos - يساوي) Berzelius، 1830 Isomers هي مواد لها نفس الصيغة الجزيئية (نفس التركيب النوعي والكمي) ، ولكنها تختلف في تسلسل ارتباط الذرات و (أو) ترتيبها في الفضاء ولها اختلاف الخصائص.
1. isomerism (من اليوناني isos - يساوي) Berzelius، 1830 Isomers هي مواد لها نفس الصيغة الجزيئية (نفس التركيب النوعي والكمي) ، ولكنها تختلف في تسلسل ارتباط الذرات و (أو) ترتيبها في الفضاء ولها اختلاف الخصائص.
 BERCELIUS (Berzelius) ، Jens Jakob 1779-1848 الكيميائي السويدي الشهير. منذ 1807 أستاذ الطب والصيدلة في ستوكهولم.
BERCELIUS (Berzelius) ، Jens Jakob 1779-1848 الكيميائي السويدي الشهير. منذ 1807 أستاذ الطب والصيدلة في ستوكهولم.
 C 2 H 6 O ثنائي ميثيل الأثير Bp \u003d -24 C كحول إيثيلي Bp \u003d 78 C n- بيوتان Bp \u003d -0.5 C C 4 H 10 أيزوبيوتان Bp \u003d -11.7 درجة مئوية
C 2 H 6 O ثنائي ميثيل الأثير Bp \u003d -24 C كحول إيثيلي Bp \u003d 78 C n- بيوتان Bp \u003d -0.5 C C 4 H 10 أيزوبيوتان Bp \u003d -11.7 درجة مئوية
 عدد الأيزومرات في سلسلة الألكان الاسم المعادلة رقم المعادلة الاسم عدد الأيزومرات CH 4 الميثان 1 C 11 H 24 undecane 159 C 2 H 6 ethane 1 C 12 H 26 dodecane 355 C 3 H 8 Propane 1 C 13 H 28 tridecane 802 C 4 H 10 البيوتان 2 C 14 H 30 tetradecane 1858 C 5 H 12 pentane 3 C 15 H 32 pentadecane 4347 C 6 H 14 hexane 5 C 20 H 42 eicosane C 7 H 16 Hptane 9 C 25 H 52 pentacosane 36797588 C 8 H 18 أوكتان 18 C 30 H 62 triacontane 4118466763 C 9 H 20 nonane 35 C 40 H 82 tetracontane 62491178805831 C 10 H 22 Decane 75366319
عدد الأيزومرات في سلسلة الألكان الاسم المعادلة رقم المعادلة الاسم عدد الأيزومرات CH 4 الميثان 1 C 11 H 24 undecane 159 C 2 H 6 ethane 1 C 12 H 26 dodecane 355 C 3 H 8 Propane 1 C 13 H 28 tridecane 802 C 4 H 10 البيوتان 2 C 14 H 30 tetradecane 1858 C 5 H 12 pentane 3 C 15 H 32 pentadecane 4347 C 6 H 14 hexane 5 C 20 H 42 eicosane C 7 H 16 Hptane 9 C 25 H 52 pentacosane 36797588 C 8 H 18 أوكتان 18 C 30 H 62 triacontane 4118466763 C 9 H 20 nonane 35 C 40 H 82 tetracontane 62491178805831 C 10 H 22 Decane 75366319
 II. التنادد مجموعات المركبات العضوية من نفس الهيكل مع نفس المجموعات الوظيفية ، تختلف عن بعضها البعض في عدد -CH 2 - مجموعات في سلسلة الكربون ، تشكل سلسلة متجانسة. سلسلة متماثلة من الميثان
II. التنادد مجموعات المركبات العضوية من نفس الهيكل مع نفس المجموعات الوظيفية ، تختلف عن بعضها البعض في عدد -CH 2 - مجموعات في سلسلة الكربون ، تشكل سلسلة متجانسة. سلسلة متماثلة من الميثان
 ثالثا. صفوف متساوية. ll هذه هي سلسلة المواد المبنية من نفس العدد من ذرات الكربون ، ولكنها تختلف في التركيب الكمي لذرات H ، أي أن كل عضو تالٍ من السلسلة يحتوي على ذرتين H أقل من السابق: C 2 H 6 ethane C 2 H 4 ethylene C 2 H 2 أسيتيلين
ثالثا. صفوف متساوية. ll هذه هي سلسلة المواد المبنية من نفس العدد من ذرات الكربون ، ولكنها تختلف في التركيب الكمي لذرات H ، أي أن كل عضو تالٍ من السلسلة يحتوي على ذرتين H أقل من السابق: C 2 H 6 ethane C 2 H 4 ethylene C 2 H 2 أسيتيلين






 التماثل البنيوي 3. توتوميرزم (توتوميرزم) (من اليونانية ταύτίς - نفس القياس و μέρος) هي ظاهرة التعايش بين شكلين متشابهين في توازن متحرك وقادران على التحول تلقائيًا إلى بعضهما البعض.
التماثل البنيوي 3. توتوميرزم (توتوميرزم) (من اليونانية ταύτίς - نفس القياس و μέρος) هي ظاهرة التعايش بين شكلين متشابهين في توازن متحرك وقادران على التحول تلقائيًا إلى بعضهما البعض.







Src \u003d "https://present5.com/presentation/73124296_273676330/image-22.jpg" alt \u003d "(! LANG: Conformation\u003e C ------- C Conformation\u003e C ------- C
 الأيزومرات الهندسية - لها نفس ترتيب (تسلسل) الروابط في الجزيء ، ولكنها تختلف في ترتيب الذرات (المجموعات) في الفضاء بالنسبة إلى مستوى الرابطة المزدوجة أو دورة صغيرة.
الأيزومرات الهندسية - لها نفس ترتيب (تسلسل) الروابط في الجزيء ، ولكنها تختلف في ترتيب الذرات (المجموعات) في الفضاء بالنسبة إلى مستوى الرابطة المزدوجة أو دورة صغيرة.
Src \u003d "https://present5.com/presentation/73124296_273676330/image-24.jpg" alt \u003d "(! LANG: رابطة الدول المستقلة والأيزومرات العابرة لبوتين -2 كل ذرة\u003e C \u003d C Cis والأيزومرات العابرة بيوتين -2 كل ذرة\u003e C \u003d C
 "على هذا وعلى الجانب الآخر" من نهر Leita Cisleitania - اسم أراضي التاج النمساوي ؛ يظهر باللون الأحمر 1867-1918 Translatedia - اسم أراضي التاج الهنغاري ؛ يظهر باللون الأخضر
"على هذا وعلى الجانب الآخر" من نهر Leita Cisleitania - اسم أراضي التاج النمساوي ؛ يظهر باللون الأحمر 1867-1918 Translatedia - اسم أراضي التاج الهنغاري ؛ يظهر باللون الأخضر




 E ، Z- التسمية 2 1 E-1-nitro-1-bromo-2-chloropentene 1 2 Z-1-nitro-1-bromo-2-chloropentene 1. باستخدام قواعد Cahn-Ingold-Prelog ، حدد الأسبقية النسبية للبدائل ، مرتبطة برابطة مزدوجة ومنحهم أرقام الأولوية 1 أو 2.
E ، Z- التسمية 2 1 E-1-nitro-1-bromo-2-chloropentene 1 2 Z-1-nitro-1-bromo-2-chloropentene 1. باستخدام قواعد Cahn-Ingold-Prelog ، حدد الأسبقية النسبية للبدائل ، مرتبطة برابطة مزدوجة ومنحهم أرقام الأولوية 1 أو 2.
 أ) الذرة ذات العدد الذري الأعلى هي الأعلى بالنسبة للذرة ذات العدد الأقل. ب) إذا كانت ذرتان من النظائر ، فإن الذرة ذات العدد الكتلي الكبير لها الأفضلية. 2. إذا كانت المجموعتان الأقدمان موجودتان على نفس الجانب من مستوى الرابطة π ، فسيتم الإشارة إلى تكوين البدائل بالرمز Z. (من zusammen الألمانية معًا) إذا كانت هاتان المجموعتان على جانبي مستوى الرابطة π ، فسيتم الإشارة إلى التكوين بالرمز E ( من الجانب الألماني entgegen)
أ) الذرة ذات العدد الذري الأعلى هي الأعلى بالنسبة للذرة ذات العدد الأقل. ب) إذا كانت ذرتان من النظائر ، فإن الذرة ذات العدد الكتلي الكبير لها الأفضلية. 2. إذا كانت المجموعتان الأقدمان موجودتان على نفس الجانب من مستوى الرابطة π ، فسيتم الإشارة إلى تكوين البدائل بالرمز Z. (من zusammen الألمانية معًا) إذا كانت هاتان المجموعتان على جانبي مستوى الرابطة π ، فسيتم الإشارة إلى التكوين بالرمز E ( من الجانب الألماني entgegen)



 لويس باستور (27.12.1822-28.09.1895) كيميائي فرنسي ، أعظم باحث في القرن التاسع عشر "عدم التناسق هو ما يميز العضوي عن غير العضوي" (هذا القانون وضع الأساس للكيمياء الفراغية). تتمتع البلورات غير المتماثلة بالقدرة على تدوير الضوء المستقطب.
لويس باستور (27.12.1822-28.09.1895) كيميائي فرنسي ، أعظم باحث في القرن التاسع عشر "عدم التناسق هو ما يميز العضوي عن غير العضوي" (هذا القانون وضع الأساس للكيمياء الفراغية). تتمتع البلورات غير المتماثلة بالقدرة على تدوير الضوء المستقطب.
 Enantiomers هي أيزومرات مكانية ، ترتبط جزيئاتها ببعضها البعض ككائن وصورة مرآة غير متوافقة. (من اليونانية enantios - العكس).
Enantiomers هي أيزومرات مكانية ، ترتبط جزيئاتها ببعضها البعض ككائن وصورة مرآة غير متوافقة. (من اليونانية enantios - العكس).
 Chirality (chirality الإنجليزية ، من chéir - hand) هو مفهوم في الكيمياء يميز خاصية كائن ما ليكون غير متوافق مع انعكاسه في مرآة مسطحة مثالية.
Chirality (chirality الإنجليزية ، من chéir - hand) هو مفهوم في الكيمياء يميز خاصية كائن ما ليكون غير متوافق مع انعكاسه في مرآة مسطحة مثالية.






 فيشر إميل هيرمان (9.10.1852 ، Eiskirchen ، - 15.7.1919 ، برلين) ، الكيميائي العضوي الألماني والكيمياء الحيوية.
فيشر إميل هيرمان (9.10.1852 ، Eiskirchen ، - 15.7.1919 ، برلين) ، الكيميائي العضوي الألماني والكيمياء الحيوية.


 يمكن تحويل إسقاطات فيشر: l 1. عدد زوجي من التباديل للبدائل لا يغير الصيغة ؛ 2. عدد فردي من البدائل يؤدي إلى صيغة antipode (enantiomer) ؛ 3. يحظر تدوير الصيغة بمقدار 90 أو 270 ، وكذلك استنتاج الصيغة من هذا المستوى (تؤدي هذه الإجراءات إلى صيغة antipode) ؛ 4. يسمح بتناوب الصيغة بأكملها في مستوى الرسم بمقدار 180 ؛
يمكن تحويل إسقاطات فيشر: l 1. عدد زوجي من التباديل للبدائل لا يغير الصيغة ؛ 2. عدد فردي من البدائل يؤدي إلى صيغة antipode (enantiomer) ؛ 3. يحظر تدوير الصيغة بمقدار 90 أو 270 ، وكذلك استنتاج الصيغة من هذا المستوى (تؤدي هذه الإجراءات إلى صيغة antipode) ؛ 4. يسمح بتناوب الصيغة بأكملها في مستوى الرسم بمقدار 180 ؛
 التكوين النسبي في عام 1906 ، بناءً على اقتراح MA Rozanov L- and D-isomers (من الكلمات اللاتينية laevus - يسار وداكستر - يمين).
التكوين النسبي في عام 1906 ، بناءً على اقتراح MA Rozanov L- and D-isomers (من الكلمات اللاتينية laevus - يسار وداكستر - يمين).



 نظام Cahn - Ingold - Prelog؟ روبرت سيدني كان إنغولد كريستوفر بريلوغ فلاديمير (09.06.1899-15.09.1981) (28.10.1893-8.10.1970) (23.07.1906-07.01.1998) (بريطانيا العظمى) ( سويسرا)
نظام Cahn - Ingold - Prelog؟ روبرت سيدني كان إنغولد كريستوفر بريلوغ فلاديمير (09.06.1899-15.09.1981) (28.10.1893-8.10.1970) (23.07.1906-07.01.1998) (بريطانيا العظمى) ( سويسرا)



 يتم تحديد العدد الإجمالي للأيزومرات الضوئية بواسطة الصيغة N \u003d 2 n ، n هو عدد المراكز اللولبية. الأول III IV 2-amino-3-hydroxybutanoic acid
يتم تحديد العدد الإجمالي للأيزومرات الضوئية بواسطة الصيغة N \u003d 2 n ، n هو عدد المراكز اللولبية. الأول III IV 2-amino-3-hydroxybutanoic acid
 حمض الطرطريك I III IV erythro threo Epimers هي دياستيريومرات تختلف في تكوين مركز واحد غير متماثل
حمض الطرطريك I III IV erythro threo Epimers هي دياستيريومرات تختلف في تكوين مركز واحد غير متماثل

 Racemate (من اللاتينية racemus - العنب). عند خلط كميات متساوية من المجسمات الفراغية D - و L - ، يتم تكوين مخاليط غير نشطة بصريًا ، تسمى racemic S (من اللاتينية شريرة - يسار) و R (لاتينية مستقيم - يمين) ؛ الزميل يتم الإشارة إليه بواسطة RS. هضم المخاليط الراسيمية: 1. طريقة ميكانيكية (طريقة باستير). 2. الطريقة الميكروبيولوجية 3. الطريقة الأنزيمية. 4. الطريقة الكيميائية. اللوني تقارب
Racemate (من اللاتينية racemus - العنب). عند خلط كميات متساوية من المجسمات الفراغية D - و L - ، يتم تكوين مخاليط غير نشطة بصريًا ، تسمى racemic S (من اللاتينية شريرة - يسار) و R (لاتينية مستقيم - يمين) ؛ الزميل يتم الإشارة إليه بواسطة RS. هضم المخاليط الراسيمية: 1. طريقة ميكانيكية (طريقة باستير). 2. الطريقة الميكروبيولوجية 3. الطريقة الأنزيمية. 4. الطريقة الكيميائية. اللوني تقارب
 علاقة التركيب الكيميائي بتجسيد النشاط البيولوجي. الأدرينالين ، الأدرينالين IUPAC: 1 - (3 ، 4-ثنائي هيدروكسي فينيل) -2 ميثيلامينوثانول - هرمون من النخاع الكظري للحيوانات والبشر. وسيط الجهاز العصبي من ذوات الدم البارد. من بين اثنين من مضادات الأدرينالين ، يُظهر الأدرينالين R (-) أكبر نشاط دوائي.
علاقة التركيب الكيميائي بتجسيد النشاط البيولوجي. الأدرينالين ، الأدرينالين IUPAC: 1 - (3 ، 4-ثنائي هيدروكسي فينيل) -2 ميثيلامينوثانول - هرمون من النخاع الكظري للحيوانات والبشر. وسيط الجهاز العصبي من ذوات الدم البارد. من بين اثنين من مضادات الأدرينالين ، يُظهر الأدرينالين R (-) أكبر نشاط دوائي.

 علاقة التركيب الكيميائي بتجسيد النشاط البيولوجي. يُظهر الأيزوبروبيل أدرينالين (إيزادرين) dextrorotatory تأثيرًا أقوى بـ 800 مرة من تأثير توسع القصبات الهوائية الفعال.
علاقة التركيب الكيميائي بتجسيد النشاط البيولوجي. يُظهر الأيزوبروبيل أدرينالين (إيزادرين) dextrorotatory تأثيرًا أقوى بـ 800 مرة من تأثير توسع القصبات الهوائية الفعال.

 Diastereomers هي أيزومرات مكانية ، جزيئاتها لا ترتبط ببعضها البعض ككائن وصورة مرآة غير متوافقة.
Diastereomers هي أيزومرات مكانية ، جزيئاتها لا ترتبط ببعضها البعض ككائن وصورة مرآة غير متوافقة.

 التماثل التوافقي يحدث التشابه التوافقي نتيجة للترتيب المختلف لأجزاء من نفس الجزيء بالنسبة لبعضها البعض ، والتي تتحقق عن طريق تدوير هذه الأجزاء حول رابطة C-C بسيطة تربط ذرتين.
التماثل التوافقي يحدث التشابه التوافقي نتيجة للترتيب المختلف لأجزاء من نفس الجزيء بالنسبة لبعضها البعض ، والتي تتحقق عن طريق تدوير هذه الأجزاء حول رابطة C-C بسيطة تربط ذرتين.
 (من نموذج Lat.
(من نموذج Lat.







 69٪ 31٪ إجهاد Van der Waals ناتج عن قوى التنافر بين بدائل التكافؤ غير المقيدة الكبيرة الحجم.
69٪ 31٪ إجهاد Van der Waals ناتج عن قوى التنافر بين بدائل التكافؤ غير المقيدة الكبيرة الحجم.
ايزومرية يجند
ايزومرية يجندينقسم إلى رابطة (والتي يتم تحديدها من خلال نوع مختلف للتنسيق من نفس الرابطة) ، و ligand أيزومر نفسه
من أمثلة تماثل الرابطة وجود مجمعات نيترو ونتريت من الكوبالت (III) مع التركيبة K 3 و K 3 ، \u200b\u200bحيث يتم تنسيق NO 2 - يجند ، على التوالي ، من خلال ذرة نيتروجين أو ذرة أكسجين. مثال آخر هو تنسيق أيون ثيوسيانات NCS - من خلال ذرة نيتروجين أو من خلال ذرة كبريت ، مع تكوين مجمعات ثيوسياناتو- N- أو ثيوسياناتو- إس.
بالإضافة إلى ذلك ، يمكن أن تشكل الروابط ذات البنية المعقدة (على سبيل المثال ، الأحماض الأمينية) أيزومرات ، يؤدي تنسيقها إلى تكوين مجمعات من نفس التركيب بخصائص مختلفة.
التماثل الهندسي بسبب التوزيع غير المتكافئ للروابط في المجال الداخلي بالنسبة لبعضها البعض. الشرط الضروري للتشابه الهندسي هو وجود اثنين على الأقل من الروابط المختلفة في مجال التنسيق الداخلي. تتجلى التماثل الهندسي بشكل أساسي في المركبات المعقدة ذات الهيكل ثماني السطوح ، وهيكل مربع مسطح أو هيكل هرمي مربع.
لا تحتوي المركبات المعقدة ذات الهياكل الرباعية السطوح والمثلثية والخطية على أيزومرات هندسية ، حيث أن مواقع الروابط من نوعين مختلفين حول الذرة المركزية متكافئة.
يمكن أن تحتوي المجمعات ذات الهيكل المربع المسطح ، في وجود اثنين من الترابطات المختلفة L و L ′ ، بالفعل على اثنين من أيزومرين (cis- و trans-):
مثال على مركب معقد يحتوي على رابطة الدول المستقلة والأيزومرات العابرة وهو ثنائي كلورو دايامين بلاتين (II):
لاحظ أن المركب المركب للتكوين ذي الهيكل المربع المسطح لا يمكن أن يحتوي على أيزومرات: موضع ligand L '' محتمل بشكل متساوٍ في أي ركن من أركان المربع. عندما يظهر رابطان مختلفان ، فإن وجود اثنين من الأيزومرين (رابطة الدول المستقلة و trans) ، يختلفان في الخصائص ، أمر ممكن بالفعل. وبالتالي ، فإن cis-dichlorodiammineplatinum (II) عبارة عن بلورات برتقالية صفراء ، قابلة للذوبان في الماء بسهولة ، و trans-dichlorodiammineplatinum (II) عبارة عن بلورات صفراء شاحبة ، تكون قابلية ذوبانها في الماء أقل قليلاً من أيزومر رابطة الدول المستقلة.
مع زيادة عدد الروابط المختلفة في المجال الداخلي ، يزداد عدد الأيزومرات الهندسية. بالنسبة لنيترو (هيدروكسيل أمين) أمين (بيريدين) كلوريد البلاتين (II) كلوريد ، تم الحصول على كل الأيزومرات الثلاثة:
يمكن أن تحتوي مجمعات ثماني السطوح على العديد من الايزومرات. إذا كانت جميع الروابط الستة في مركب معقد من هذا النوع هي نفسها () أو يختلف واحد فقط عن الآخرين () ، فلا توجد إمكانية لترتيب مختلف للروابط فيما يتعلق ببعضها البعض. على سبيل المثال ، في مركبات الاوكتاهدرا ، فإن أي موضع للرابط L '' فيما يتعلق بروابط L الخمسة الأخرى سيكون مكافئًا وبالتالي يجب ألا يكون هناك أيزومرات:
ظهور اثنان ligands L ′ ′ في ثماني السطوحالمركبات المعقدة ستؤدي إلى إمكانية الوجود اثنين من الايزومرات الهندسية... في هذه الحالة ، هناك طريقتان مختلفتان لترتيب الروابط L '' بالنسبة لبعضهما البعض. على سبيل المثال ، الكاتيون من ثنائي هيدروكسي تيترااممين كوبالت (III) + يحتوي على اثنين من أيزومرين:
عند محاولة العثور على ترتيب متبادل آخر للروابط H 3 N و OH - والتي قد تختلف عن تلك المشار إليها أعلاه ، سنصل دائمًا إلى هيكل واحد من تلك المعطاة بالفعل.
مع زيادة عدد الروابط ذات التركيبات الكيميائية المختلفة في المجمع ، يزداد عدد الأيزومرات الهندسية بسرعة. سيكون للمركبات من هذا النوع أربعة أيزومرات ، وبالنسبة للمركبات من النوع الذي يحتوي على ستة روابط مختلفة ، يصل عدد الأيزومرات الهندسية إلى 15. لا تزال هذه المركبات المعقدة غير مفهومة جيدًا.
تختلف الأيزومرات الهندسية اختلافًا كبيرًا في خواصها الفيزيائية والكيميائية ، مثل اللون والقابلية للذوبان والكثافة والبنية البلورية وما إلى ذلك.
1. التماكب البنيوي.
2. التماثل التوافقي.
3. التماثل الهندسي.
4. تماثل بصري.
نظائر هي مواد لها نفس التركيب والوزن الجزيئي ، لكن لها خصائص فيزيائية وكيميائية مختلفة. تعود الاختلافات في خصائص الأيزومرات إلى الاختلافات في التركيب الكيميائي أو المكاني. في هذا الصدد ، هناك نوعان من التماثل.
ايزومرية
الهيكلي
مكاني
هيكل عظمي من الكربون
ترتيب
توافقي
الوظيفة الوظيفية
بصري
Interclass
هندسي
1. التماكب البنيوي
تختلف الأيزومرات الهيكلية في التركيب الكيميائي ، أي طبيعة وتسلسل الروابط بين الذرات في الجزيء. يتم عزل الايزومرات الهيكلية في شكل نقي. توجد كمواد فردية ومستقرة ، من أجل التحول المتبادل ، يلزم طاقة عالية - حوالي 350-400 كيلوجول / مول. فقط الايزومرات الهيكلية - توتومرات - هي في حالة توازن ديناميكي. تعتبر Tautomerism ظاهرة شائعة في الكيمياء العضوية. من الممكن مع نقل ذرة الهيدروجين المتنقلة في جزيء (مركبات الكربونيل ، الأمينات ، الدورات غير المتجانسة ، إلخ) ، التفاعلات داخل الجزيئية (الكربوهيدرات).
يتم تقديم جميع الأيزومرات الهيكلية في شكل صيغ هيكلية ويتم تسميتها بواسطة تسميات IUPAC. على سبيل المثال ، يتوافق تكوين С 4 Н 8 مع أيزومرات بنيوية:
و) مع هيكل عظمي كربوني مختلف
سلسلة C غير متفرعة - CH 3 -CH 2 -CH 2 -CH \u003d O (بيوتانال ، ألدهيد) و
متفرعة C- سلسلة -
 (2-ميثيل بروبانال ، ألدهيد) أو
(2-ميثيل بروبانال ، ألدهيد) أو
دورة -  (سيكلوبوتانول ، كحول دوري) ؛
(سيكلوبوتانول ، كحول دوري) ؛
ب) مع موقف مختلف للمجموعة الوظيفية
 بوتانون -2 ، كيتون.
بوتانون -2 ، كيتون.
في) مع تكوين مختلف للمجموعة الوظيفية
 3-بيوتينول -2 ، كحول غير مشبع ؛
3-بيوتينول -2 ، كحول غير مشبع ؛
د) metamerism
يمكن دمج ذرة غير متجانسة لمجموعة وظيفية في هيكل عظمي كربوني (حلقة أو سلسلة). أحد الأيزومرات المحتملة لهذا النوع من التماكب هو CH 3 - O - CH 2 - CH \u003d CH 2 (3-methoxypropene-1 ، ether) ؛
ه) توتومرية (كيتو إنول)
شكل اينول  شكل كيتو
شكل كيتو
تكون المواد الخام في توازن ديناميكي ، بينما يسود الشكل الأكثر ثباتًا ، شكل كيتو ، في الخليط.
بالنسبة للمركبات العطرية ، يتم اعتبار التماثل البنيوي فقط للسلسلة الجانبية.
2 - التماثل المكاني (الأيزومرية الفراغية)
الأيزومرات المكانية لها نفس التركيب الكيميائي ، وتختلف في الترتيب المكاني للذرات في الجزيء. هذا الاختلاف يخلق الاختلاف في الخصائص الفيزيائية والكيميائية. يتم تصوير الأيزومرات المكانية على أنها إسقاطات مختلفة أو صيغ كيميائية مجسمة. يسمى فرع الكيمياء الذي يدرس التركيب المكاني وتأثيره على الخصائص الفيزيائية والكيميائية للمركبات ، على اتجاه ومعدل تفاعلاتها ، بالكيمياء الفراغية.
و)التماثل التوافقي (الدوراني)
بدون تغيير أي من زوايا الرابطة أو أطوال الرابطة ، يمكن للمرء أن يتخيل العديد من الأشكال الهندسية (المطابقة) لجزيء تختلف عن بعضها البعض عن طريق الدوران المتبادل لرباعي الأسطح الكربوني حول الرابطة σ-C-C التي تربطها. يؤدي هذا الدوران إلى ظهور أيزومرات دورانية (المطابقة). طاقات المطابقة المختلفة ليست هي نفسها ، لكن حاجز الطاقة الذي يفصل الأيزومرات التوافقية المختلفة صغير بالنسبة لمعظم المركبات العضوية. لذلك ، في ظل الظروف العادية ، كقاعدة عامة ، من المستحيل تثبيت الجزيئات في شكل واحد محدد بدقة. عادة ، في حالة التوازن ، تتعايش العديد من الأيزومرات التوافقية التي تمر بسهولة في بعضها البعض.
يمكن اعتبار طرق التصوير وتسميات الأيزومرات باستخدام مثال جزيء الإيثان. بالنسبة له ، يمكن للمرء أن يتوقع وجود شكلين يختلفان قدر الإمكان في الطاقة ، والتي يمكن تصويرها على أنها توقعات المنظور (1) ("المنشرة") أو النتوءات رجل جديد(2):

يحجب التشكل المتخلف التشكل
في إسقاط المنظور (1) ، يجب تخيل اتصال С-С على أنه يذهب إلى مسافة ؛ ذرة الكربون على اليسار أقرب إلى الراصد ، والذرة التي على اليمين بعيدة عنه.
في إسقاط نيومان (2) ، يُنظر إلى الجزيء على طول رابطة CC. تشير ثلاثة خطوط متباعدة بزاوية 120 درجة من مركز الدائرة إلى روابط ذرة الكربون الأقرب إلى المراقب ؛ الخطوط "البارزة" من الدائرة هي روابط ذرة الكربون البعيدة.
يسمى التشكل الظاهر على اليمين مشوشة ... يذكرنا هذا الاسم أن ذرات الهيدروجين لكلا المجموعتين CH 3 متقابلة. أدى التشكل المعوق إلى زيادة الطاقة الداخلية وبالتالي فهو غير ملائم. يسمى التشكل الظاهر على اليسار تثبط ، مما يعني أن الدوران الحر حول الرابطة C-C "ممنوع" في هذا الوضع ، أي يوجد الجزيء في الغالب في هذا التشكل.
يُطلق على الحد الأدنى من الطاقة المطلوبة لتدوير جزيء ما حول رابطة معينة اسم حاجز الدوران لتلك الرابطة. يمكن التعبير عن حاجز الدوران في جزيء مثل الإيثان من حيث التغيير في الطاقة الكامنة للجزيء كدالة للتغيير في زاوية ثنائية السطوح (التواء - τ) للنظام. يوضح الشكل 1. ملف الطاقة الخاص بالدوران حول الرابطة C - C في الإيثان. يبلغ حاجز الدوران الذي يفصل بين شكلي الإيثان حوالي 3 كيلو كالوري / مول (12.6 كيلو جول / مول). تتوافق الحدود الدنيا لمنحنى الطاقة الكامنة مع المطابقات المثبطة ، والحد الأقصى - مع المطابقات المحجوبة. نظرًا لأن طاقة بعض تصادمات الجزيئات في درجة حرارة الغرفة يمكن أن تصل إلى 20 كيلو كالوري / مول (حوالي 80 كيلو جول / مول) ، يمكن التغلب بسهولة على هذا الحاجز البالغ 12.6 كيلو جول / مول ويعتبر الدوران في الإيثان حرًا. في مزيج من جميع المطابقة الممكنة ، تسود المطابقات المثبطة.

رسم بياني 1. مخطط الطاقة المحتملة لتوافق الإيثان.
بالنسبة للجزيئات الأكثر تعقيدًا ، يزداد عدد التوافقات الممكنة. وذلك ل ن-البوتان ، من الممكن بالفعل تصوير ستة مطابقة ناشئة عن الدوران حول رابطة C 2 - C 3 المركزية وتختلف في الترتيب المتبادل لمجموعات CH 3. تختلف التكوينات المختلفة المسدودة والمتأخرة للبيوتان في الطاقة. التماثلات المتخلفة هي أكثر ملاءمة بقوة.

يظهر الشكل 2 ملف تعريف الطاقة للدوران حول رابطة C 2-C 3 في البيوتان.

الصورة 2. مخطط الطاقة المحتملة لمطابقة n- البوتان.
بالنسبة للجزيء ذي السلسلة الكربونية الطويلة ، يزداد عدد الأشكال التوافقية.
يتميز جزيء المركبات الحلقية بأشكال مختلفة من الحلقات التوافقية (على سبيل المثال ، للهكسان الحلقي كرسي ذو ذراعين, حمام, إلتواء-نماذج).
إذن ، المطابقة هي أشكال مكانية مختلفة لجزيء بتكوين معين. المطابقة عبارة عن هياكل أيزومرية مجسمة تتوافق مع الحد الأدنى للطاقة على مخطط الطاقة الكامنة ، وهي في حالة توازن متنقل وقادرة على التحويل البيني بالتناوب حول روابط بسيطة.
إذا أصبح الحاجز أمام مثل هذه التحولات مرتفعًا بدرجة كافية ، فيمكن فصل أشكال الأيزوميرات الفراغية (على سبيل المثال ، ثنائي الفينيل النشط بصريًا). في مثل هذه الحالات ، لم يعد المرء يتحدث عن المطابقات ، ولكن عن الأيزومرات الفراغية الموجودة بالفعل.
ب) التماثل الهندسي
تنتج الايزومرات الهندسية من عدم وجود:
1. دوران ذرات الكربون بالنسبة لبعضها البعض - نتيجة لصلابة الرابطة المزدوجة C \u003d C أو الهيكل الدوري ؛
2. مجموعتان متطابقتان في ذرة كربون واحدة لرابطة أو دورة مزدوجة.
يمكن عزل الأيزومرات الهندسية ، على عكس المطابقة ، في شكل نقي وتوجد كمواد فردية ومستقرة. من أجل التحول المتبادل ، يلزم وجود طاقة أعلى - حوالي 125-170 كيلوجول / مول (30-40 كيلو كالوري / مول).
هناك أيزومرات رابطة الدول المستقلة (Z ، E) ؛ رابطة الدول المستقلة- الأشكال عبارة عن أيزومرات هندسية حيث توجد نفس البدائل على جانب واحد من مستوى الرابطة أو الحلقة ، نشوة- الأشكال هي أيزومرات هندسية حيث توجد نفس البدائل على جوانب متقابلة من مستوى الرابطة أو الحلقة.
أبسط مثال على ذلك هو أيزومرات البيوتين -2 ، والتي توجد في شكل أيزومرات هندسية عابرة لرابطة الدول المستقلة:


رابطة الدول المستقلة-بيوتين -2 ترانس-بيوتين -2
درجة حرارة الانصهار
138.9 0 درجة مئوية - 105.6 0 درجة مئوية
درجة حرارة الغليان
3.72 0 ج 1.00 0 ج
كثافة
1،2 - ثنائي كلورو حلقي البروبان موجود في شكل رابطة الدول المستقلة ، عبر الأيزومرات:


cis-1،2-dichlorocyclopropane trans-1،2-dichlorocyclopropane
في الحالات الأكثر تعقيدًا ، قم بتطبيق ض، التسمية الإلكترونية (تسمية كان ، إنغولد ، بريلوغ - KIP ، تسمية أقدمية النواب). بالاقتران
1-برومو -2-ميثيل-1-كلوروبوتين -1 (Br) (CI) C \u003d C (CH 3) - CH 2-CH 3 جميع البدائل على ذرات الكربون ذات الرابطة المزدوجة مختلفة ؛ لذلك ، يوجد هذا المركب في شكل Z- ، E- أيزومرات هندسية:


E-1-bromo-2-methyl-1-chlorobutene-1 Z-1-bromo-2-methyl-1-chlorobutene-1.
للإشارة إلى تكوين الأيزومر ، حدد موقع البدائل الكبرى في الرابطة المزدوجة (أو الدورة) - Z- (من Zusammen الألماني - معًا) أو E- (من Entgegen الألمانية - المقابل).
في النظام الإلكتروني Z ، تعتبر البدائل ذات العدد الترتيبي (الذري) الكبير من كبار السن. إذا كانت الذرات المرتبطة مباشرة بذرات الكربون غير المشبعة هي نفسها ، فإنها تنتقل إلى "الطبقة الثانية" ، إذا لزم الأمر ، إلى "الطبقة الثالثة" ، إلخ.
في الإسقاط الأول ، تكون المجموعات الأقدم معاكسة لبعضها البعض بالنسبة إلى الرابطة المزدوجة ، لذلك هذا هو الأيزومر E. في الإسقاط الثاني ، توجد المجموعات الأقدم على جانب واحد من الرابطة المزدوجة (معًا) ، لذلك هذا هو Z-isomer.
تنتشر الأيزومرات الهندسية في الطبيعة. على سبيل المثال ، البوليمرات الطبيعية هي المطاط (أيزومر رابطة الدول المستقلة) وجوتا بيرشا (أيزومر ترانس) ، وأحماض الفوماريك الطبيعية (حمض عبر بوتينيويك) وأحماض مالييك الاصطناعية (حمض سي-بوتينديويك) ، في تكوين الدهون هناك أحماض أوليك ولينوليك ولينولينيك.
في) التماثل البصري
يمكن أن تكون جزيئات المركبات العضوية موانع أو آيرالية. Chirality (من اليونانية. Сheir - hand) هو عدم توافق جزيء مع صورته المرآة.
المواد اللولبية قادرة على تدوير مستوى استقطاب الضوء. تسمى هذه الظاهرة بالنشاط البصري ، والمواد المقابلة - نشطة ضوئيا... تحدث المواد الفعالة بصريًا كأزواج الأضداد البصرية - أيزومرات ، خصائصها الفيزيائية والكيميائية هي نفسها في ظل الظروف العادية ، باستثناء واحد - علامة دوران مستوى الاستقطاب: أحد المضادات الضوئية ينحرف عن مستوى الاستقطاب إلى اليمين (+ ، أيزومر ديكستوريوتوري) ، والآخر إلى اليسار (- ، ليفوجيترات) يمكن تحديد تكوين الأكواد الضوئية بشكل تجريبي باستخدام أداة - مقياس الاستقطاب.
يظهر التماثل البصري عندما يحتوي الجزيء ذرة كربون غير متماثلة(هناك أسباب أخرى لظاهرة الجزيء)... هذا هو اسم ذرة الكربون في sp 3 - التهجين والمرتبط بأربعة بدائل مختلفة. هناك نوعان من الترتيبات الممكنة رباعي السطوح للبدائل حول الذرة غير المتماثلة. علاوة على ذلك ، لا يمكن الجمع بين الشكلين المكانيين بأي دوران ؛ أحدهما صورة معكوسة للآخر:

يشكل كلا الشكلين المرآتين زوجًا من المضادات الضوئية أو المتشاهدين .
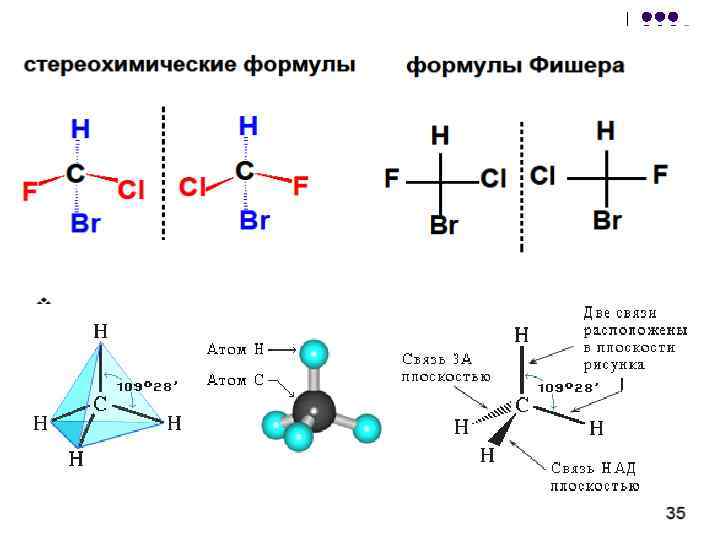
تُصوَّر الأيزومرات الضوئية في شكل صيغ إسقاط إي فيشر. يتم الحصول عليها عن طريق إسقاط جزيء بذرة كربون غير متماثلة. في هذه الحالة ، يتم الإشارة إلى ذرة الكربون غير المتماثلة نفسها على المستوى بنقطة ، على الخط الأفقي يشار إلى رموز البدائل البارزة أمام مستوى الرسم. يشير الخط العمودي (متقطع أو متصل) إلى البدائل التي تمت إزالتها خارج مستوى الرسم. فيما يلي طرق مختلفة لكتابة معادلة الإسقاط المقابلة للنموذج الأيسر في الشكل السابق:

في الإسقاط ، تظهر سلسلة الكربون الرئيسية رأسياً ؛ الوظيفة الرئيسية ، إذا كانت في نهاية السلسلة ، يشار إليها في الجزء العلوي من الإسقاط. على سبيل المثال ، يتم تمثيل الصيغ الكيميائية الفراغية والإسقاط (+) و (-) ألانين - CH 3 - * CH (NH 2) -COOH على النحو التالي:

يسمى الخليط الذي يحتوي على نفس المحتوى المتماثل لزميل السباق. Racemate ليس له أي نشاط بصري ويتميز بخصائص فيزيائية مختلفة عن المتغيرات.
قواعد التحويل لصيغ الإسقاط.
1. يمكن تدوير الصيغ في مستوى الرسم بمقدار 180 درجة دون تغيير معناها الكيميائي الفراغي:

2. لا يغير اثنان (أو أي عدد زوجي) من البدائل في ذرة غير متماثلة المعنى الفراغي الكيميائي للصيغة:

3. يؤدي تبديل واحد (أو أي رقم فردي) للبدائل في المركز غير المتماثل إلى صيغة المضاد البصري:

4. الدوران في مستوى الرسم بمقدار 90 درجة يحول الصيغة إلى نقيض.
5. دوران أي ثلاثة بدائل في اتجاه عقارب الساعة أو عكس اتجاه عقارب الساعة لا يغير المعنى الفراغي الكيميائي للصيغة:
 6. لا يمكن اشتقاق صيغ الإسقاط من مستوى الرسم.
6. لا يمكن اشتقاق صيغ الإسقاط من مستوى الرسم.
للمركبات العضوية نشاط بصري ، في الجزيئات التي تكون فيها الذرات الأخرى مراكز مراوان ، على سبيل المثال ، السيليكون والفوسفور والنيتروجين والكبريت.
توجد مركبات بها عدة ذرات كربون غير متماثلة في الشكل دياستيريومرز ، بمعنى آخر. الايزومرات المكانية التي لا تشكل نقيضات ضوئية مع بعضها البعض.
يختلف Diastereomers عن بعضها البعض ليس فقط في الدوران البصري ، ولكن أيضًا في جميع الثوابت الفيزيائية الأخرى: لها نقاط انصهار وغليان مختلفة ، وذوبان مختلف ، إلخ.
يتم تحديد عدد الأيزومرات المكانية بواسطة صيغة فيشر N \u003d 2 n ، حيث n هو عدد ذرات الكربون غير المتماثلة. قد ينخفض \u200b\u200bعدد الأيزومرات الفراغية بسبب التناظر الجزئي الذي يظهر في بعض الهياكل. تسمى diastereomers الخاملة بصريا ميسو-نماذج.
تسمية الأيزومرات الضوئية:
أ) D- ، L- التسمية
لتحديد سلسلة D- أو L من الأيزومير ، تتم مقارنة التكوين (موضع مجموعة OH في ذرة الكربون غير المتماثلة) مع تكوينات متناهية الصغر لألدهيد الجلسرين (مفتاح الجلسرين):

L- الجلسرين ألدهيد D- جلسرين ألدهيد
يقتصر استخدام المصطلحات D- و L حاليًا على ثلاث فئات من المواد النشطة بصريًا: الكربوهيدرات والأحماض الأمينية والأحماض الهيدروكسية.
ب) R - ، S- تسمية (Kahn ، Ingold و Prelog تسمية)
لتحديد التكوين R (يمين) أو S (يسار) للأيزومير البصري ، من الضروري ترتيب البدائل في رباعي الوجوه (الصيغة الكيميائية الفراغية) حول ذرة الكربون غير المتماثلة بطريقة يكون فيها البديل الأدنى (عادة الهيدروجين) هو الاتجاه "من المراقب". إذا كان انتقال البدائل الثلاثة الأخرى من الأقدم إلى المتوسط \u200b\u200bوالصغار في الأقدمية يحدث في اتجاه عقارب الساعة ، فهذا هو R-isomer (يتزامن الانخفاض في الأقدمية مع حركة اليد عند كتابة الجزء العلوي من الحرف R). إذا حدث الانتقال عكس اتجاه عقارب الساعة ، فسيكون S. - أيزومر (يتزامن انخفاض الأسبقية مع حركة اليد عند كتابة الجزء العلوي من الحرف S).
لتحديد التكوين R أو S للأيزومير البصري باستخدام صيغة الإسقاط ، من الضروري ترتيب البدائل بعدد زوجي من التباديل بحيث يكون أقلها في أسفل الإسقاط. يتوافق الانخفاض في أسبقية البدائل الثلاثة المتبقية في اتجاه عقارب الساعة مع التكوين R ، عكس اتجاه عقارب الساعة - إلى التكوين S.
يتم الحصول على الايزومرات الضوئية بالطرق التالية:
أ) العزلة عن المواد الطبيعية التي تحتوي على مركبات نشطة بصريًا ، على سبيل المثال ، البروتينات والأحماض الأمينية والكربوهيدرات والعديد من أحماض الهيدروكسي (الطرطريك والماليك واللوز) وهيدروكربونات التربين وكحولات التربين والكيتونات والمنشطات والقلويدات ، إلخ.
ب) انقسام زملائه ؛
ج) التركيب غير المتماثل.
د) الإنتاج البيوكيميائي للمواد الفعالة بصريا.
هل تعرف أن
ظاهرة ايزومرية (من اليونانية - أنااستغاثة - مختلف و ميروس - حصة ، جزء) افتتح عام 1823. J. Liebig و F. Wöhler في مثال أملاح اثنين من الأحماض غير العضوية: سيانيك H-O-C≡N والمتفجرات H-O-N \u003d C.
في عام 1830 ، قام J. Dumas بتوسيع مفهوم isomerism إلى المركبات العضوية.
في عام 1831. المصطلح "ايزومر" للمركبات العضوية اقترحه J. Berzelius.
تتميز الأيزومرات المجسمة للمركبات الطبيعية بأنشطة بيولوجية مختلفة (الأحماض الأمينية ، والكربوهيدرات ، والقلويدات ، والهرمونات ، والفيرومونات ، والمواد الطبية ذات الأصل الطبيعي ، وما إلى ذلك).
الأيزومرات الهندسية هي أيزومرية رابطة الدول المستقلة ، أو أيزومرية EZ. تعتمد أفعالهم على الدوران المحدود للروابط الكربونية المزدوجة أو المفردة في المركبات الحلقية.في المركب الدوري ، يكون الدوران بين الرابطة الكربونية الأحادية محدودًا ويتم ربط مجموعتين مختلفتين بكل أيزومر كربون بطريقة مماثلة. غالبًا ما تختلف هذه الأيزومرات الهندسية في خصائصها الفيزيائية. هذا يرجع إلى شكل الأيزومرات والعزم الكلي ثنائي القطب. إذا بقيت الذرتان ذات الأولوية القصوى على نفس الجانب من الأيزومر ، فسيتم تعيينهما على أنهما Z ، وإذا كانا على الجانب الآخر ، فإن E.
تاريخ موجز للايزومرية
يعد مفهوم التماثل الدستوري خطوة مهمة إلى الأمام في تاريخ الكيمياء الحديثة ، وخاصة في تطوير الكيمياء العضوية. بحلول نهاية القرن الثامن عشر الميلادي ، تم عزل العديد من المواد النقية عن طريق دراسة كيمياء "الحيوان" و "النبات". حصل كارل فيلهلم شيل (1742-1786) على العديد منها. بسبب التنوع الكبير في المركبات العضوية ، قدمت كل مادة جديدة تركيبة عنصرية مختلفة ، والتي تتوافق مع الملاحظة العامة من الكيمياء "المعدنية". زاد عدد المركبات العضوية المعزولة في أوائل القرن التاسع عشر ، من خلال التعرف على المواد المختلفة.
كتب توماس طومسون في كتابه عن تاريخ الكيمياء عام 1830 ما يلي:
طبق برزيليوس نظرية الذرة أيضًا على المملكة النباتية ، حيث قام بتحليل العديد من الأحماض النباتية ، وعرض تكوينه الذري ، ولكن تبرز هنا صعوبة ، في الحالة الحالية لمعرفتنا ، لا يمكننا التغلب عليها. هناك نوعان من الأحماض التي تتكون من نفس الذرات بالضبط. الآن ، كيف يفترض بنا أن نفسر هذا الاختلاف المذهل في العقارات؟ لا شك في اختلاف الطرق التي توجد بها الذرات في كل منها.
استخدم طومسون بعد ذلك مخططات مختلفة للرموز الذرية المستخدمة في ذلك الوقت لشرح سبب وجود خواص فيزيائية وكيميائية مختلفة لحمضين لهما نفس التركيب الأولي ، يشار إليهما بالأيزومرات الهندسية.
حتى أوائل القرن التاسع عشر ، كان يُعتقد أن هذه المواد الكيميائية الموجودة في الكائنات الحية لها حيوية خاصة مرتبطة بالكائنات الحية ، وأنها ضرورية في الأنظمة الحية للتكاثر. في عام 1828 ، قام Wöhler بتجميع عينة من اليوريا ، (NH2) 2CO (أيضًا CH4N2O) ، والتي لا يمكن تمييزها عن اليوريا التي تفرز من البول البيولوجي.
قام بتحضير هذه المادة "الحيوانية" من مادة بداية غير عضوية (معدنية) من سيانات الأمونيوم ، (NH4) NCO (أيضًا CH4N2O) ، والتي تنتج عن مزيج من كلوريد الأمونيوم وسيانات الفضة. وهكذا ، انهار الحاجز بين التزاوج "الحي" و "غير الحي".
في أيزومر رابطة الدول المستقلة ، تبقى مجموعتان متشابهتان على جانب واحد من الرابطة المزدوجة ، بينما في الأيزومر العابر يظلان في الجانب المقابل. على سبيل المثال ، يحتوي 2-بيوتين على اثنين من أيزومرين ، رابطة الدول المستقلة و trans.
في أيزومر رابطة الدول المستقلة ، تظل مجموعتان من الميثيل ومجموعتا الهيدروجين على نفس الجانب من الرابطة المزدوجة ، بينما في الأيزومر العابر يظلون على الجانب الآخر.
عندما تكون مجموعة واحدة أو أكثر من المجموعات المرتبطة برابطة مزدوجة غير متماثلة ، فإن الأيزومرات تسمى E أو Z. لإعلام هذا النوع ، سيحتاج المستخدم إلى الإشارة إلى صيغ الهيدروكربونات التي تحتوي على أيزومرات هندسية وتحديد الذرة ذات الأولوية القصوى (أعلى رقم ذري). مرتبطة بكل رابطة مزدوجة C. إذا بقيت الذرتان اللتان لهما الأولوية القصوى على نفس الجانب من الأيزومر ، والذي تم تحديده على أنه Z ، وإذا كانا على الجانب المقابل ، يُسمى E.

على سبيل المثال ، 1 - البروم - 1 - يحتوي الفلوروبروبان على اثنين من أيزومرين. في Z-1 - البروم - 1 - الفلوروبروبان ، يمكن ملاحظة أن البروم له أولوية أعلى أو رقم ذري أعلى (35) من الفلور (9) ، المرتبط بـ C-1. يحتوي الكربون على عدد ذري \u200b\u200bأعلى (6) من الهيدروجين (1) المرتبط بـ C-2 لهذا المركب. نظرًا لأن ذرات الكربون ذات الأولوية القصوى (من مجموعة CH3) والبروم المرتبط بهاتين ذرتين من الكربون موجودان على جانب واحد ، يتم تعريف هذا المركب على أنه Z ، ومن ناحية أخرى ، في E-1 - البروم - 1 - فلوروبروبان ، الذرات ذات أعلى تكون أولوية C والبروم على الجانب الآخر ، ولهذا يطلق عليه اسم E-isomer.
الرابطة المزدوجة للكربون والكربون
الأيزومرات عبارة عن جزيئين لهما نفس التركيب الذري ولكنهما غير متطابقين. يمكن ربط الذرات في الأيزومرين بترتيب مختلف (التماثل البنيوي) ، أو يمكن ربطها بنفس الطريقة ، ولكن لها اتجاه مختلف - الفراغ الفراغي المكاني.
يجب أن يفي أيزومر هيكلي وهندسي في حالات خاصة - الأيزومر الفراغي ، بمتطلبين:
- هناك دوران محدود في الجزيء.
- كلتا الذرتين المشاركة في الرابطة التقييدية لها مجموعتان وظيفيتان مختلفتان لهما.
مثال شائع على الدوران المقيد هو الرابطة المزدوجة للكربون والكربون. تشمل هذه السندات سند pi ؛ وفي معظم الأحوال ، لا يكون كسرها مربحًا.

الأيزومرات الهندسية لها بنية تؤثر على الخصائص الفيزيائية للمركب.
نظام رابطة الدول المستقلة / عبر
تسمية Cis / Trans هي أبسط نظام اتصال. أولاً ، يتم تحديد أطول سلسلة كربون في الجزيء ، ثم يتم تحديد المجموعات الوظيفية ذات الأهمية. في أيزومر رابطة الدول المستقلة ، تكون المجموعتان المعنيتان على نفس الجانب من الرابطة المزدوجة (cis تعني "على نفس الجانب" باللاتينية). في الأيزومر العابر ، تكون المجموعتان قيد النظر على جانبي الرابطة المزدوجة (تعني عبر اللغة اللاتينية). على سبيل المثال ، هناك نوعان من الأيزومرين الهندسيين المختلفين من بيوتين -2.

كلتا ذرات الرابطة المزدوجة لها نفس المجموعتين مثل هاتين المجموعتين ، لكنهما مختلفتان عن بعضهما البعض في إحدى ذرات الكربون المزدوج. تصبح المهمة أكثر تعقيدًا حيث تصبح السلاسل الجانبية والمجموعات الوظيفية أكثر تعقيدًا.
يستخدم نظام التسمية IUPAC الرسمي تعيين E / Z. لا توجد علاقة محددة بين cis / trans و E / Z ، والنظامين غير قابلين للتبادل. يستخدم تعيين E / Z قواعد أولوية Cahn-Ingold-Prelog ويعتبر أكثر موثوقية. اسم IUPAC لحمض الفوماريك هو الأيزومر العابر بالصيغة HO2CCH \u003d CHCO2H وحمض الماليك هو حمض cis-butenedioic.

IUPAC هو الاتحاد الدولي للكيمياء البحتة والتطبيقية ، والذي يضع القواعد والمعايير الدولية لتسمية المواد الكيميائية بجميع اللغات.
في الرابطة الحلقية ، يكون الدوران بين الرابطة الكربونية الأحادية محدودًا. وبالتالي ، بالنسبة لهذا النوع من المركبات ، يمكن أيضًا التماثل المتماثل إذا تم ربط مجموعتين مختلفتين بكل كربون. هناك نوعان من أيزومرين من 1،2-ثنائي ميثيل سيكلوبروبان.

أحدهما هو أيزومر رابطة الدول المستقلة ، حيث توجد مجموعتان من الميثيل على جانب واحد ، والآخر هو الأيزومر العابر ، حيث توجد مجموعتان من الميثيل على الجانب الآخر.
تختلف الايزومرات الهندسية في خصائصها الفيزيائية. هذا يرجع إلى شكل الايزومرات والعزم الكلي ثنائي القطب. على سبيل المثال ، تختلف في درجة الغليان. نقاط غليان رابطة الدول المستقلة والأيزومرات العابرة لـ 1،2-ثنائي كلورو إيثيلين هي 60.3 درجة مئوية و 47.5 درجة مئوية ، على التوالي.
في أيزومر رابطة الدول المستقلة ، فإن وجود رابطتين ثنائي القطب (C-Cl) يعطي ثنائي أقطاب جزيئي مشترك. هذا يؤدي إلى قوى ثنائي القطب ثنائي القطب بين الجزيئات. لهذه القوة ، يحتوي أيزومر رابطة الدول المستقلة على نقطة غليان أعلى من الأيزومر العابر ، حيث يتم إلغاء رابطتين ثنائي القطب (C-Cl) بسبب موقعهما في الاتجاه المعاكس.
السبب في عدم إمكانية تدوير الرابطة المزدوجة للكربون والكربون هو وجود رابطين يربطان ذرات الكربون معًا ويجب كسر رابطة pi. تتشكل روابط pi عن طريق التداخل الجانبي بين المدارات p. إذا حاول المرء تدوير الرابطة المزدوجة للكربون والكربون ، فلن تصطف المدارات p ، وبالتالي سيتم كسر رابطة pi. هذا يتطلب طاقة ، وهذا يحدث فقط إذا كان الاتصال ساخنًا جدًا.
من السهل جدًا التغاضي عن العناصر المهمة للأيزومرات الهندسية عند إنشاء الصيغ الهيكلية أثناء الانكماش. على سبيل المثال ، من المغري جدًا رسم but-2-ene ؛ إذا كتبه المستخدم بشكل خاطئ ، فلن يكون المركب بعد ذلك متماكبًا. إذا كان هناك أدنى تلميح إلى أنه يمكن استخدام أيزومر ، فمن الضروري دائمًا استخدام مركبات تحتوي على روابط كربون-كربون مزدوجة تظهر زوايا صحيحة (120 درجة) حول ذرات الكربون في نهايات الرابطة. بمعنى آخر ، يجب عليك استخدام التنسيق الموضح في الشكل.

المركبات التي تحتوي على رابطة كربون-كربون مزدوجة لها دوران محدود. للحصول على أيزومرات ، يجب استيفاء المتطلبات الأساسية التالية:
- دوران محدود ، يشتمل عادة على رابطة ثنائية بين كربون وكربون ؛
- مجموعتين مختلفتين في الطرف الأيسر من الرابط ومجموعتين مختلفتين في الطرف الأيمن.
لا يهم إذا كانت المجموعات اليسرى هي نفسها المجموعات الصحيحة أم لا.
تشتمل الأيزومرات الهندسية للألكينات على عدد من المركبات التي تتكون من ذرات C و H في سلسلة الكربون. تتضمن هذه المجموعة سلسلة متماثلة مع الصيغة CnH2n. أبسط ألكين هو الإيثين ، فهو يحتوي على ذرتين من الكربون والصيغة C2H4.

تظهر الصيغة البنائية للإيثين في الشكل أعلاه. في سلاسل الألكين الأطول ، يتم ربط ذرات كربون إضافية ببعضها البعض عبر الروابط التساهمية وحدها. ترتبط كل ذرة كربون أيضًا بذرات هيدروجين كافية لتشكيل ما مجموعه أربعة روابط تساهمية فردية.
في السلاسل التي تحتوي على أربع ذرات C أو أكثر ، يمكن أن توجد الرابطة المزدوجة في مواضع مختلفة ، مما يؤدي إلى تكوين أيزومرات هيكلية. بالإضافة إلى الأيزومرات الهيكلية ، تشكل الألكينات أيضًا متجانسات مجسمة. نظرًا لأن الدوران حول الرابطة المتعددة محدود ، تظل المجموعات المرتبطة بذرات الرابطة المزدوجة دائمًا في نفس المواضع النسبية.
تسمح هذه المواضع "المغلقة" للكيميائيين بتحديد أيزومرات مختلفة من البدائل من أجل تحديد المادة التي بها أيزومرات هندسية. على سبيل المثال ، يحتوي أيزومر هيكلي واحد لـ C5H10 على الأيزومرات الفراغية التالية.

الأيزومر الموجود على اليسار ، حيث يوجد بدائلين (مجموعات الميثيل والإيثيل) على جانب واحد من الرابطة المزدوجة ، يسمى أيزومر رابطة الدول المستقلة ، بينما الأيزومر الموجود على اليمين مع بدائلين غير هيدروجين على الجانبين المتقابلين هو الأيزومر العابر.
على سبيل المثال ، الكلور له الأسبقية لأنه أثقل. على الجانب الأيمن ، البروم متفوق على الكربون. ثالثًا ، يتم تحديد مواقع ذرتين من الرتبة الأعلى. إذا كانت هناك ذرتان في وضع رابطة الدول المستقلة ، يكون الترتيب هو Z (من zusammen الألمانية ، والتي تعني "معًا"). إذا كانت الذرات ، أو المجموعات ، في وضع التحويل ، يكون الترتيب هو E (من كلمة entgegen الألمانية ، والتي تعني "العكس").
أيزومرات هندسية بيوتين عبارة عن ألكين ذو رابطة مزدوجة صلبة. هذا يعني أن هناك أربعة ايزومرات ، وليس ثلاثة ، في موضع الرابطة المزدوجة. يوجد الهيدروكربون الخامس والسادس من نفس التركيب ، لكنهما ليسا ألكينات ، على الرغم من نفس الصيغة.

يشغل تشكيل الحلقة من cyclobutane أو methylcyclopropane مساحة ذرتين من الهيدروجين كرابطة مزدوجة ، مما يؤدي إلى حقيقة أن لديهم صيغًا متطابقة مع مختلف البيوتين.
أمثلة الأيزومرات الهندسية:
- 1-بيوتيلين (1-بيوتين) ؛
- أيزو بيوتلين (2 ميثيل بروبين) ؛
- رابطة الدول المستقلة - 2 - بيوتلين (رابطة الدول المستقلة - 2 - بيوتين) ؛
- ترانس -2-بيوتلين (ترانس -2-بيوتين).
والمزايا: سيكلوبوتان وميثيل سيكلوبروبان - وكلاهما له نفس الصيغة التجريبية مثل أيزومرات البيوتين ، لكنهما ليسا ألكينات. الاسم الأول هو الاسم "الشائع" أو "التافه" ، والاسم الوارد بين قوسين هو اسم IUPAC.
يستخدم البيوتين العديد من الاستخدامات ، من الوقود في السيارة إلى أكياس البقالة التي يحملها يوميًا مئات الملايين من الأشخاص حول العالم. الصيغة الكيميائية للبوتين هي C4H8 ، مما يعني أنه يحتوي على أربع ذرات C وثماني ذرات H ، ويشير المركب إلى الألكين.
هناك العديد من الأيزومرات المختلفة أو الهياكل الجزيئية التي يمكن أن يشكلها هذا المركب (تظهر أسماء IUPAC بين قوسين):
- ألفا بيوتلين (but-1-ene) ؛
- رابطة الدول المستقلة - بيتا - بيوتلين - ((2Z) - لكن - 2 - إن) ؛
- ترانس بيتا بوتيلين - ((2E)-but-2-ene) ؛
- إيزوبيوتيلين (2-ميثيل بروب-1-إن).

على الرغم من أنهم جميعًا لديهم نفس الصيغة ، إلا أن هياكلهم مختلفة. العلاقات بين كل من هذه الأيزومرات الهندسية هي علاقات دستورية في الغالب ، مما يعني أن لها نفس الصيغة الجزيئية ، ولكن علاقات مختلفة. الاستثناءات هي cis-beta-butylene و trans-beta-butylene.
يعرف الكثير من الناس أن الدهون المتحولة ضارة للبشر ، وأن الدهون غير المشبعة مفيدة لهم. الفرق الوحيد بين هذين الدهون هو أن أحدهما لديه رابطة متحولة والآخر لديه رابطة رابطة الدول المستقلة ، ولكن هذا التمايز الطفيف يمكن أن يؤثر بشكل كبير على وظيفة الجزيء.
مع cis-beta-butylene و trans-beta-butylene ، تكون الذرات في نفس الترتيب ، لكن الأقطاب مختلفة. ايزومر رابطة الدول المستقلة هو قطبي مع كلا المجموعتين CH3 على نفس الجانب. وهذا يجعله ضخمًا ومعقدًا حقًا ، فالإيزومر العابر غير قطبي ، وتتناوب مجموعات CH3 الضخمة ، مما يعطي مساحة أكبر في الجزيء. هذه النسبة تسمى isomerism رابطة الدول المستقلة. ايزومرات رابطة الدول المستقلة قطبية ، بينما الايزومرات العابرة ليست كذلك.
على الرغم من أن كل من أيزومرات البيوتين هذه تتكون من نفس المواد ، إلا أن لكل منها خصائص فيزيائية مختلفة. على سبيل المثال نقطة الغليان:
- Cis-beta-butylene: 3.7 درجة مئوية.
- ترانس بيتا البيوتيلين: 0.8 درجة مئوية.
- الايزوبيوتيلين: -6.9 درجة مئوية.
- ألفا بيوتلين: -6.3 درجة مئوية.
مواد لانتاج البلاستيك
البيوتين عبارة عن ألكينات بأربع ذرات كربون ، C4H8. هناك العديد من الايزومرات الهيكلية والتكوينية المختلفة للبوتين ، بما في ذلك الايزومرات الهندسية والبصرية. جميع البيوتين الأربعة لها خصائص فيزيائية متشابهة ، كونها غازات عديمة اللون وثقيلة في الماء وقابلة للذوبان بسهولة في الأثير والألكانات. يتم تفسير الاختلافات في الخصائص الفيزيائية من خلال بنية الجزيئات. على سبيل المثال ، cis-But-2-en لديه نقطة غليان أعلى من trans-But-2-en لأنه ثنائي القطب أقوى.

تعمل مجموعتي الألكيل من أيزومر رابطة الدول المستقلة مع تأثيرهما + I في نفس الاتجاه وبالتالي يعززان ، بينما تعمل مجموعتي الألكيل من الأيزومرات العابرة في اتجاهين متعاكسين وبالتالي تضعف بعضهما البعض. يشار إلى صيغ الهيدروكربونات التي تحتوي على أيزومرات هندسية وفقًا لمعايير IUPAC. لكن - 1 - إن لديه نقطة انصهار منخفضة ، لأن CC عبارة عن رابطة واحدة بين الدوران الحر لذرات الكربون الثانية والثالثة ويمكن لمجموعة الإيثيل الدوران حول محور الدوران في جميع الاتجاهات.
هذا يجعل من الصعب تصنيف الجزيء إلى بنية بلورية صلبة. البيوتين الثلاثة الأخرى ذات الرابطة المزدوجة بين ذرات 2 و 3 rd C صلبة للغاية ويمكن تصنيفها بسهولة إلى هياكل بلورية. لذلك ، لديهم نقاط انصهار عالية نسبيًا. لا تكون هذه الحجج صالحة دائمًا ، حيث يوضح المثال 2-Methyl-but-2-en (أو isobutene). تعمل مجموعتي الميثيل ، بتأثيراتهما + I ، في نفس اتجاه cis-But-2-en ، وفي الواقع يجب تحسينهما. ومع ذلك ، يحتوي الإيزوبيوتين على درجة غليان منخفضة جدًا تبلغ -7 درجة مئوية فقط.
يتم استخدام But-1-en و But-2-ene لإنتاج بوتادين وبيوتان -2-ol. بالإضافة إلى ذلك ، يتم استخدام الألكينات كعوامل مؤلكلة. وبالتالي ، يتم الحصول على الوقود المهم 2،2،4-Trimethyl-pentan ، المعروف باسم isooctane ، من الأيزوبيوتين والأيزوبيوتان. أخيرًا ، تعتبر البيوتين مادة البداية لبعض أنواع البلاستيك لأنها سهلة البلمرة. البلاستيك المشهور القائم على But-1-en هو polybutene-1 ، الذي تصنع منه الأنابيب.
بنتان ، ن-بنتان ، أيزوبنتان
البنتان ، أو n-pentane ، هو أحد الهيدروكربونات المشبعة للألكانات. تقريبا عديم الرائحة ، n-pentane سائل في الظروف المحيطة وهو 3-isomer isomer of herakechite. تستخدم الأيزو ألكانات السائلة المتفرعة C5 - C16 بشكل متزايد كوقود (أوتو ، ديزل). بالإضافة إلى ذلك ، توجد هذه الألكانات في زيوت التدفئة وزيوت التشحيم. أنها تضمن الاحتراق الكامل. قبل معرفة خصائص هذه المركبات ، من الضروري الإشارة إلى صيغ الهيدروكربونات التي تحتوي على أيزومرات هندسية:
- الحالة الفيزيائية سائلة.
- اللون عديم اللون.
- الرائحة - لا شيء تقريبًا.
- سهل الاشتعال.
- يمكن أن تشكل الأبخرة مخاليط متفجرة عند تعرضها للهواء.
- الذوبان في الماء منخفض جدا (غير قابل للذوبان عمليا).
- اتصال غير مستقر للغاية.
أهم مصادر البنتان هي زيوت البترول ، والتي تختلف اختلافًا كبيرًا في تركيبها حسب مصدرها. يتم الفصل عن طريق التقطير التجزيئي. يتم الحصول على الفصائل التالية هنا:
- زيت البارافين (نقطة الغليان\u003e 320 درجة مئوية).
- الزيت (درجة الغليان 180 إلى 250 درجة مئوية).
- تدفئة / ديزل (درجة الغليان 250 إلى 320 درجة مئوية).
- البنزين الخام (تصل درجة الغليان إلى 180 درجة مئوية تقريبًا).
- توجد الهيدروكربونات المتفرعة (الألكانات) من C5 إلى C10 في النفتا.
- احتراق البنتان بالأكسجين (القياس المتكافئ).
- المنتجات النهائية هي ثاني أكسيد الكربون والماء. صيغ الأيزومرات الهندسية: C5H12 + 8O2 ⟹ 5CO2 + 6H2O.
| القيمة الحرارية HU | القيمة الحرارية HU [kWh / kg] |
||
الأيزومر الهندسي للبنتن -2 مذيب متعدد الاستخدامات. يتم استخدامه لرغوة راتينج الفينول والبوليسترين. كما أنه مطلوب أيضًا كمواد مرجعية في كروماتوغرافيا الغاز وكمادة دافعة في علب الرش.


 برمجة العقل الباطن بـ "الفيروس"!
برمجة العقل الباطن بـ "الفيروس"! القراءة السريعة وتنمية الذكاء
القراءة السريعة وتنمية الذكاء كيف تحفظ المعلومات بشكل أسرع؟
كيف تحفظ المعلومات بشكل أسرع؟