Нарушение гемостаза. Истощение факторов свертывания крови. в) тяжелое повреждение печени

ПАТОФИЗИОЛОГИЯ СИСТЕМЫ ГЕМОСТАЗА
Значение системы гемостаза
1. Сохранение крови в жидком состоянии (адекватное соотношение активности свертывающей и противосвертывающей систем)
2. Предупреждение и остановка кровотечения (поддержание постоянного объема циркулирующей крови)

ВИДЫ ГЕМОСТАЗА
СОСУДИСТО-ТРОМБОЦИТАРНЫЙ
(ПЕРВИЧНЫЙ)
- ОСТАНОВКА КРОВОТЕЧЕНИЯ В МИКРОСОСУДАХ
КОАГУЛЯЦИОННЫЙ
(ВТОРИЧНЫЙ)
ФОРМИРОВАНИЕ ФИБРИНОВЫХ СГУСТКОВ

КОМПОНЕНТЫ СИСТЕМЫ ГЕМОСТАЗА
* СОСУДИСТАЯ СТЕНКА
* ТРОМБОЦИТЫ (моноциты, эритроциты)
* ПЛАЗМЕННЫЕ СИСТЕМЫ :
- ПРОКОАГУЛЯНТЫ
- АНТИКОАГУЛЯНТЫ
- ФИБРИНОЛИТИЧЕСКАЯ
- КАЛЛИКРЕИН-КИНИНОВАЯ

КЛАССИФИКАЦИЯ НАРУШЕНИЙ ГЕМОСТАЗА
ЗА ЭТИОЛОГИЕЙ
- НАСЛЕДСТВЕННЫЕ
- ПРИОБРЕТЕННЫЕ
ЗА МЕХАНИЗМОМ РАЗВИТИЯ
- НАРУШЕНИЯ СОСУДИСТО-ТРОМБОЦИТАРНОГО
ГЕМОСТАЗА
- НАРУШЕНИЯ КОАГУЛЯЦИОННОГО ГЕМОСТАЗА
ЗА НАПРАВЛЕННОСТЬЮ ИЗМЕНЕНИЙ
- ГИПОКОАГУЛЯЦИЯ
- ГИПЕРКОАГУЛЯЦИЯ

ГИПОКОАГУЛЯЦИЯ
Снижение способности крови сворачиваться с появлением склонности к повторным кровотечениям и кровоизлия-ниям (спонтанным или после незначительных травм)

ЭТИОЛОГИЯ
1. ТРОМБОЦИТОПЕНИЯ
2. ТРОМБОЦИТОПАТИЯ
3. ВАЗОПАТИЯ
4. КОАГУЛОПАТИЯ

ТРОМБОЦИТОПЕНИЯ
Патологическое состояние которое характеризуется понижением содержания тромбоцитов в крови (меньше 150·109 /л)

НАСЛЕДСТВЕННАЯ ТРОМБОЦИТОПЕНИЯ
Как правило, одновремен-но сопровождается врож-деннными дефектами тромбоцитов

ПРИОБРЕТЕННАЯ ТРОМБОЦИТОПЕНИЯ (КЛАССИФИКАЦИЯ ЗА МЕХАНИЗМОМ РАЗВИТИЯ)
ПОВРЕЖДЕНИЕ ТРОМБОЦИТОВ
- имунными комплексами
- механическая травматизация (спленомегалия, гемангиома)
УГНЕТЕНИЕ ОБРАЗОВАНИЯ ТРОМБОЦИТОВ
(апластическая анемия, химическое и радиационное повреждение красного костного мозга, замещение кроветворной ткани опухолью)
ПОВЫШЕННОЕ ИСПОЛЬЗОВАНИЕ ТРОМБОЦИТОВ
(тромбоз, ДВС-синдром)

ИММУННАЯ ТРОМБОЦИТОПЕНИЯ
ГЕТЕРОИММУННАЯ
* Возникает чаще у детей
** Причина – изменение антигенной структуры тромбоцитов (при оседании вирусов краснухи, оспы, аденовирусов; гаптенов медикаментозного происхождения – хинидин, сульфаниламиды, рифампицин; вакцины)
***Течение благоприятное (при устранении причины наступает полное выздоровление)

ИММУННАЯ ТРОМБОЦИТОПЕНИЯ
АУТОИММУННАЯ
Возникает чаще у взрослых
Причина – отсутствие иммунной толерант-ности к антигенам собственных тромбоцитов
Провоцирующие факторы: лекарства, вирусы, бактерии

Аутоиммунная тромбоцитопения
БОЛЕЗНЬ ВЕРЛЬГОФА
(аутоиммунная хроническая тромбоцитопеническая пурпура)
* На поверхности тромбоцитов количество Ig G увеличивается в 10 раз
* Основным местом синтеза Ig G является селезенка
* Принцип лечения :
- спленэктомия
- кортикостероиды
- иммунодепресанты
* Полного излечения не бывает

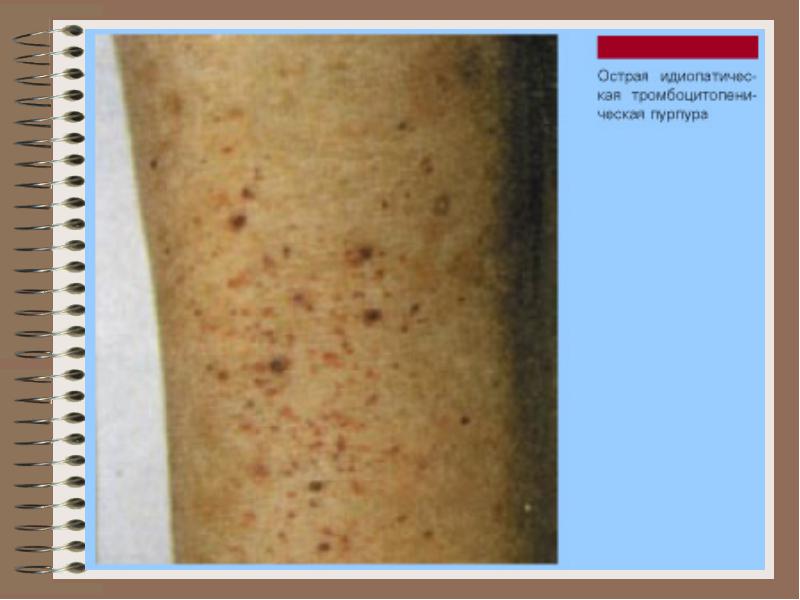
ТРОМБОЦИТОПАТИЯ
Нарушенние гемостаза вследствие качественной неполноценности или дисфункции тромбоцитов, которое характеризуется нарушением сосудисто-тромбоцитарного гемостаза, появлением кровоточи-вости тканей и органов

БЕЗ НАРУШЕНИЯ РЕАКЦИИ ОСВОБОЖДЕНИЯ ГРАНУЛ
Тромбастения Гланцмана
*Наследование - аутосомно-рецессивное
*Причина - отсутствие гликопротеидов 2в и 3а в оболочке тромбоцитов
*Патогенез - тромбоциты не взаимодей-ствуют с фибриногеном и не агрегируют
*Признаки: петехии, носовые кровотече-ния, маточные кровотечения (могут быть смертельными!! )

Наследственная тромбоцитопатия
С НАРУШЕНИЕМ РЕАКЦИИ ОСВОБОЖДЕНИЯ ГРАНУЛ
Наследование - аутосомно-рецессивное
Причина – нарушение активности циклоксигена-зы, низкая активность контрактильных белков
Патогенез – отсутствие агрегации при взаимодействии с коллагеном, отсутствие освобождения гранул
Признаки:

Наследственная тромбоцитопатия
С НАРУШЕНИЕМ НАГРОМОЖДЕНИЯ И ОСВОБОЖДЕНИЯ СОДЕРЖИМОГО ГРАНУЛ
Болезнь Херджманского-Пудлака (АР)
* Причина – нарушение накопления плотных гранул (АДФ, адреналин, серотонин, Са2+)
* Патогенез – отсутствует агрегация при взаимодей-ствии с коллагеном, отсутствует освобождение содержимого гранул
* Признаки: петехии, носовые кровотечения, маточные кровотечения

Наследственная тромбоцитопатия
С НАРУШЕНИЕМ АДГЕЗИИ И АГРЕГАЦИИ ТРОМБОЦИТОВ
Синдром Виллебранда-Юргенса (АР)
Причина – дефицит фактора Виллебранда
Патогенез – нарушена адгезия тромбоцитов вследствие дефицита фактора 8
Болезнь Бернара Сульє (АР)
Причина – отсутствие гликопротеида 1 на тромбоцитах
Патогенез – нарушено взаимодействие тромбоцитов с фактором Виллебранда, ф. 5, ф. 11
Признаки – капиллярные кровотечения (особенно опасны при половом созревании или родах)

Наследственная тромбоцитопатия
ДЕФИЦИТ И СНИЖЕННАЯ ДОСТУПНОСТЬ ф.3
Тромбоцитопатия Боуе и Овена
Причина - дефицит ф.3 тромбоцитов
Патогенез – отсутствует взвємодействие тромбоцитов и прокоагулянтов
Признаки: петехии, носовые кровотечения, маточные кровотечения

Наследственная тромбоцитопатия
Тромбоцитопатии в сочетании сдругими наследственными аномалиями
Синдром Вискотта-Олдриджа
- Причина – в тромбоцитах мало плотных гранул (АДФ, серотонин, адреналин, Са2+), альфа-гранул (бета-тромбоглобулин, фибриноген, фибронектин, ростовой фактор)
- Патогенез –сниженная адгезия и агрегация тромбо-цитов, нарушено освобождение гранул
- Признаки: геморрагический синдром появляєтся рано, могут быть смертельные кровотечения

Приобретенная тромбоцитопатия (Этиология)
1. Лейкозы - мало гранул в тромбоцитах вследствие ускоренного созревания, снижена адгезия и агрегация
2. Нагромождение Ig М – повреждение рецепторов иммунными комплексами, нарушение взаимодействия тромбоцитов с прокоагулянтами (иммунные болезни)
3. Гиповитаминоз В12 – нарушено освобождение гранул
4. Медикаментозные влияния

Медикаментозная тромбоцитопатия
* Ингибиторы синтеза тромбоксана А2
-стероидные противовоспалительные препараты
- нестероидные противовоспалительные препараты (аспирин блокирует агрегацию тромбоцитов на 4-6 дней)
* Стимуляторы образования цАМФ
-папаверин
-эуфиллин
-анаболические стероиды
* Антагонисты ионов Са
-верапамил
-коринфар

ВАЗОПАТИЯ
Геморрагический диатез обусловленный функциональной и морфологической неполноцен-ностью сосудистой стенки
- врожденная
- приобретенная

ВРОДЖЕННАЯ ВАЗОПАТИЯ
Бол. Рандю-Ослера (геморрагическая телеангиоэктазия)
Бол. Фабри (диффузная ангиокера-тома туловища)
Наследственный тромбоцитопени-ческий микроангиоматоз

ВРОДЖЕННАЯ ВАЗОПАТИЯ
Причина – наследственное нарушение развития соединительной ткани, в т.ч. субэндотелия сосудов
Характеристика
- очаговое истончение сосудов
- расширение просвета микрососудов
- мало коллагеновых волокон в субэндотелии
- сосуды легко травмируються
- слабкая адгезия и агрегация тромбоцитов вследствие дефицита коллагеновых волокон
**Признаки – кровотечения носовые, легочно-бронхиальние и желудочно-кишечные (бывают смертельные)

ПРИОБРЕТЕННАЯ ВАЗОПАТИЯ
1. Идиопатическая (саркома Капоши)
- этиология – неизвестна
2. Застойная (дерматит Клотца, дерматит Фавра-Ракушо)
- этиология – хр.сердечная недостаточность, локальная венозная недостаточность
3. Дистрофическая
Стероидная пурпура - гиперфункция надпочечников, лечение кортикостероидами – угнетают синтез коллагена
Скорбут – дефицит вит.С
Бол.Шенляйн-Геноха – повреждение сосудов иммунными комплексами
4. Неврогенная
Клинические признаки – кожные формы кровоточивости

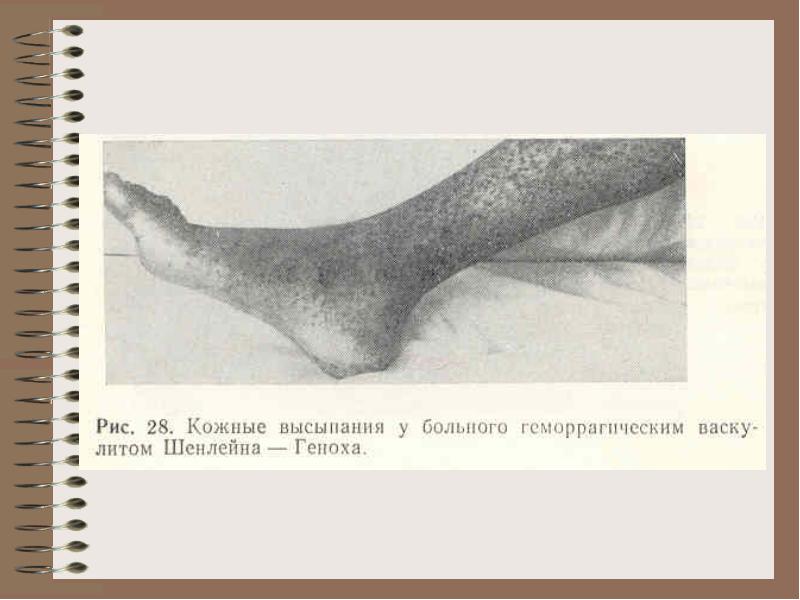
КОАГУЛОПАТИЯ
Геморрагический диатез, который возникает в результате патологии коагуляционной системы гемостаза
** наследственная
** приобретенная

НАСЛЕДСТВЕННАЯ КОАГУЛОПАТИЯ
Генетически обусловленное нарушение свертывания крови вследствие дефицита или молекулярной аномалии веществ, отвечающих за коагуляционный гемостаз

НАСЛЕДСТВЕННАЯ КОАГУЛОПАТИЯ
КЛАССИФИКАЦИЯ
1. Коагулопатия вследствие изолированного нарушения внутреннего механизма формирования протромбиназной активности (гемофилии А, В, С, б.Виллебранда, дефицит Хагемана)
2. Коагулопатия вследствие изолированного нарушения внешнего механизма формирования протромбиназной активности (гипопроконвертинемия – дефицит 7 ф.)
3. Комбинированное нарушение внешнего и внутреннего механизма формирования протромбиназной активности (парагемофилия – дефицит 5 ф., б.Стюарта-Прауэра – дефи-цит 10 ф.)
4. Нарушение конечной стадии свертывания крови (афибриногенемия)

СТАТИСТИКА
Среди всех форм коагулопатий страдают:
Гемофилией А 68 – 78%
Б. Виллебранда 9 – 18 %
Гемофилией В 6 – 13 %
Гемофилией С, парагемофилией и гипопроконвертинемией 1 – 2 %
Остальные формы – клиническая казуистика

Гемофилия А
Геморрагический диатез, обусловленный наслед-ственным дефицитом прокоагулянтной части фактора 8
Фактор 8 (высокомолекулярный белок)
1. Гликопротеин прокоагулянт (VIII:К)
2. Гликопротеин, осуществляющий адгезию тромбоцитов (VIII:ФВ)
3. Гликопротеин, активирующий адгезию тромбоцитов под влиянием ристомицина (VIII:Ркоф)
4. Антигенный маркер VIII:К (VIII:К АГ)
5. Антигенный маркер VIII: Ркоф (VIII: Ркоф АГ)
Активность VIII:К и VIII:ФВ снижается при уменьшении мультимерной структурыи всего 8 фактора

Гемофилия А
* Этиология – аномалия гена в Х-хромосоме, который контролирует синтез прокоагулянтной части ф. 8 (VIII:К)
** Болеют – мужчины (46, XhY)
** Виды
- Гемофилия А+ (антигенположительная форма – синтезируется аномальный VIII:К ), страдают 8 –10 %
- Гемофилия А- (антигенотрицательная форма – не синтезируется VIII:К ), страдают 90 –92 %
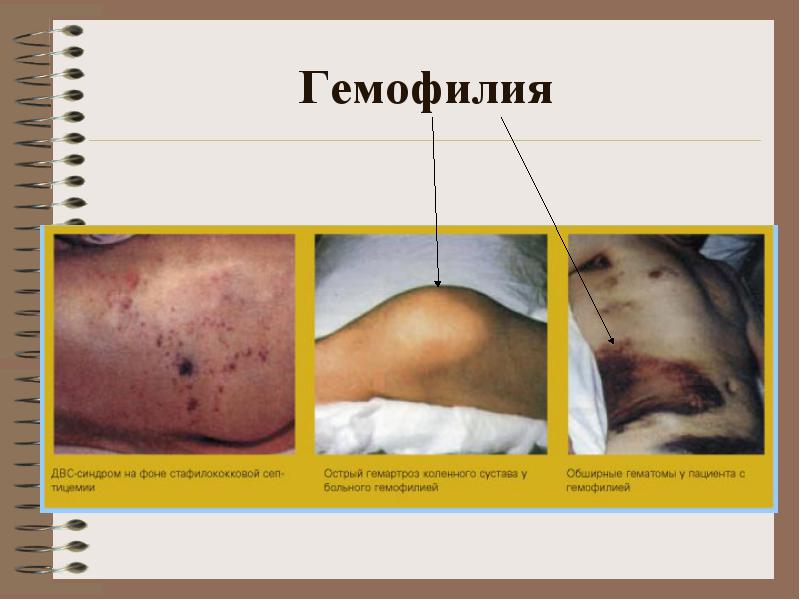
**** Клиника: кровоизлияния в большие суставы, гематомы (подкожные, внутримышечные), сильные и длительные посттравматические кровотечения. Возможны кровоизлия-ния в органы брюшной полости, желудочно-кишечные кровотечения

Гемофилия
Гемофилия
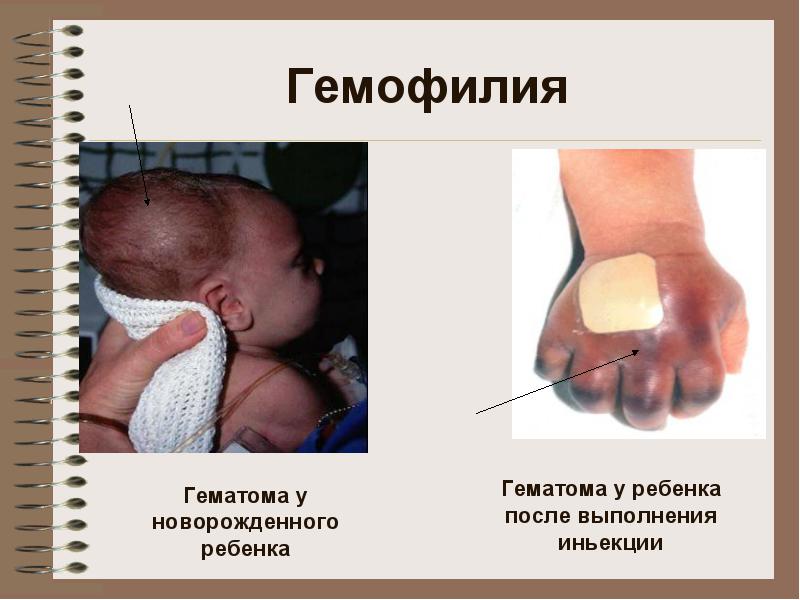
Гемофилия В
Этиология – аномалия гена в Х-хромосоме, который контролирует синтез ф. 9
Болеют – мужчины (46, XhY)
- женщины (46, XhXh), (45, Xh O)
*** Виды
- Гемофилия В+ (антигенположительная форма – синтезируется аномальный ф. 9 )
- Гемофилия В- (антигенотрицательная форма – не синтезируется ф. 9 )
Клиника: кровоизлияния в большие суставы, гематомы (подкожные, внутримышечные), сильные и длительные посттравматические кровотечения. Возможны кровоизлия-ния в органы брюшной полости, желудочно-кишечные кровотечения

ПРИОБРЕТЕННАЯ КОАГУЛОПАТИЯ
Особенность – полидефицитная
Етиология
1. Иммунная ингибиция прокоагулянтов (резус конфликт)
2. Дефицит вит. К–зависимых факторов коагуляции (7, 10, 9, 2)
а) нарушение синтеза в кишечнике (дисбактериоз, понос)
б) нарушение всасывания вит. К (дефицит желчи)
в) тяжелое повреждение печени
3. Передозировка гепарина

ГИПЕРКОАГУЛЯЦИЯ
ПОВЫШЕННАЯ СПОСОБНОСТЬ КРОВИ ОБРАЗОВЫВАТЬ СГУСТКИ В СОСУДАХ
ТРОМБОЗ
ДВС-СИНДРОМ

ДВС-СИНДРОМ (СИНДРОМ ДЕСИМИНОРОВАННОГО ВНУТРИСОСУДИСТОГО СВЕРТЫВАНИЯ КРОВИ)
КЛАССИФИКАЦИЯ
* По клиническому течению
1) острый (мгновенные формы характеризуются тяжелым течением)
2) хронический
* По распространенности
1) локализированный
2) генерализированный

ЭТИОЛОГИЯ
Инфекции, септические состояния
Шок (при септическом – смертность 100 %)
Хирургические вмешательства, ожеги
Все терминальные состояния, остановка сердца
Острый внутрисосудистый гемолиз
Акушерская патология (20-25 %)
Гемобластозы (при о. лейкозе – 33-45 %)
Деструктивные процессы в паренхиматозных органах
Аллергические реакции

Стадии ДВС-синдрома
1) Гиперкоагуляция (образование множественных тромбов вследствие активации системы коагуляции)
2) Коагулопатия потребления (истощение системы каогулянтов, чрезмерное использование тромбо-цитов для образования тромбов)
3) Гипокоагуляция (понижение активности коагу-лянтов, активация антикоагулянтов, активация фибринолиза)
4) Завершение (выздоровление, осложнения, смерть)

Патогенез ДВС-синдрома
1) Гипертромбинемия (тромбопластин поступает в кровь в большом количестве из поврежденных тканей и способ-ствует образованию тромбина). При инфекциях активированные моноциты-макрофаги синтези-руют собственные коагулянти (ф.7, ф.10, ф.9, ф.2)

Патогенез ДВС-синдрома
2) Массивная агрегация тромбоцитов (вызывает развитие тромбоцитопе-нии потребления и осложняется геморрагиями)
3) Травматизация и гемолиз эритро-цитов (при этом выделяется много АДФ, что усиливает адгезию и агрегацию тромбоцитов)

Патогенез ДВС-синдрома
4) “Гуморальный протеазный взрыв” (при активации прокоагулянтов, ан-тикоагулянтов, фибринолитиков, белков калликреин-кининовой си-стемы, системы комплемента в крови накапливается много продуктов бел-кового распада, которые являются очень токсическими и повреждают сосуды и ткани)

Патогенез ДВС-синдрома
5) Истощение системы фибрино-лиза
(способствует тромбообразованию)
6) Истощение факторов свертывания крови
(вызывают развитие геморрагий)

Клиника ДВС-синдрома
1. Гемокоагуляционный шок
причина
* нарушения микроциркуляции (вызывают развитие гипоксии тканей)
* накопление токсических продуктов протеолиза
проявления
* понижение артериального давления
* понижение центрального венозного давления
* кровотечения (провоцируют геморрагический шок)

Клиника ДВС-синдрома
2. Нарушения гемостаза
а) гиперкоагуляция
Главное проявление – тромбоз
Кровь сворачивается в пробирке
б) гипокоагуляция
Главное проявление – кровотечения
(одновременно истощается система фибринолиза)

Клиника ДВС-синдрома
3. Тромбоцитопения
Возникает вследствие образова-ния большого количества тромбов в сосудах (тромбоцитопения потребления)

К данной группе относят генетически детерминированные гипокоагуляции, характеризующиеся дефицитом, а также молекулярными аномалиями факторов свертывания крови.
Так, 83-90% всех наследственных нарушений свертываемости крови представляют 2 разновидности дефицита фактора VTII гемофилию А (70-78%) и болезнь Виллебранда (9-18%); еще 6-13% связаны с дефицитом фактора IX (гемофилия В). Таким образом, на дефицит только двух факторов свертывания - VIII и IX - приходится около 96-98% всех наследственных коагулопатий. Дефицит факторов VII и V регистрируется в 0,5-1,5%, фактора X - в 0,3-0,5% случаев.
Не все нарушения в свертывающей системе крови сопровождаются кровоточивостью: она может отсутствовать или быть слабо выраженной.
Гемофилия А . Данное заболевание представляет собой наиболее распространенную коагулопатию, в основе которой лежит дефицит фактора VIII (антигемофильного глобулина), и является единственной среди них формой с рецессивным, сцепленным с X-хромосомой наследованием.
Разнообразие форм патологии фактора VIII отражает сложность его структуры. В крови фактор VIII циркулирует в виде протеинового комплекса, состоящего из ряда однотипных субъединиц.
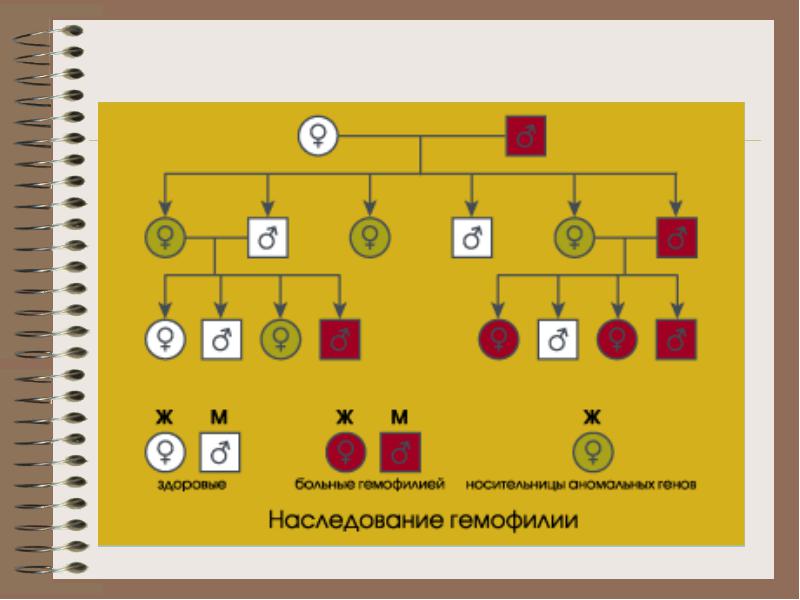
Наследование . Ген гемофилии, располагающийся в Х-хромосоме, от больного мужчины наследуется всеми его дочерьми, которые в дальнейшем неизбежно являются носителями заболевания, при этом сыновья больного остаются здоровыми (в связи с тем, что получают Х-хромосому от здоровой матери).
Также следует отметить, что у женщины - носителя гемофилии имеется возможность в 50% случаев родить здорового сына, а половина дочерей становятся носителями гена гемофилии.
Женщины-носители, как правило, кровоточивостью не страдают, поскольку вторая нормальная Х-хромосома обеспечивает синтез фактора VIII, чего в большинстве случаев достаточно для обеспечения гемостаза.
Однако норма фактора VIII варьирует в очень больших пределах (60-250%). В связи с этим у некоторых передатчиц уровень фактора VIII в плазме может составлять 11-20%, что создает угрозу кровотечений при травмах, операциях и в родах. Об этой опасности врачу следует помнить при хирургических вмешательствах у матерей, сестер и особенно дочерей больных гемофилией. Перед операцией и перед родами у них следует проверять уровень фактора VIII в плазме и при показателях ниже 25% профилактически вводить криопреципитат по 7-10 ЕД/кг в сутки.
Выявлению носительства гена гемофилии способствует детальное изучение семейного геморрагического анамнеза у всех кровных родственников больного по материнской линии.
Наследственный генез устанавливается при гемофилии А в 70-75% случаев, а при гемофилии В - в 90-91%. Ген гемофилии А, несомненно, часто мутирует, поскольку число больных за много веков не уменьшилось, хотя до недавнего времени значительная часть их умирала до достижения детородного возраста, что вело к естественной убыли аномальных Х-хромосом.
Симптомы Нарушений коагуляционного гемостаза
Степень выраженности кровотечений зависит от дефицита фактора VIII в плазме, содержание которого в различных гемофилических семьях генетически запрограммировано.
Уровень факторов, обладающих четким антигемофильным действием (VIII или IX), составляющий от 0 до 1%, обусловливает крайне тяжелое течение рассматриваемой патологии, уровень факторов от 1 до 2% обусловливает тяжелое, от 2 до 5% -среднетяжелое, а свыше 5% - легкое течение заболевания. В последнем случае существует вероятность развития кровотечений, представляющих серьезную опасность для жизни больного, что имеет особое значение при проведении у него различных оперативных вмешательств либо в случае травмирования.
В клинической картине гемофилии преобладают кровоизлияния в крупные суставы конечностей, глубокие подкожные, межмышечные и внутримышечные гематомы, обильные и длительные кровотечения при травмах, гематурия (появление крови в моче). Реже наблюдаются другие кровотечения, в том числе и такие тяжелые и опасные, как забрюшинные гематомы, кровоизлияния в органы брюшной полости, желудочно-кишечные кровотечения внутричерепные кровоизлияния.
Прослеживается отчетливая возрастная эволюция проявлений болезни. При рождении могут наблюдаться более или менее обширные кефалогематомы (кровоизлияние под надкостницу костей черепа), подкожные и внутрикожные кровоизлияния, поздние кровотечения из пупочного канатика. Иногда болезнь выявляется при первой внутримышечной инъекции, которая может стать причиной большой, опасной для жизни межмышечной гематомы. Прорезывание зубов часто сопровождается не очень обильными кровотечениями.
В первые годы жизни часто бывают кровотечения из слизистой оболочки полости рта, связанные с травмой различными острыми предметами. Когда ребенок учится ходить, падения и ушибы часто сопровождаются обильными носовыми кровотечениями и гематомами на голове, кровоизлияниями в глазницу, а также заглазничными гематомами, которые могут привести к потере зрения. У ребенка начавшего ползать, типичны кровоизлияния в области ягодиц.
Затем на первый план выступают кровоизлияния в крупные суставы конечностей. Острые кровоизлияния в суставы появляются тем раньше, чем тяжелее гемофилия. Первые кровоизлияния предрасполагают к повторным в те же суставы. У каждого больного с особым упорством и частотой поражаются кровоизлияниями I - III сустава. Это связано с морфологической перестройкой и вторичными воспалительными изменениями тканей сустава.
Установлено, что синовиальная оболочка является главным, а возможно, и единственным источником кровоизлияния в сустав, поскольку после полной синовэктомии (удаления синовиальной оболочки) такие кровоизлияния п-екращаются и не повторяются. Наиболее часто поражаются коленные суставы, за ними голеностопные и локтевые, а затем со значительным перепадом - тазобедренные. Сравнительно редко наблюдаются кровоизлияния в мелкие суставы кистей и стоп (менее 1% всех поражений) и межпозвонковые суставы. У каждого больного в зависимости от возраста и тяжести заболевания поражаются от I - II до VIII - XII суставов.
Клинически важно различать острые кровоизлияния в суставы (первичные и повторяющиеся), хронические геморрагически-деструктивные остеоартрозы (артропатии), вторичный иммунный ревматоидный синдром как осложнение основного процесса.
Острый гемартроз - внезапное появление (часто после небольшой травмы) или резкое усиление боли в суставе. Кожа в области сустава красная и горячая на ощупь. Боль быстро (в течение нескольких часов) ослабляется после первого же переливания криопреципитата или антигемофильной плазмы и почти немедленно проходит при одновременном удалении крови из сустава. Если болевой синдром при таком лечении не ликвидируется, то следует искать дополнительную патологию - внутрисуставной перелом, отрыв мыщелка, ущемление ткани.
Остеоартрозы разделяются по стадиям на основе клинико-рентгенологических данных. В классификации выделяются 4 стадии поражения суставов.
В I, или ранней, стадии может быть увеличен объем сустава (с расширением суставной щели) в результате кровоизлияния. В «холодном» периоде функция сустава не нарушена, но рентгенологически может обнаруживаться утолщение и уплотнение суставной капсулы вследствие инфильтрации ее гемосидерином.
Во II стадии выявляются типичные изменения в подхрящевом отделе эпифизов -краевые узоры, образование одиночных овальных мелких ячеистых деструкции и кист. Более выражен остеопороз, суставная щель сохранена, но может быть умеренно суженной.
В III стадии сустав резко увеличен, деформирован, имеет неровную и бугристую структуру, определяется выраженная гипотрофия мускулатуры. Подвижность пораженных суставов более или менее ограничена, что связано как с поражением самого сустава, так и с изменениями мышц и сухожилий. Рентгенологически суставы утолщены, резко деформированы, суставные поверхности уплощены, эпифизы расширены за счет разрастания костной ткани, диафизы уменьшены, суставная щель сужена. Выражен остеопороз, легко возникают внутрисуставные переломы. В бедренной кости отмечается типичное для гемофилии кратеро- или туннелеподобное разрушение костного вещества в области межмыщелковой ямки. Надколенник частично разрушается. Внутрисуставные хрящи разрушены, в полости сустава обнаруживаются подвижные, нередко замурованные в старые организовавшиеся сгустки крови осколки этих хрящей. Возможны различного рода подвывихи и смещения костей.
В IV стадии функция сустава почти полностью утрачивается, суставная щель сужена, плохо визуализируется на рентгенограмме и часто заращена соединительной тканью. Выражен склероз околохрящевых отделов кости, сочетающийся с образованием щелей и формированием кист в области эпифизов. Возможны патологические внутрисуставные переломы. Костные анкилозы исключительно редки и, по сути дела, никогда не наблюдаются, если только в прошлом не проводилось неправильное лечение (с длительной иммобилизацией конечности).
С возрастом тяжесть и распространенность суставного поражения неуклонно прогрессируют и усугубляются возникновением околосуставных гематом.
Вторичный ревматоидный синдром (синдром Баркагана - Егоровой), впервые описанный авторами в 1969 г., является частой формой поражения суставов у больных гемофилией. Во многих случаях он просматривается, поскольку наслаивается на предшествующие кровоизлияния в суставы и свойственные гемофилии деструктивные процессы в суставах. Внимательное обследование больных позволяет легко диагностировать вторичный ревматоидный синдром, что имеет существенное значение для дальнейшего правильного лечения. Этот синдром сопровождается хроническим воспалительным процессом (часто симметричным) в мелких суставах кистей и стоп, не поражавшихся ранее кровоизлияниями, с последующей их типичной деформацией, болью в крупных суставах, не купирующейся, а нередко и обостряющейся после переливаний плазмы и введений криопреципитата. Также данный синдром протекает с выраженной утренней скованностью в суставах, неуклонным прогрессированием суставного процесса вне связи со свежими кровоизлияниями, появлением или резким усилением лабораторных признаков воспалительного процесса, в том числе и иммунологических, - с повышением уровня глобулинов в сыворотке крови, сиаловых кислот, фибриногена, нарастанием концентрации циркулирующих иммунных комплексов и в ряде случаев - титра ревматоидного фактора. У большинства больных синдром появляется в возрасте старше 10-14 лет, к 20 годам его частота доходит до 5,9%, а к 30 - до 13%.
С возрастом распространенность и тяжесть всех поражений суставов неуклонно прогрессируют, что приводит к инвалидности, заставляет больных пользоваться костылями, колясками и другими приспособлениями.
Прогрессирование поражения суставов зависит от частоты острых кровоизлияний в суставы, своевременности и полноценности их лечения (очень важно раннее переливание кровезаменителей), качества ортопедической помощи больному, правильного применения лечебной физкультуры, физиотерапевтических и бальнеологических воздействий, выбора профессии и ряда других обстоятельств. В настоящее время все эти вопросы чрезвычайно актуальны, поскольку продолжительность жизни больных гемофилией благодаря успехам коррекционной терапии резко возросла.
Довольно тяжело протекают и представляют опасность для больного следующие виды обширных и напряженных гематом: подкожные, межмышечные, субфасциальные и забрюшинные. Постепенно увеличиваясь, они могут достигать огромных размеров, содержать 0,5-3 л крови и более, приводить к развитию анемии у больных, вызывать компрессию (сдавление) и деструкцию (разрушение) окружающих тканей и питающих их сосудов, некроз. Так, например, забрюшинные гематомы нередко полностью разрушают большие участки тазовых костей (диаметр зоны деструкции - до 15 см и более), гематомы на ногах и руках разрушают трубчатые кости, пяточную кость. Гибель костной ткани обусловливают также кровоизлияния под надкостницу. Эти деструкции костей на рентгенограммах имеют сходство с опухолевыми разрушениями (например, при остеосаркомах). Нередко гематомы кальцинируются, а иногда приводят к образованию новых костей (остеонеогенез). Они могут замыкать суставы и полностью их обездвиживать.
Многие гематомы, оказывая давление на нервные стволы или мышцы, вызывают параличи, нарушения подвижности, чувствительности, быстро прогрессирующую атрофию мышц. Для кровоизлияний в область подвздошно-поясничной мышцы особенно характерны сгибательные движения бедра. Особое внимание уделяется тем гематомам, которые способны вызывать развитие стеноза верхних дыхательных путей. К таким гематомам относятся гематомы мягких тканей подчелюстной области, гематомы области шеи, зева и глотки.
У 14-30% всех больных с гемофилией развиваются обильные и длительные почечные кровотечения, которые создают серьезную угрозу жизни больного и с трудом поддаются лечению. Такие кровотечения могут возникать как спонтанно, так и в связи с травмами поясничной области, сопутствующими пиелонефритами, и, возможно, вследствие повышенного выделения кальция с мочой из-за деструкции костной ткани у больных гемофилией. Появлению или усилению таких кровотечений могут способствовать прием анальгетиков (ацетилсалициловая кислота и др.), обильные переливания крови и плазмы, приводящие к развитию вторичной тромбоцитопатии за счет дополнительного отрицательного воздействия на почки. Почечным кровотечениям часто предшествует длительная микрогематурия (малое количество эритроцитов в моче), которая регистрируется и в промежутках между эпизодами макрогематурии (большое количество эритроцитов в моче, заметное на глаз).
Появление крови в моче часто сопровождается выраженными дизурическими явлениями, приступами почечной колики, обусловленными образованием сгустков крови в мочевыводящих путях. Особенно интенсивны и выражены эти явления при лечении больных, когда временно восстанавливается нормальный гемостаз. Прекращению гематурии часто предшествует почечная колика, а нередко - и временное отсутствие мочи с азотемией.
Почечные кровотечения склонны к возобновлению, что с годами может привести к тяжелым дистрофически-деструктивным изменениям в этом органе, вторичной инфекции и амилоидозу, смерти от уремии (попадания продуктов обмена веществ, в норме выводимых с мочой, в кровь).
Обильные кровотечения из желудочно-кишечного тракта у больных гемофилией могут возникать спонтанно, хотя в большинстве случаев они провоцируются приемом ацетилсалициловой кислоты, бутадиона и других препаратов. Вторым источником кровотечений служат клинически выраженные или «скрытые» язвы желудка или двенадцатиперстной кишки, а также эрозивные гастриты различного происхождения. Вместе с тем иногда наблюдаются диффузные капиллярные кровотечения без каких-либо деструктивных изменений слизистой оболочки. Эти диапедезные кровотечения, при которых стенка кишечника на большом протяжении пропитывается кровью, быстро приводят к анемической коме, острой сосудистой недостаточности и летальному исходу.
Кровоизлияния в брыжейку, а также в большой и малый сальник зачастую создают ложное впечатление о развитии у больного острой хирургической патологии органов брюшной полости, такой как острый аппендицит, кишечная непроходимость, что особенно выражено в случае кровоизлияния под серозную оболочку в стенке кишки. Единственным ориентиром в подобных ситуациях может быть быстрая эффективность интенсивной заместительной терапии. Мгновенное начало такой терапии рекомендуется в любом случае - как для устранения кровотечений, так и в порядке подготовки больного к операции. Далее все решает результат лечения. Если вслед за струйным введением концентрата фактора VIII (или IX) болевой синдром и другие признаки острого живота быстро стихают, то можно продолжить наблюдение за больным при продолжающейся интенсивной заместительной терапии (неосложненное внутреннее кровоизлияние). Если эффект заместительной терапии выражен недостаточно, то необходимо хирургическое вмешательство.
Кровоизлияния в головной и спинной мозг и их оболочки при гемофилии почти всегда связаны либо с травмами, либо с приемом препаратов, нарушающих гемостатическую функцию тромбоцитов. Между моментом травмы и развитием кровоизлияния может быть светлый промежуток продолжительностью от 1-2 ч до суток.
Характерным симптомом, отличающим гемофилию от другой патологии, является длительное кровотечение в случае травмы и операции. Рваные раны значительно опаснее линейных разрывов. Кровотечения часто возникают не сразу после травмы, а через 1-5 ч.
Тонзиллэктомия (удаление небных миндалин) при гемофилии значительно более опасна, чем полостные хирургические операции.
Удаление зубов, особенно коренных, часто сопровождается многодневными анемизирующими кровотечениями не только из зубных лунок, но и из гематом, образовавшихся на месте инфильтрации тканей новокаином. Эти гематомы вызывают деструкцию челюсти. При гемофилии зубы следует удалять на фоне действия антигемофилических препаратов под общим наркозом. Удаление нескольких зубов лучше проводить одномоментно.
Часть осложнений при гемофилии обусловлена потерей крови, сдавлением и деструкцией тканей гематомами, инфицированием гематом. Большая группа осложнений связана также с иммунными нарушениями. Наиболее опасным из них является обнаружение в крови больных большого количества антител против фактора VIII свертывания крови (или IX), модифицирующих гемофилию в так называемую ингибиторную форму, при которой основной метод лечения - трансфузионная терапия -почти полностью утрачивает свою эффективность. Более того, повторное введение антигемофилических препаратов часто вызывает у больных быстрое нарастание количества данных антител, вследствие чего трансфузионная терапия, первоначально дававшая какой-то эффект, вскоре становится бесполезной.
Частота ингибиторной формы гемофилии колеблется от 1 до 20%, чаще - от 5 до 15%. При тяжелых формах гемофилии ингибиторы появляются в крови больных несравненно чаще, чем при легких, а у лиц старше 12 лет - намного чаще, чем в более раннем возрасте. При ингибиторных формах заметно нарушается гемостатическая функция тромбоцитов, учащаются кровоизлияния в суставы, кровь в моче, достоверно выше поражение суставов.
Из других иммуноаллергических нарушений иногда наблюдаются тромбоцитопения, изредка сочетающаяся с лейкопенией, аутоиммунная гемолитическая анемия с положительной пробой Кумбса, большая эозинофилия, амилоидоз почек.
Диагностика Нарушений коагуляционного гемостаза
Гемофилия диагностируется у всех больных с гематомным типом кровоточивости и поражением опорно-двигательного аппарата, а также при упорных поздних кровотечениях при операциях. Для ориентировочной диагностики решающее значение имеет выявление снижения интенсивности коагуляции (свертывания) крови в таких общих пробах, как время свертывания крови, активированное парциальное тромбопластиновое время, и в аутокоагуляционном тесте при нормальных показателях тромбинового и протромбинового времени.
С целью определения того, какой из факторов свертывания крови находится в дефиците, прибегают к помощи коррекционных проб, используя тест генерации тромбопластина или аутокоагуляционный тест.
Вид гемофилии можно идентифицировать и «тестами смешивания»: к плазме обследуемого больного последовательно в разных пробирках добавляют образцы плазмы, в которых отсутствует один из факторов свертывания (VIII, IX или XI). Отсутствие нормализации свертывания в одной из пробирок указывает на дефицит того же фактора в обеих смешиваемых плазмах, т. е. на его дефицит у больного.
Диагностика гемофилии заканчивается определением дефицита фактора в количественном отношении, что имеет значение для правильной оценки тяжести заболевания и проведения заместительной терапии.
Лечение Нарушений коагуляционного гемостаза
Основным методом лечения и профилактики гемофилических кровотечений любой локализации и любого происхождения является внутривенное введение достаточных доз препаратов крови, содержащих фактор VIII. Фактор VIII изменчив и практически не сохраняется в консервированной крови, нативной и сухой плазме. Для заместительного лечения пригодны только прямые переливания крови от донора к больному гемофилией, а также внутривенные вливания препаратов крови с сохраненным фактором VIII (антигемофильная плазма, криопреципитат, концентраты фактора VIII разной очистки).
К прямым переливаниям от донора прибегают лишь тогда, когда врач не располагает какими-либо другими антигемофилическими препаратами. Грубой ошибкой является переливание крови от матери больного, так как она - носительница болезни и уровень фактора VIII у нее резко снижен.
Ввиду короткого периода полувыведения фактора VIII в крови больного (около 6-8 ч) переливания крови, как и переливания антигемофильной плазмы, должны повторяться не реже 3 раз в сутки. Для остановки массивных кровотечений и надежного прикрытия различных хирургических вмешательств, когда уровень антигемофильного фактора должен поддерживаться выше 30-40%, такие переливания крови и плазмы непригодны. Хотя время свертывания и время рекальцификации (насыщения крови кальцием) нормализуется у больных гемофилией при повышении концентрации фактора VIII до 3-4%, этого уровня недостаточно для предупреждения кровотечений при операциях. Следовательно, при лечении и предоперационной подготовке следует ориентироваться только на количественное определение фактора VIII (либо на аутокоагулограмму), но не на показатели общего времени свертывания, теста потребления протромбина и других методик с низким порогом чувствительности.
Равный объем антигемофильной плазмы приблизительно в 3-4 раза эффективнее свежей консервированной крови. В разовых дозах 10-15 мл/кг и в суточных 30-50 мл/кг, разделенных на 3 части (первая доза в 1,5 раза больше 2 последующих), антигемофильная плазма позволяет недолго поддерживать 10-15%-ный уровень фактора VIII. Главная опасность такого лечения - перегрузка кровообращения больного объемом, что может привести к развитию отека легкого. Использование антигемофильной плазмы в концентрированном виде не меняет ситуации, так как высокая концентрация вводимого альбумина (белка) вызывает интенсивное перемещение жидкости из тканей в кровь, вследствие чего объем циркулирующей крови увеличивается так же, как и при переливании плазмы в нормальном разведении. Концентрированная сухая антигемоVIIильная плазма имеет лишь то преимущество, что в ней более концентрирован фактор С и в малом объеме он быстрее вводится в кровоток больного. Сухую антигемофильную плазму перед употреблением разводят дистиллированной водой до 1/3-1/2 исходного объема. Лечения антигемофильной плазмой вполне достаточно для купирования большинства острых кровоизлияний в суставы (кроме наиболее тяжелых), профилактики и лечения небольших кровотечений.
Наиболее надежны и эффективны при гемофилии концентраты фактора VIII. Самым доступным из них остается криопреципитат - выделяемый из плазмы с помощью охлаждения (криоосаждения) белковый концентрат, в котором достаточно фактора VIII, фибриногена и фактора XIII, но мало альбумина и ряда других белков. Низкое содержание в препарате альбумина позволяет вводить его в кровоток больных в очень больших количествах и увеличивать концентрацию фактора VIII до 100% и более, не опасаясь перегрузки кровообращения и отека легких. Основной недостаток криопреципитата - его нестандартность по активности.
Криопреципитат нужно хранить при -20°С, что затрудняет его транспортировку. При оттаивании препарат быстро утрачивает активность. Этих недостатков лишены сухой криопреципитат и современные концентраты фактора VIII. Их можно хранить в обычном холодильнике и применять в полевых условиях.
За единицу активности антигемофилического препарата принимается то количество фактора VIII, которое содержится в 1 мл «усредненной» донорской плазмы, т. е. плазмы со 100%-ным содержанием антигемофильного глобулина.
Для купирования кровоизлияний в суставы и небольших кровотечений, в том числе и их предотвращения при удалении зубов, обычно достаточно повысить уровень фактора VIII до 15-20%. Более опасные внутренние и наружные кровотечения, а также развитие гематом в мягких тканях требуют поддержания уровня фактора VIII выше 30-40%, для чего вводят криопреципитат или другие концентраты фактора VIII по 20-30 ЕД/кг; при больших операциях и травмах, гематурии и желудочно-кишечных кровотечениях дозу криопреципитата увеличивают до 40-60 ЕД/кг, а в отдельных случаях - больше.
Вместе с тем избыточные введения криопреципитата нежелательны, так как создают высокую концентрацию фибриногена в крови, вследствие чего нарушается микроциркуляция в органах и возникает опасность тромбозов и ДВС-синдрома.
Частота введения антигемофильных препаратов определяется тем, насколько при каждом введении удалось повысить концентрацию фактора VIII в плазме. Так, если концентрация фактора была повышена до 40%, то уже через 6-8 ч она снизится до 20%, а при начальном повышении до 120% уровень 20% будет достигнут лишь через сутки. Современные концентрированные препараты фактора VIII (криопреципитат и др.) позволяют ограничиться 1-2 внутривенными введениями в сутки. Достаточный эффект заместительной терапии достигается только при соблюдении следующих условий: все антигемофилические препараты вводят внутривенно только струйно, в возможно более концентрированном виде и возможно быстрее после их расконсервирования без смешивания с другими инфузионными растворами. Одна из главных причин неудач заместительной терапии - капельное введение препаратов крови, не повышающих уровня фактора VIII в плазме.
До стойкой остановки кровотечения следует избегать введения любых кровезаменителей и гемопрепаратов (препаратов крови), не содержащих антигемофилических факторов, так как это приводит к разведению фактора VIII и снижению его концентрации.
Раннее удаление (аспирация) излившейся в сустав крови не только сразу же купирует болевой синдром, предотвращает дальнейшее свертывание крови в суставе, но и уменьшает угрозу развития и быстрого прогрессирования остеоартроза. Для предупреждения и купирования вторичных воспалительных изменений после аспирации крови врач назначает введение в сустав 40-60 мг гидроко-тизона. Поддерживающая трансфузионная терапия, проводимая в течение первых 36 дней, предотвращает дальнейшее кровотечение и позволяет рано начать занятия лечебной физкультурой, что способствует более быстрому и полному восстановлению функции пораженной конечности, предотвращает атрофию мышц.
Движения в пораженном суставе следует разрабатывать поэтапно: в первые 5-7 дней после снятия иммобилизирующей повязки выполняют активные движения как в пораженном суставе, так и в других суставах конечности, постепенно увеличивая частоту и длительность упражнений. В дальнейшем с 6-9-го дня переходят на нагрузочные упражнения, пользуясь велоэргометрами, педальными воротами для рук, эластическими тягами. И только на 11-13-й день с целью устранения остаточной тугоподвижности и ограничений максимального сгибания или разгибания с осторожностью под контролем переливаний антигемофильной плазмы или небольших доз криопреципитата выполняют пассивные нагрузочные упражнения.
Одновременно с 5-7-го дня назначают физиотерапевтические воздействия -электрофорез гидрокортизона, анодную гальванизацию.
При кровоизлияниях в мягкие ткани необходима более интенсивная, чем при кровоизлияниях в суставы, терапия антигемофилическими препаратами. При анемизации больного дополнительно назначают переливания эритроцитной массы. Если возникают признаки инфицирования гематомы, то немедленно назначают антибиотики широкого спектра действия. Любые внутримышечные инъекции при гемофилии противопоказаны, так как могут стать причиной обширных гематом и псевдоопухолей. Пенициллин и его полусинтетические аналоги также нежелательны, поскольку в больших дозах вызывают дисфункцию тромбоцитов и усиливают кровоточивость.
Ранняя и интенсивная терапия антигемофилическими препаратами способствует быстрому обратному развитию гематом. Пункций гематом и аспирации из них крови следует избегать. Продолжают трансфузионную терапию от 5-7 до 14 дней. Осумковавшиеся гематомы удаляют, если это возможно, хирургическим путем вместе с капсулой под прикрытием интенсивной терапии концентратами антигемофилических факторов.
При носовых кровотечениях врачу не следует прибегать к тугой тампонаде, особенно задней, так как непосредственно после удаления тампонов кровотечение у таких больных практически всегда возобновляется с еще большей силой.
Для как можно более быстрой остановки носового кровотечения необходимо применять антигемофильную плазму, а также антигемофилические препараты в комбинации с орошением слизистой оболочки носа раствором аминокапроновой кислоты, тромбина или адроксоном.
Серьезную опасность для больных представляют почечные кровотечения, при которых неэффективны переливания антигемофильной плазмы и малых доз криопреципитата. Рекомендуемые средние дозы антигемофилических препаратов (30-40 ЕД/кг) также не всегда купируют эти кровотечения либо останавливают их максимум на 1-2 дня. Усиливает эффективность применения антигемофилических препаратов преднизолон (20-30 мг/сут для взрослых больных).
Для купирования желудочно-кишечных кровотечений следует пользоваться большими дозами концентратов антигемофилических факторов совместно с аминокапроновой кислотой дозировкой до 0,2 г/кг.
Стоит отметить, что использования преднизолона при кровотечениях в желудочно-кишечном тракте необходимо избегать, наиболее опасно применение преднизолона при язвенной болезни как желудка, так и двенадцатиперстной кишки.
Следует помнить, что желудочные кровотечения часто провоцируются приемом в связи с болями в суставах, зубной или головной болью ацетилсалициловой кислоты, бруфена, индометацина, бутазолидонов. У больных гемофилией даже однократный прием ацетилсалициловой кислоты может вызвать желудочное кровотечение.
В профилактике и лечении хронических остеоартрозов и других поражений опорно-двигательного аппарата следует предусматривать различные способы защиты суставов и предупреждения травм конечностей. Для этого в одежду вшивают поролоновые щитки вокруг коленных, голеностопных и локтевых суставов, запрещают все виды спорта, связанные с прыжками, падениями и ушибами (в том числе езду на велосипеде и мотоцикле). Немаловажную роль играют как можно более раннее и полноценное лечение острых кровоизлияний в мышцы и суставы, интенсивная круглогодичная лечебная физкультура. Для этого составляют комплексы из атравматических упражнений в воде, на мягких матах и нагрузочных аппаратах - велоэргометрах, ручных воротах. Занятия нужно начинать в дошкольном или младшем школьном возрасте, т. е. до того, как развились хронические остеоартрозы, нарушения подвижности и другие тяжелые нарушения опорно-двигательного аппарата.
Комплексное лечение дополняют физиотерапевтическими (токи высокой частоты, электрофорез глюкокортикостероидов) и бальнеологическими методами терапии, к которым относятся: грязелечение, рапные и радоновые ванны. При частых и упорно повторяющихся кровоизлияниях в одни и те же суставы методами выбора являются рентгенотерапия и синовэктомия (удаление синовиальной оболочки сустава).
Рентгенотерапию проводят при разовой дозе от 25-50 Р (при острых кровоизлияниях) до 50-100 Р при хроническом остеоартрозе. Сеансы повторяют через 1-2 дня, суммарная доза колеблется от 400 до 1000 Р. У детей моложе 14 лет необходима определенная осторожность из-за возможности повреждения зон роста костей, в связи с чем суммарная доза не должна превышать 400 Р. В последние годы применяется и внутреннее облучение путем введения в суставы радиоактивных изотопов.
Синовэктомия, выполняемая через один разрез, - высокоэффективный метод лечения гемофилических поражений суставов, предупреждения тяжелых остеоартрозов. Данный тип лечения устраняет последующие кровоизлияния в прооперированный сустав, гарантирует сохранение его нормальной конфигурации и функции. Такой эффект выражен при сравнительно раннем выполнении операции - при артрозе I - II степеней, а при поражениях III - IV степеней синовэктомия, как правило, уже нецелесообразна. Как и все другие хирургические вмешательства, синовэктомия выполняется на фоне применения криопреципитата или других концентратов антигемофилических факторов.
Из других ортопедических вмешательств чаще выполняют ахиллопластику, удлинение костей с целью восстановления суставной щели, в запущенных случаях - замыкание суставов компрессией в физиологическом положении. Неоценимую услугу при этом оказывают аппараты Волкова - Оганесяна, Илизарова и других авторов, позволяющие надежно и быстро получить коррекцию без чрезвычайно опасной для больных длительной иммобилизации конечностей. Восстановление суставной щели без использования этих аппаратов вообще практически невозможно.
При достаточной заместительной терапии криопреципитатом (в первые 7-8 дней - 30-40 ЕД/(кг Ч сут), затем - вдвое меньшие количества) у больных обеспечивается вполне надежный гемостаз; кровотечения и кровоизлияния в местах проведения спиц не наблюдаются.
Современные методы заместительной терапии и использование ортопедических аппаратов коренным образом изменили прогноз при переломах костей у больных гемофилией. Если еще недавно такие переломы плохо заживали, часто осложнялись ложными суставами и даже вели к потере конечности, то под влиянием больших доз криопреципитата при одновременном сближении и хорошей фиксации костей с помощью упомянутых выше аппаратов обеспечивается заживление переломов в обычные сроки.
К нерешенным терапевтическим проблемам относится борьба с остеопорозом, внутрикостными кистами и псевдоопухолями, не имеющими тенденции к осумкованию. Эти процессы дают тяжелые осложнения и иногда заставляют прибегать к ампутации конечности.
Лечение осложненных форм гемофилии . Наиболее опасным является обнаружение в крови больных с гемофилией большого количества антител против фактора VIII, которые определяют трансформацию гемофилии в ингибиторную форму. Ингибитор способен инактивировать очень большие количества вводимого извне фактора VIII, в связи с чем основной метод лечения - заместительная трансфузионная терапия - становится малодейственным или совсем неэффективным.
В процессе трансфузионной терапии (с 4-6-го дня) титр антител может резко возрасти.
Если заместительная терапия нужна по жизненным показаниям, то временно преодолеть действие антител удается введением огромных количеств концентрата фактора VIII (по 500-1000 ЕД/кг) или плазмаферезом (удаление у больного нескольких литров плазмы с заменой ее свежей антигемофильной) вместе с введениями мегадоз фактора VIII.
Более перспективным оказалось применение при ингибиторной форме гемофилии А так называемого обходного лечения - введения концентратов факторов IX, X и II. Их применение в средних дозах обеспечивает у половины больных ингибиторной гемофилией остановку кровотечения. Вместе с тем известна тромбогенность этих препаратов, их способность провоцировать развитие ДВС-синдрома и тромбозов, особенно при одновременном применении аминокапроновой кислоты и других гемостатиков. Могут развиться такие нарушения и при обходной терапии ингибиторной формы гемофилии. Так, например, описаны случаи развития инфаркта миокарда у молодых больных гемофилией при повторном применении концентратов факторов протромбинового комплекса. По данным ряда авторов, при ингибиторной гемофилии эффективнее не обычные, а так называемые активированные препараты протромбинового комплекса или комплекса фактора IX. Однако они в 10 и более раз дороже неактивированных концентратов этих же факторов. Для уменьшения опасности развития ДВС-синдрома и тромбозов рекомендуется вводить эти факторы с антитромбином III или с предварительно глубоко замороженной плазмой вместе с небольшими дозами контрикала.
Данные о влиянии преднизолона на количество антител в крови противоречивы, но большинство авторов все же отмечают, что у больных гемофилией такое лечение редко бывает эффективным. Иммунодепрессанты (азатиоприн и др.) чаще снижают количество антител, но их применение опасно из-за развития тромбоцитопении, которая при гемофилии может существенно усугубить геморрагические явления.
Если у больных с ингибиторной формой гемофилии отсутствует положительная динамика, то при проведении заместительной терапии перед хирургическими вмешательствами всегда нужно тщательно проверять, присутствует ли указанный ингибитор в плазме.
При обострении вторичного ревматоидного синдрома, а также при проведении курсов интенсивной заместительной терапии, особенно если она не ослабляет, а усиливает боли в суставах, хороший эффект дает преднизолон (20-40 мг в день в течение месяца с последующим постепенным снижением дозы до минимума).
Большое значение в профилактике кровотечений имеет сведение к минимуму с раннего детского возраста опасности травм, порезов и т. д. Из обихода исключают легко ломающиеся игрушки (в том числе металлические и пластмассовые), а также неустойчивые и тяжелые предметы. Мебель должна быть с закругленными гранями, выступающие края обматывают ватой или поролоном, пол покрывают ворсовым ковром. Предпочтительнее общение и игры больных с девочками, а не с мальчиками.
Для больного важен правильный выбор профессии и места работы. В наиболее тяжелых случаях единственным эффективным методом смягчения болезни служит систематическое, один раз в 10 дней, внутривенное введение криопреципитата или любого иного имеющегося в наличии концентрата фактора VIII. Разовая доза препарата при такой профилактике составляет 400-800 ЕД.
Огромное значение для предупреждения тяжелых поражений опорно-двигательного аппарата имеет как можно более раннее введение препаратов фактора VIII при ушибах и других травмах, а также при проявлении острой боли в суставе, говорящей о том, что в него началось подтекание крови. Немедленное введение концентратов антигемофилических факторов (специальной бригадой «Скорой помощи» или гемофилического центра либо прошедшими обучение родителями больного) обрывает образование или обострения кровоизлияний в самом начале, предотвращает деструктивные изменения в суставе. Неотложная доврачебная помощь - важнейший компонент физической реабилитации больных, профилактики тяжелых и необратимых изменений в суставах, костях и мышцах. Она резко уменьшает число госпитализаций, среднегодовую длительность пребывания в больнице, не отрывает детей от учебы.
С интенсификацией заместительной трансфузионной терапии увеличивается число инфицированных вирусом сывороточного гепатита, учащаются тяжелые реакции на введение гемопрепаратов и возникает ряд других иммунных нарушений.
Генопрофилактика гемофилии пока не разработана. Определение пола путем исследования полового хроматина и кариотипа амниотических клеток, полученных методом амниоцентеза, позволяет своевременно прервать беременность, но не показывает, является ли плод носителем гемофилического гена. Беременность сохраняют, если плод мужского пола, так как все сыновья больных рождаются здоровыми, и прерывают, если плод женского пола, поскольку все дочери больных гемофилией являются носителями заболевания.
У женщин - носителей гемофилии, имеющих 50%-ную вероятность родить больного (если плод мужского пола) или передатчицу гемофилии (если плод женского пола), рождение только девочек переносит опасность появления в семье больных гемофилией с первого поколения на второе, а также одновременно увеличивает общее число носителей заболевания.
Минздрав РФ одобрило препарат Револейд (Элтромбопаг) к применению у детей. Новый препарат показан пациентам страдающим хронической иммунной тромбоцитопенией (идиопатической тромбоцитопенической пурпурой, ИТП), редким заболеванием системы крови.
03.03.2017
Канадские ученые из университета в Оттаве намерены произвести революцию в восстановительной медицине. В одном из последних экспериментов им удалось вырастить человеческое ухо из обычного яблока.
27.02.2017
Специалисты Первого медицинского университета имени Павлова в Санкт-Петербурге создали наночастицы с помощью которых возможна диагностика инфарктных и пред инфарктных состояний больного. Так же в перспективе исследований, наночастицы будут применяться...
Медицинские статьи
Почти 5% всех злокачественных опухолей составляют саркомы. Они отличаются высокой агрессивностью, быстрым распространением гематогенным путем и склонностью к рецидивам после лечения. Некоторые саркомы развиваются годами, ничем себя не проявляя...
Вирусы не только витают в воздухе, но и могут попадать на поручни, сидения и другие поверхности, при этом сохраняя свою активность. Поэтому в поездках или общественных местах желательно не только исключить общение с окружающими людьми, но и избегать...
Вернуть хорошее зрение и навсегда распрощаться с очками и контактными линзами - мечта многих людей. Сейчас её можно сделать реальностью быстро и безопасно. Новые возможности лазерной коррекции зрения открывает полностью бесконтактная методика Фемто-ЛАСИК.
Косметические препараты, предназначенные ухаживать за нашей кожей и волосами, на самом деле могут оказаться не столь безопасными, как мы думаем
Комплекс механизмов, поддерживающий кровь в жидком состоянии, без ее свертывания в просвете сосуда или просачивания через сосудистую стенку, получил название гемостаза. Так как патологические состояния, связанные со свертыванием крови разбираются в следующей лекции, то здесь следует рассмотреть другие изменения, связанные с нарушениями гемостаза.
Кровотечением (геморрагией, от греч. haima - кровь и rhein - течь) называется выход крови за пределы сосудистого русла или сердца в окружающую среду (наружное кровотечение) или в полости тела, просвет полого органа (внутреннее кровотечение). Примерами наружного кровотечения являются метроррагия (маточное), мелена (кишечное), а внутреннего - гемоперикард, гемоторакс, гемоперитонеум и гемартроз (в полость перикарда, плевры, брюшной полости или сустава соответственно).
В зависимости от источника кровотечения делятся на артериальные, венозные, артериально-венозные (смешанные), капиллярные, паренхиматозные (капиллярные из паренхиматозных органов) и сердечные.
Частным видом кровотечения является кровоизлияние, при котором кровь накапливается экстраваскулярно в тканях. Различают четыре его разновидности:
Гематома - кровоизлияние с нарушением целостности тканей и образованием полости;
Геморрагическое пропитывание (инфильтрация) - кровоизлияние с сохранением целости ткани;
Кровоподтек (синяк) - плоскостное кровоизлияние в коже, подкожной клетчатке, слизистых оболочках;
Петехии - точечные кровоизлияния в коже, слизистых и серозных оболочках, внутренних органах.
Множественные петехиальные кровоизлияния, сливающиеся между собой в более крупные по размерам, называют геморрагической пурпурой, а кровоподтек до 2 см диаметром - экхимозом.
К механизмам развития как кровотечений, так и кровоизлияний относят:
Разрыв (haemorragia per rhexin), возникающий вследствие травм неизмененного сосуда или некроза (разрыв сердца при инфаркте миокарда), воспаления (сифилитический мезаортит с разрывом аорты), аневризмы пораженной сосудистой стенки;
Разъедание (haemorragia per diabrosin), или аррозивное кровотечение, развивающееся при разрушении сосудистой стенки воспалением (чаще гнойным), злокачественной опухолью, некрозом (казеозный некроз в кровоточащей туберкулезной каверне), воздействии химических веществ (желудочный сок может вызвать кровотечение из язвы желудка), прорастании ворсинами хориона сосудов маточной трубы при внематочной беременности;
Диапедез (haemorragia per diapedesin, от греч. dia - через, pedao - скачу), отличающийся выходом крови за счет повышения сосудистой проницаемости, как правило, сохранных сосудов микроциркуляторного русла при тяжелой гипоксии, интоксикации, инфекции, различных коагулопатиях, геморрагических диатезах. Сравнительно часто диапедезные кровоизлияния развиваются при гипертоническом кризе, системных васкулитах, лейкозах, гемофилии, уремии.
Склонность к спонтанным кровотечениям или кровоизлияниям в ответ даже на незначительное повреждение получило название геморрагического диатеза. Такое состояние связано с качественными или количественными изменениями тромбоцитов, недостаточностью гемокоагуляции, патологической ломкостью или повышенной проницаемостью сосудистой стенки как наследственными, так и приобретенными.
Основными причинами кровотечений (кровоизлияний) являются:
1. Повышенная ломкость сосудистой стенки отмечается при врожденных ее дефектах, инфекциях и интоксикациях, гипо- и авитаминозах, стероидной терапии;
2. Дефекты тромбоцитов. К ним относятся тромбоцитопении любого генеза, наследственные или приобретенные ослабления адгезии (болезни фон Виллебранда, Бернара-Сулье, наследственный геморрагический диатез и др.), ослабленная агрегация или уменьшение секреции тромбоцитов;
3. Недостаточность факторов коагуляции врожденного (гемофилия А по фактору VIII, гемофилия В по фактору IX, болезнь фон Виллебранда, по другим факторам свертывания крови) или чаще приобретенного происхождения (при заболеваниях печени, дефиците витамина К, некоторых иммунных поражениях);
4. Избыточная внутрисосудистая коагуляция, например, при диссеминированном внутрисосудистом свертывании крови - ДВС-синдроме (см. следующую лекцию).
Исход кровоизлияний может быть благоприятным (рассасывание излившейся крови, организация, инкапсуляция, образование "ржавой" кисты) и неблагоприятным (нагноение при присоединении инфекции).
Значение кровотечения обусловлено его видом, выраженностью и продолжительностью. Так, разрыв сердца при инфаркте миокарда с формированием гемоперикарда быстро приводит к смерти больного, хотя общее количество излившейся крови составляет обычно не более 100-200 г. При артериальном кровотечении может развиться массивная кровопотеря и острое малокровие с летальным исходом. Длительное небольшое кровотечение из хронической язвы желудка или двенадцатиперстной кишки обусловливает хроническую постгеморрагическую анемию. Значение кровоизлияния зависит, прежде всего, от его локализации и лишь затем от его размеров. Даже небольшое кровоизлияние в головной мозг может вызвать поражение жизненно важных центров, отек мозга и смерть больного, тогда как даже массивные неосложненные кровоизлияния в подкожную клетчатку не представляют опасности для жизни.
Плазморрагия - выход из просвета сосуда плазмы крови с пропитыванием окружающих тканей (плазматическое пропитывание) вследствие повышенной сосудистой проницаемости. Плазморрагия происходит трансэндотелиально за счет ультрафильтрации (выход плазмы через поры базальной мембраны эндотелия за счет повышения гидростатического или осмотического давления), диффузии (обусловленной градиентом плазменных компонентов в просвете и вне сосуда), микровезикулярного транспорта (микропиноцитоз или цитопемзис, происходящий вследствие активности ферментативных систем эндотелиоцитов). Возможен и интерэндотелиальный выход плазмы. Таким образом, плазморрагия определяется повреждением сосудистой стенки (прежде всего ее интимы) и изменением констант крови. При морфологическом исследовании стенка сосудов микроциркуляторного русла утолщается, становится гомогенной, а при электронно-микроскопическом исследовании в набухших эндотелиоцитах отмечается большое количество микровезикул, образование фенестр и туннелей, появление межклеточных щелей, разрыхление базальной мембраны интимы. Накопление плазменных компонентов приводит к повреждению клеток и межклеточного вещества как в сосудистой стенке, так и периваскулярных тканях, в исходе которого развивается гиалиноз, а в тяжелых случаях - фибриноидный некроз.
Шок - тяжелое патологическое состояние, характеризующееся циркуляторным коллапсом (острой недостаточностью кровообращения) после сверхсильного воздействия на гемостаз. Различают гиповолемический, кардиальный, септический и сосудистый типы шока.
Гиповолемический шок обусловлен быстрым уменьшением на 20% и более объема циркулирующей крови, что отмечается при острой кровопотере, обезвоживании. Так, потеря жидкости и электролитов возможна при обширных ожогах (вследствие выхода плазмы из поврежденных микроциркуляторных сосудов), при тяжелой рвоте, профузной диарее.
Кардиальный шок развивается в ответ на снижение ударного объема при поражении сердца, наблюдается при инфаркте миокарда, тяжелом миокардите, острой митральной или аортальной недостаточности, тромбозе протезированного клапана, разрыве межжелудочковой перегородки, гемотампонаде сердечной сорочки. Выраженное падение артериального давления приводит к значительному снижению кровенаполнения тканей, аналогичному гипо- волемическим изменениям.
Септический (токсико-инфекционный) шок возникает при наличии инфекции, вызванной грамотрицательной (Е. coli, Proteus, Klebsiella и др.) реже грамположительной (стафило-, стрепто-, пневмококки) микрофлорой. Выделяемые токсины (прежде всего эндотоксины) активируют системы комплемента, коагуляции, фибринолиза, а также тромбоциты и нейтрофилы. В результате стимулируются образование оксида азота (мощного вазодилятатора), фактора некроза опухолей а, интерлейкинов, вызывающих острую недостаточность кровообращения.
Сосудистый (перераспределительный) шок может быть нейрогенным (травматическим, болевым, при повреждении спинного мозга, как осложнение наркоза) или анафилактическим, вызванным генерализованными реакциями гиперчувствительности. Вследствие выраженной вазодилатации, повышения проницаемости капилляров и артериовенозного сброса происходит перераспределение внутрисосудистого объема крови, сопровождающееся значительным снижением общего периферического сосудистого сопротивления.
Шок в своем развитии проходит три стадии:
1. Непрогрессирующая (ранняя) стадия шока характеризуется снижением давления крови и объема сердечного выброса с сохранением относительно нормального кровенаполнения жизненно важных органов. Это происходит за счет компенсаторной вазоконстрикции сосудов, прежде всего кожи и кишечника. При истощении адаптивных механизмов шок переходит в следующую стадию;
2. Прогрессирующая стадия шока отличается выраженной клинической симптоматикой, глубоким коллапсом, обусловленным пониженным кровенаполнением всех органов и тканей (тканевой гипоперфузией из-за увеличивающейся артериальной дилата- ции), развитием метаболических и циркуляторных расстройств. 3. В необратимую стадию шока наблюдается выраженная недостаточность кровообращения на уровне микроциркуляторного русла с нарушением целостности сосудистой стенки, быстро нарастающей полиорганной недостаточностью, заканчивающейся смертью больного.
При морфологическом исследовании отмечаются генерализованные дистрофические и некротические изменения, явления ДВС-синдрома (петехиальные кровоизлияния, стаз, тромбы в микроциркуляторном русле). Помимо этого в связи с особенностями строения и функционирования различных органов в каждом из них возникают своеобразные изменения - шоковые органы. Так, для шоковой почки характерно развитие некротического нефроза (некроза эпителия извитых канальцев). Шоковое легкое проявляется очагами ателектазов, серозно-геморрагического отека, иногда с выпадением нитей фибрина (гиалиновые мембраны). В мозгу возникает ишемическая энцефалопатия, проявляющаяся отеком, точечными кровоизлияниями и очагами некроза. В сердце наблюдают мелкие, преимущественно субэндокардиальные очаги кровоизлияний и некроза миокарда, жировую дистрофию кардиомиоцитов с явлениями их пересокращения. В корковом слое надпочечников происходит уменьшение вплоть до полного исчезновения липидов, использующихся для синтеза стероидных гормонов. В желудочно-кишечном тракте обнаруживают кровоизлияния, эрозии и острые язвы в слизистой оболочке. Шоковая печень отличается жировой дистрофией гепатоцитов, а в отдельных случаях даже их центролобулярным некрозом.
Прогноз шока зависит от его типа, тяжести, стадии, на которой начато лечение, наличия осложнений. В настоящее время при тяжелом кардиогенном или септическом шоке летальность достигает 50% и выше.
Ключевые понятия нарушения гемостаза:
1. Нарушения гемостаза, коагулопатия
(coagulopathia, коагуло- + греч. patos – страдание,болезнь) – нарушение функции свёртывающей и противосвёртывающей систем крови.
2. Гиперкоагуляционно-тромботическое состояние
– состояние, сопровождающееся патологическим процессом усиления свёртываемости крови вследствие повышенной агрегации тромбоцитов, активации плазменных и тканевых факторов свёртывания крови с образованием тромбоцитарного и фибринового сгустков.
3. Гипокоагуляционно-геморрагическое состояние
– состояние, сопровождающееся патологическим процессом уменьшения свёртываемости крови вследствие снижения агрегации тромбоцитов, инактивации плазменных и тканевых факторов свёртывания крови с возникновением кровоточивости и кровотечений.
4. ДВС-синдром (тромбо-геморрагическое состояние)
– синдром диссеминированного внутрисосудистого свёртывания крови – типический патологический процесс нарушения гемостаза в результате последовательно протекающих реакций свёртывания крови: гиперкоагуляции (образование диссеминированных тромбов в микроциркуляторной сосудистой сети) и гипокоагуляции (истощение тромбогенных факторов и усиление фибринолиза), сопровождающихся массивным кровотечением, тяжёлым гемокоагуляционным шоком и острой дистрофией внутренних органов.
При каких заболеваниях возникает нарушение гемостаза:
Гемостаз - это сложный процесс, который предотвращает или останавливает истечение крови из просвета сосуда, обеспечивает возникновение свертка фибрина, необходимого для восстановления целостности ткани, и, наконец, удаляет фибрин, когда нужда в нем отпадает. В этом процессе участвуют четыре основных физиологических механизма.
С помощью системы гемостаза кровь выполняет свою важнейшую функцию - поддержание жидкого состояния крови, протекающей в кровеносных сосудах, и свертывание крови при нарушении целостности сосудистой стенки и, тем самым, прекращение кровотечения и сохранение объема и состава крови. Система гемостаза многокомпонентна. В ней участвуют тромбоциты и другие клетки крови, сосудистая стенка, экстраваскулярная ткань, биологически активные вещества (тромбоцитарно-сосудистый гемостаз), плазменные, тканевые факторы свертывания крови (коагуляционный гемостаз), находящиеся в тесном взаимодействии с противосвертывающей, фибринолитической и калликреин-кининовой системами. Нарушение любого из этих компонентов ведет к патологии гемостаза.
Классификация нарушения гемостаза. Патология гемостаза классифицируется по преимущественному поражению различных его компонентов на нарушения тромбоцитарно-сосудистого гемостаза и коагуляционного гемостаза. По этиологии эти нарушения могут быть приобретенными и наследственными, а по направленности изменений подразделяться на понижение свертывания крови (гипокоагуляцию) и повышение свертывания крови (гиперкоагуляцию), которое может быть локальным (тромбоз) и генерализованным (ДВС-синдром).
Понижение свертывания крови
Понижение свертывания крови проявляется повышенной кровоточивостью (геморрагическим синдромом) - повторными кровотечениями, кровоизлияниями, возникающими как самопроизвольно, так и при незначительных травмах.
Тромбоцитарно-сосудистый гемостаз нарушается при количественных и качественных изменениях тромбоцитов (тромбоцитопениях и тромбоцитопатиях), а также поражениях сосудистой стенки.
Тромбоцитопенией называется уменьшение содержания тромбоцитов в крови ниже нормы (180-320 Г/л или 180-320x109/л). Однако спонтанные кровотечения возникают лишь при снижении их числа меньше 30 Г/л. Под тромбоцитопатиями понимают качественную неполноценность и дисфункцию тромбоцитов при нормальном или пониженном их содержании.
Причины пониженного свертывания крови. Причиной возникновения тромбоцитопении нередко являются иммунные реакции при изменении антигенной структуры тромбоцитов под действием вирусов, лекарственных препаратов, выработке антитромбоцитарных аутоантител (при хроническом лимфолейкозе, идиопатической тромбоцитопении), несовместимости тромбоцитарных антигенов матери и плода. Кроме того, тромбоцитопения развивается вследствие поражения мегакариоцитарного ростка костного мозга ионизирующей радиацией, химическими веществами или вытеснения его опухолевыми метастазами, лейкозными инфильтратами. Снижение тромбоцитопоэза может быть обусловлено дефицитом цианокобаламина и фолиевой кислоты, наследственным дефектом образования тромбоцитов (в том числе при дефиците тромбоцитопоэтинов). Тромбоцитопения возникает в результате механического повреждения тромбоцитов при спленомегалии, искусственных клапанах сердца, а также усиленного потребления тромбоцитов при локальном и генерализованном внутрисосудистом свертывании крови.
К этиологическим факторам, вызывающим тромбоцитопатию, относятся действие токсических веществ и лекарственных препаратов (алкоголь, ацетилсалициловая кислота), ионизирующей радиации, эндогенных метаболитов (при уремии, циррозе печени); дефицит цианокобаламина, гормональные нарушения (гипотиреоз). Наблюдаются и генетические дефекты структуры мембраны и биохимического состава тромбоцитов (дефицит тромбостенина, фактора 3, АТФ, АДФ, Г-6-ФДГ, мембранных рецепторов для факторов V, VIII, XI и др.).
При геморрагических вазопатиях поражение сосудистой стенки, приводящее к нарушению тромбоцитарно-сосудистого гемостаза и кровоточивости, возникает вследствие повышения проницаемости стенки кровеносных сосудов и ее деструкции при нарушении синтеза коллагена (при алиментарном дефиците аскорбиновой кислоты, наследственных дефектах синтеза коллагена), при действии биологически активных веществ (аллергия), радиотоксинов (лучевая болезнь), иммунных геморрагических васкулитах, снижении ангиотрофической функции тромбоцитов при тромбоцитопениях и тромбоцитопатиях, разрушении сосудистой стенки лейкозными инфильтратами. Одной из причин кровоточивости является уменьшение выработки эндотелием сосудистой стенки фактора Виллебранда - крупномолекулярного компонента VIII фактора свертывания-крови (наследственная болезнь Виллебранда). Этот фактор накапливается в тромбоцитах и освобождается при их дегрануляции.
Он необходим для нормальной адгезии тромбоцитов к коллагену стенки, и без него не формируется тромбоцитарный тромб. Геморрагический синдром наблюдается и при усилении перекисного окисления мембранных фосфолипидов, в результате чего в эндотелии синтезируется и секретируется избыточное количество мощных ингибиторов агрегации тромбоцитов - простациклинов. Кроме того, к снижению тромбоцитарно-сосудистого гемостаза приводит нарушение нейрогенной и гуморальной регуляции сосудистого тонуса, понижение которого ведет к невозможности закупорки мелких сосудов тромбоцитарным тромбом.
Патогенез пониженного свертывания крови. Выделяют четыре основных механизма возникновения тромбоцитопений: уменьшение продукции, усиленное разрушение, повышенное потребление (тромбообразование), перераспределение тромбоцитов.
Нарушение гемостаза и развитие кровоточивости при тромбоцитопении обусловлено следующими механизмами:
- повышением проницаемости микрососудов для эритроцитов и других составных частей крови (диапедезная геморрагия) и ломкости сосудов вследствие дистрофии стенки при выключении ангиотрофической функции тромбоцитов;
- уменьшением адгезивно-агрегационной функции тромбоцитов;
- нарушением реакции освобождения тромбоцитарных факторов свертывания крови, АДФ, серотонина, адреналина, антигепаринового фактора, следствием чего является недостаточное формирование тромбоцитарного тромба, отсутствие спазма сосудов и замедление свертывания;
- уменьшением ретракции сгустка в результате снижения активности сократительного белка тромбоцитов - тромбостенина (фактор 8 тромбоцитов).
В патогенезе тромбоцитопатий можно выделить два основных механизма их возникновения - продукция патологических тромбоцитов в костном мозге и деструкция тромбоцитов во всех отделах системы крови. Патогенез нарушения тромбоцитарно-сосудистого гемостаза при тромбоцитопатиях такой же, как и при тромбоцитопениях, так как связан с выключением функций тромбоцитов.
Нарушение коагуляционного гемостаза, приводящее к развитию кровоточивости, может быть вызвано следующими факторами:
- приобретенным и наследственным уменьшением или извращением синтеза плазменных и тромбоцитарных факторов свертывания крови и компонентов калликреин-кининовой системы;
- ингибированием или повышенным потреблением этих факторов;
- увеличением эндогенных антикоагулянтов;
- активизацией фибринолитической системы;
- передозировкой антикоагулянтов, фибринолитических и дефибринирующих препаратов. Все это лежит в основе нарушения одной из трех фаз свертывания крови и ретракции сгустка или же сочетанного их изменения.
Причинами нарушения первой фазы свертывания крови - образования тромбопластина - является снижение продукции факторов (IX, X) при патологии печени, образование антител к некоторым факторам (VIII, IX) при заболеваниях, в патогенезе которых имеется аутоиммунный компонент (лейкозы, коллагенозы), или же передозировка такого универсального антикоагулянта, как гепарин. Известны генетические дефекты синтеза VIII, IX и XI факторов, дефицит которых лежит в основе развития гемофилии (соответственно последовательности этих факторов - гемофилии А, В и С).
Нарушение второй фазы свертывания крови - образования тромбина - возникает не только при заболеваниях печени, но и при гипо- и авитаминозах К, когда тоже понижается синтез в печени факторов II, V, VII, участвующих в этой фазе (при механической желтухе, энтерите, обширной резекции тонкой кишки, лекарственном дисбактериозе). Возможно появление иммунных ингибиторов факторов V, VII (например, при лечении стрептомицина сульфатом), усиленное их выведение почками, наследственный дефицит (фактора V при парагемофилии) или же инактивация компонентами противосвертывающей системы - антитромбинами, гепарином (при анафилактическом шоке, передозировке гепарина).
Геморрагический диатез, связанный с нарушением третьей фазы свертывания - фазы образования фибрина, возникает при уменьшении синтеза фибриногена в пораженных патологическим процессом печени, легких или же в результате наследственной гипо-, афибриногенемии и дефицита фибринстабилизирующего фактора (фактора XIII). Однако значительно чаще нарушение третьей фазы является следствием усиления фибринолиза при травме (операции) легких, матки, поджелудочной железы; ожоге, шоке. Это обусловлено повышенным поступлением в кровь активаторов профибринолизина (плазминогена) - тканевых, микробных фибринокиназ, лейко- и эритроцитарных активаторов, компонентов калликреин-кининовой системы и системы комплемента комплексов гепарина с фибриногеном, профибринолизином и адреналином (эти комплексы обеспечивают неферментативный фибринолиз, по Б. А. Кудряшову).
Патогенез. Главными звеньями в патогенезе геморрагического диатеза, развившегося при нарушении любой из фаз свертывания крови, являются хроническая кровопотеря и ее последствия, а также структурные и функциональные изменения в месте кровоизлияний (в суставах, внутренних органах, коже и других тканях).
Повышение свертывания крови
Повышение свертывания крови проявляется локальным (тромбоз) или генерализованным внутрисосудистым свертыванием крови, в основе чего лежит нарушение тромбоцитарно-сосудистого и коагуляционного гемостаза.
Гиперкоагуляция может быть обусловлена:
- повышением функциональной активности системы свертывания крови за счет увеличенного - - поступления в кровь прокоагулянтов и активаторов свертывания крови;
- увеличением в крови содержания тромбоцитов;
- снижением антитромботических свойств сосудистой стенки;
- уменьшением активности противосвертывающей системы крови;
- ослаблением фибринолиза.
Генерализованное (диссеминированное) внутрисосудистое свертывание крови (ДВС-синдром) - тяжелое нарушение гемостаза, возникающее при избыточном поступлении в кровь прокоагулянтов и активаторов свертывания крови, что ведет к образованию множественных микротромбов в сосудах микроциркуляторного русла, а затем развитию гипокоагуляции, тромбоцитопении и геморрагии в результате "потребления" факторов системы свертывания и повышения функциональной активности системы противосвертывания и фибринолиза крови с последующим истощением всех трех систем.
Этиология. Универсальность и неспецифичность ДВС-синдрома обусловлены многообразием причинных факторов его возникновения. К ним относятся прежде всего генерализованные инфекции и септические состояния, все виды шока, травматические хирургические операции, акушерская патология (преждевременная отслойка, ручное отделение плаценты), острый внутрисосудистый гемолиз, уремия при почечной недостаточности, все терминальные состояния.
Патогенез. Главным звеном в патогенезе генерализованной гиперкоагуляции является нарушение баланса между калликреин-кининовой, свертывающей, противосвертывающей и фибринолитической системами крови при поступлении в сосудистое русло большого количества прокоагулянтов и их активаторов. Это и приводит к нарушению столь важной функции крови, как сохранение ее нормального агрегатного состояния, в результате чего в фазу гиперкоагуляции кровь в сосудах свертывается и прекращается ее циркуляция с развитием тяжелых дистрофических и функциональных нарушений в органах и тканях, нередко несовместимых с жизнью. В последующую фазу гипокоагуляции разжижение крови и потеря способности к свертыванию и агрегации тромбоцитов вызывают кровотечение, которое плохо поддается терапевтической коррекции. При благоприятном исходе наступает третья - восстановительная фаза, при которой происходит нормализация гемостаза.
 Прекрасные цветы из джинсовой ткани
Прекрасные цветы из джинсовой ткани Этнические татуировки Этнические узоры
Этнические татуировки Этнические узоры Как узнать дату зачатия: особенности, правила расчета и рекомендации
Как узнать дату зачатия: особенности, правила расчета и рекомендации